hsa-miR-204-5p对人脐静脉内皮细胞生物学行为的影响*
张义炜, 杨 英, 潘尚领
(广西医科大学基础医学院病理生理学教研室,广西 南宁 530021)
血管内皮细胞在循环系统的发育和维持中起着关键作用[1],其功能的障碍是冠状动脉粥样硬化发生的基础[2],而后者引发的冠心病(coronary heart disease, CHD)是近代以来人类最主要的死亡原因[3-4]。因此,明确内皮细胞功能障碍的机制,有助于CHD的防治,提高人类寿命。已知吸烟、熬夜等不良生活方式及高血压、糖尿病、高血脂、肥胖等基础病是血管内皮细胞损伤的重要因素,损伤所致的内皮细胞黏附因子/趋化因子表达、泡沫细胞的聚集、血脂的沉积、内皮细胞的异常增殖和凋亡[5-8],是CHD发生发展的主要过程及机制,但具体的细节及信号转导通路尚未明了。近年,高通量测序技术的进步及生物信息学的发展,让人们对非编码RNA的功能有了新的认识,它们在内皮细胞稳态失调中的作用逐渐被揭示。
微小RNA(microRNA, miRNA)是一类非编码小RNA,其主要作用方式是通过靶向结合mRNA的3’UTR区抑制靶基因的翻译或促进mRNA的降解[9]。新近有报道表明,miRNA参与调节血管生成的过程[10],而且已发现多种miRNA作为CHD的生物标志物参与CHD的发生发展。例如miR-320b通过促进p65磷酸化水平来提升促炎细胞因子水平,进而促进动脉粥样硬化[11];miR-27a和miR-329表达水平的增加可能通过下调ABCA1和ABCG1基因的表达促进动脉粥样硬化斑块的进展[12];miR-15b-5p通过抑制mTOR信号通路抑制CHD[13]。
hsa-miR-204-5p(以下简称miR-204-5p)在多个领域已被研究,其中作为肿瘤抑制因子的报道最为广泛,例如miR-204-5p可抑制甲状腺癌[14]和胃癌[15]的发生发展,其大概机制是抑制肿瘤细胞的增殖和迁移、促进肿瘤细胞的凋亡。而CHD的发生是内皮细胞的异常增殖和凋亡所致,因此,我们推测,miR-204-5p有可能会影响内皮细胞的功能状态,故本研究的主要目的是进一步了解miR-204-5p对内皮细胞迁移、增殖、周期及凋亡的影响,为防治CHD提供新的参考资料。
材料和方法
1 实验材料
人脐静脉内皮细胞株EA.hy926购自中科院上海细胞库。
2 主要试剂
胎牛血清(fetal bovine serum, FBS)购自上海逍鹏生物科技有限公司;DMEM培养液购自GIBCO;LipoFiter 3.0脂质体转染试剂购自上海汉恒生物科技有限公司;miR-204-5p mimics和mimics阴性对照(mimics-negative control, mimics-NC)购自苏州吉玛基因有限公司。hsa-miR-204-5p mimics的正义链序列为5'-UUCCCUUUGUCAUCCUAUGCCU-3',反义链序列为5'-GCAUAGGAUGACAAAGGGAAUU-3';mimics-NC的正义链序列为5'-UUCUCCGAACGUGUCACGUTT-3',反义链序列为5'-ACGUGACACGUUCGGAGAATT-3'。SanPrep Column microRNA Extraction Kit和miRNA第一链cDNA合成(加尾法)试剂盒购自上海生工生物工程股份有限公司;CCK-8试剂购自南京诺唯赞生物科技股份有限公司;磷酸盐缓冲盐溶液(phosphate-buffered saline, PBS)购自北京索莱宝科技有限公司;胰蛋白酶细胞消化液购自上海生工生物工程股份有限公司;细胞周期试剂盒和细胞凋亡试剂盒(Annexin V-APC/7AAD)均由杭州联科生物技术股份有限公司提供;75%乙醇溶液购自广西博亨医疗用品有限公司;过氧化氢(H2O2)溶液购自Sigma;AxyPrepTm Multisource Total RNA Miniprep Kit购自杭州AXYGEN 生物技术有限公司;RNA文库制备及测序由上海天昊生物科技有限公司完成。
3 主要方法
3.1 细胞转染 选择EA.hy926细胞用于分析miR-204-5p对细胞功能的影响[16]。培养基为含10% FBS的DMEM。将细胞放在37 ℃、5% CO2的细胞培养箱培养。所有操作均在超净台内进行,操作前紫外线照射30 min以上。将EA.hy926细胞接种于六孔板中,每孔4×105个细胞,待细胞汇合度达到80%左右,利用LipoFiter 3.0脂质体转染试剂转染miR-204-5p mimics和mimics-NC。转染步骤以LipoFiter 3.0脂质体转染试剂说明书为准。转染30 h左右,利用San-Prep Column microRNA Extraction Kit提取细胞miRNA,并使用miRNA第一链cDNA合成(加尾法)试剂盒将miRNA逆转录成cDNA。利用RT-qPCR测定转染效率并进行后续的细胞功能实验。RT-qPCR条件如下:95 ℃预变性600 s;随后在95 ℃ 10 s,60 ℃ 20 s,72 ℃ 10 s条件下进行40个循环;95 ℃ 5 s,60 ℃ 60 s,95 ℃ 1 s后得到熔解曲线,最后50 ℃ 30 s进行降温。miR-204-5p转染效率测定公式为2-ΔΔCt[ΔΔCt=(CtmiR-204-5pmimics-CtmiR-204-5pmimicsU6)-(Ctmimics-NCCtmimics-NCU6)]。
3.2 细胞活力实验 收集转染了miR-204-5p mimics和mimics-NC的EA.hy926细胞,调整细胞悬液浓度为4×107/L,取一96孔板,每孔加100 μL,使细胞数为每孔4 000个。每孔加10 μL CCK-8试剂,放置于细胞培养箱孵育1 h。最后,使用酶标仪分别于0、24、48、72和96 h测量细胞在450 nm处的吸光度。
3.3 细胞划痕实验 转染miR-204-5p mimics和
mimics-NC入EA.hy926细胞30 h后,用PBS洗涤一次细胞。利用1 000 μL枪头按十字线进行划痕,然后再次使用PBS洗涤两次细胞,分别于0、12、24和36 h在倒置显微镜4倍目镜/10倍物镜下拍照。利用ImageJ软件分析划痕面积。
3.4 细胞迁移实验 通过Tranwell实验进一步研究miR-204-5p对EA.hy926细胞迁移能力的影响。使用胰蛋白酶细胞消化液消化细胞。利用含2% FBS的DMEM重悬细胞,使细胞浓度为2×108/L,充分混匀后吸取100 μL细胞悬液种于小室中,将小室浸于装有500 μL含3% FBS的DMEM的24孔板内,24 h后,将小室取出,使用PBS洗涤3次后,利用甲醇固定30 min。最后,对小室外侧细胞进行结晶紫染色,8~12 h后,使用PBS洗涤3次小室,晾干后于倒置显微镜下拍照。
3.5 细胞周期实验 收集至少1×106个细胞到10 mL管中,1 000 rpm离心5 min。弃去上清液,向每管中加入1 mL预冷的PBS清洗3次,1 000 r/min离心5 min,弃去上清,加入1 mL PBS重悬细胞,随后,使用200 μL枪头吸取细胞悬液,逐滴加入到3 mL预冷的75%乙醇溶液中,边加边震荡,-20 ℃避光固定过夜;次日,将细胞拿出,1 000 r/min离心5 min,弃去上清,向每管中加入5 mL PBS清洗一次,放置15 min后1 000 r/min离心5 min;弃去上清,每个样本中加入1 mL DNA staining solution,室温下避光孵育30 min,随后使用流式细胞仪检测细胞周期。
3.6 细胞凋亡实验 首先,利用不同浓度H2O2溶液构建细胞凋亡模型,浓度梯度依次为200、400、600、800、1 000和1 200 μmol/L。使用最佳浓度H2O2溶液和转染了miR-204-5p mimics和mimics-NC的926细胞共培养24 h后,至少收集1×106个细胞,1 000 r/min离心5 min;弃去上清液,每管加入1 mL PBS,洗涤3次。留取细胞沉淀,加入500 μL 1× Binding Buffer重悬细胞,随后每管加入5 μL Annexin V-APC和10 μL 7AAD,轻轻震荡混匀后,室温避光孵育15 min,利用流式细胞仪(BD FACSC Calibur)检测细胞凋亡率。
3.7 RNA-seq 使 用AxyPrepTm Multisource Total RNA Miniprep Kit提取细胞总RNA,确保RNA总量>2 μg,浓度≥100 mg/L,A260/A230≥2.0,A260/A280在1.8~2.2之间,且Agilent 2100 Bioanalyzer检测的RIN≥6.5。以美国Illumina生物技术公司的样品制备试剂盒说明书为准构建cDNA文库。构建完成后,应用Agencourt SPRIselect核酸片段筛选试剂盒纯化文库的同时进行片段大小筛选。使用Qubit和Agilent 2100 Bioanalyzer分别检测文库浓度与文库片段长度分布。要求浓度>5 mg/L,且片段长度集中在300~400 bp之间。文库最终以2×150 bp双端测序模式在Illumina高通量测序平台进行高通量测序并获得FastQ数据。采用FastQC软件及R version 4.2.1对原始测序数据进行质量评估。使用STAR软件将过滤后的reads与参照数据库进行比对,比对上的碱基所占比例在一定程度上能反映测序水平的高低、所选参考基因组的优劣以及后期分析水平的可靠程度。利用Stringtie的分析流程对已知的基因和转录本进行表达定量。采用Deseq2软件分析差异表达基因。筛选条件为P<0.05且|log2(fold change)|>0.5。
3.8 富集分析 利用miRWalk查找miR-204-5p的下游靶基因,结合位点选择3'UTR,和RNA-seq得到的下调基因取交集,随后进行基因本体论(Gene Ontology, GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)富集分析。通过美国国家生物技术信息中心(National Center of Biotechnology Information, NCBI)设计基因引物并使用RT-qPCR对富集在MAPK通路里的MAPT、PPP3R1、PRKACB、PTPRR、MAP2K4、CACNA2D2和RPS6KA6进行验证。以GAPDH作为内参照。引物序列如表1所示。

表1 基因引物序列Table 1.Primer sequences of the genes
4 统计学处理
涉及两组之间的比较,若数据符合正态分布,则使用独立样本t检验,否则使用曼惠特尼检验。SPSS 26.0和Graphpad Prism 9.0被用来分析数据和作图,数据以均数±标准差(mean±SD)表示。P<0.05被认为差异有统计学意义。
结 果
1 过表达miR-204-5p抑制EA.hy926细胞的活力和迁移
RT-qPCR检测结果显示,miR-204-5p mimics组EA.hy926细胞miR-204-5p的表达效率是对照组的2 149倍,表明转染成功,可以进行下一步实验。CCK-8实验用于探究miR-204-5p对EA.hy926细胞活力的影响,结果发现,miR-204-5p mimics在第24及48小时抑制EA.hy926细胞的活力;Transwell实验表明miR-204-5p mimics可以显著抑制EA.hy926细胞的迁移能力,见图1。
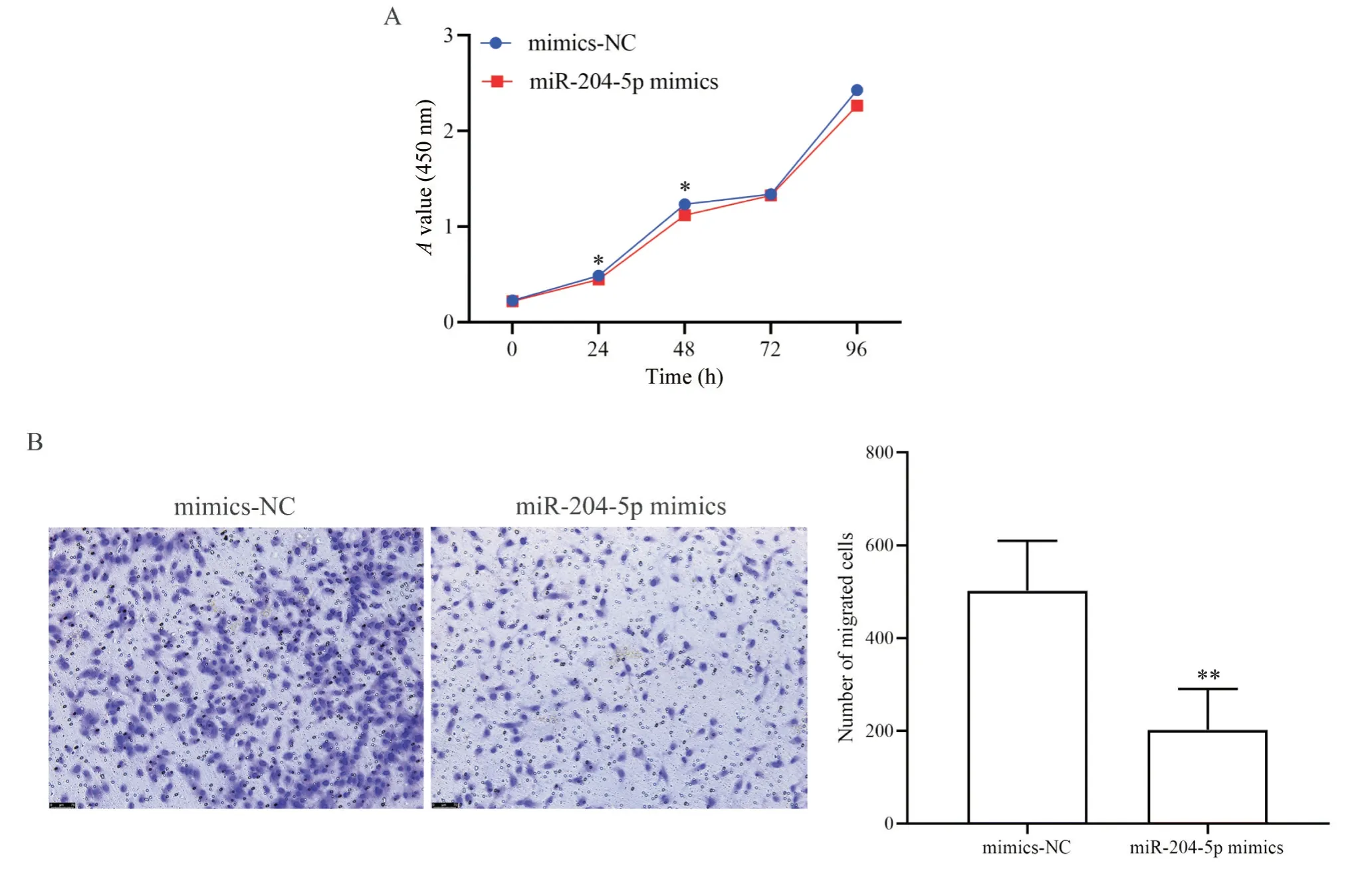
Figure 1.Results of CCK-8 and Transwell experiments.A: CCK-8 assay showing the viability of EA.hy926 cells in mimics-NC and miR-204-5p mimics groups at 0, 24, 48, 72 and 96 h;B: Transwell assay displaying the number of migrating cells with mimics-NC and miR-204-5p mimics under an inverted microscope(×100).Mean±SD.n=3.*P<0.05, **P<0.01 vs mimics-NC group.图1 CCK-8和Transwell实验结果
细胞划痕结果显示,相对于mimics-NC,miR-204-5p mimics可以在12 h和24 h抑制EA.hy926细胞的愈合能力,见图2。
2 过表达miR-204-5p使S期细胞减少并抑制细胞凋亡
过表达miR-204-5p使G0/G1期细胞数目增多,使S期细胞数减少(P<0.05),见图3A。使用不同浓度H2O2构建细胞凋亡模型,结果发现1 000 μmo/L的浓度可以在不过度损伤细胞的前提下使细胞凋亡率有较高提升,因此,选择1 000 μmo/L浓度的H2O2构建细胞凋亡模型。细胞凋亡率分析发现,miR-204-5p mimics显著降低了EA.hy926细胞的早期凋亡率(P<0.05),见图3B。

Figure 3.Results of the cell cycle and apoptosis assays.A: the proportion of EA.hy926 cells in G0/G1, S and G2/M phases;B: the early and late apoptosis rates of EA.hy926 cells.Mean±SD.n=3.*P<0.05 vs mimics-NC group.图3 细胞周期和细胞凋亡检测结果
3 富集分析
RNA-seq结果显示,过表达miR-204-5p后,以P<0.05且log2FC≤-0.5为条件,共有432个基因表达下调,和miRWalk预测的下游靶基因取交集后,共得到138个可能的下游靶基因。将下游靶基因导入metascape进行GO/KEGG富集分析,发现在生物学过程(biological process,BP)中,下游靶基因主要富集在蛋白质磷酸化(protein phosphorylation)、小蛋白偶联修饰蛋白(protein modification by small protein conjugation)和蛋白质分解代谢过程(protein catabolic process),见图4A;在细胞组分(cellular components,CC)中,主要富集在轴突(axon)、主轴(spindle)和细胞导端(cell leading edge),见图4B;在分子功能(molecular function, MF)中,下游靶基因主要富集在酰基转移酶活性(acyltransferase activity)、激酶活性(kinase activity)和泛素样蛋白转移酶活性(ubiquitinlike protein transferase activity),见图4C。KEGG通路富集分析显示下游靶基因主要富集在单纯疱疹病毒感染(herpes simplex virus 1 infection)、MAPK信号通路(MAPK signaling pathway)和人类T细胞白血病病毒1型感染(human T-cell leukemia virus 1 infection),见图4D。

Figure 4.Enrichment analysis of downstream target genes of miR-204-5p.A: biological process;B: cellular component;C: molecular function;D: KEGG.图4 miR-204-5p下游靶基因富集分析
4 miR-204-5p可能通过抑制MAPT的表达来抑制CHD的发生发展
通过富集分析可知,富集在MAPK信号通路里的 基 因 为MAPT、PPP3R1、PRKACB、PTPRR、MAP2K4、CACNA2D2和RPS6KA6。RT-qPCR结果显示,过表达miR-204-5p后,MAPT和MAP2K4扩增结果较好且表达下降,其中MAPT表达下降最明显,其表达量约为对照组的30%,见图5。因此,miR-204-5p可能通过抑制MAPT/MAPK信号通路而抑制内皮细胞的活力和迁移,减少细胞凋亡,进而减缓CHD的发生发展。

Figure 5.Results of RT-qPCR.Mean±SD.n=3.**P<0.01 vs mimics-NC group.图5 RT-qPCR结果
讨 论
已有研究显示,lncRNA uc003pxg.1可以促进内皮细胞的增殖、迁移进而促进CHD的发生[17]。SIRT1被认为可通过抗氧化、抗炎和抗细胞凋亡来抑制CHD[18]。在冠心病PBLs中高表达的miR-323-3p会导致血管内皮细胞凋亡率上升进而促进CHD发病进程[19]。以上结果证明,内皮细胞增殖、迁移增强,凋亡率上升均可以促进CHD的发生,而我们的研究结果发现过表达miR-204-5p可以抑制内皮细胞的增殖和迁移,并降低其凋亡率。因此,推测miR-204-5p可能通过影响内皮细胞功能而抑制CHD的发生发展。
真核生物细胞周期主要包括G1、S、G2、M四个时期,同时,细胞也可以退出细胞周期进入静止状态(G0期)[20]。其中,S期又称为DNA合成期,M期包括有丝分裂和细胞质分裂,有丝分裂和S期之间的间隔称为G1期,S期和M期之间的间隔称为G2期[21]。S期是细胞增殖的关键时期,DNA数量在此期增加一倍[22]。本研究中,过表达miR-204-5p后,发现处于S期的细胞减少,说明miR-204-5p对于内皮细胞的生长和增殖具有抑制作用。
丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)信号通路在细胞增殖、凋亡和分化中发挥着重要的作用[23]。目前已发现MAPK信号通路可以促进多种癌症的发生发展,例如肝癌[24]、肺癌[25]和乳腺癌[26]等。MAPK信号通路可以促进内皮细胞的增殖和迁移,并诱导细胞从细胞周期的G1期向S/G2期转变[27]。已有研究表明MAPK信号通路的激活可以促进内皮细胞的凋亡和损伤从而促进CHD的发展[28]。MAPK信号通路可以促进巨噬细胞的凋亡[29]和M1极化[30]来促进动脉粥样硬化,也可以促进炎症的发生[31]。通过富集分析,我们发现miR-204-5p下游靶基因富集在MAPK信号通路,因此推测miR-204-5p可能通过抑制MAPK信号通路进而抑制内皮细胞的迁移、增殖和凋亡,并使S期细胞减少。
综上所述,miR-204-5p可能通过抑制MAPT/MAPK信号通路进而抑制内皮细胞的活力、迁移和凋亡,这些内皮细胞生物学行为的改变可能对CHD的发生发展产生重要的影响,潜在的影响及其机制值得进一步研究。

