Uhrf1基因重组腺病毒载体构建及其在小鼠心肌细胞DNA损伤修复中的作用研究*
江 南, 王驰寅, 聂 宇, 王 珏,2△
(1温州医科大学第一临床医学院,浙江 温州 325000;2温州医科大学附属第一医院心脏外科,浙江 温州 325000;3中国医学科学院,北京协和医学院国家心血管病中心,阜外医院心血管疾病国家重点实验室,北京 100037)
泛素样同源域和环指结构域1(ubiquitin-like with plant homeodomain and RING finger domains 1,Uhrf1),也称为NP95或ICBP90,是一种多结构域蛋白,包含泛素样结构域(ubiquitin-like domain, UBL)、串联铎域(tandem tudor domain, TTD)、植物同源结构域(plant homeodomain, PHD)、SET和RING相关结构域(SET and RING-associated domain, SRA)以及真正有趣的新基因结构域(really interesting new gene domain, RING)。这些结构域经过连接区进行翻译后修饰,调控UHRF1不同的空间构象状态,影响其稳定性和功能[1]。研究表明,Uhrf1基因在DNA甲基化、DNA损伤修复和细胞增殖中扮演着关键角色[2-4]。Muto等[5]的研究指出,UHRF1的缺失可提高细胞对DNA损伤剂的敏感性,最初被发现参与DNA损伤修复的染色质标志是磷酸化组蛋白H2A变异体(γ histone H2A,γH2AX)[6],而Tian等[2]观察到,缺乏UHRF1功能的细胞会积累DNA损伤标志物γH2AX。然而,当前研究对Uhrf1基因在心肌细胞中发挥何种作用知之甚少,因心肌细胞质粒转染效率极低,严重制约了相关研究的进展。因此,本研究旨在构建并鉴定小鼠Uhrf1基因重组过表达腺病毒载体,为进一步利用腺病毒基因递送系统在心肌细胞中实现Uhrf1基因过表达,探索Uhrf1基因在心肌细胞DNA损伤中的作用提供实验依据。
材料和方法
1 动物
SPF级ICR小鼠,1日龄,0.8~1.2 g,共25只,购自北京斯贝福生物技术有限公司,许可证号为SCXK(京)2019-0004。
2 主要实验试剂
限制性内切酶AsisI及MluI、质粒载体pADMCMV-C-FH、T4 DNA连接酶、感受态细胞DH5α和PrimeScript RT Master Mix (RR036A)购自TaKaRa;DMEM培养液及胎牛血清(fetal bovine serum,FBS)购自Gibco;青霉素/链霉素溶液、磷酸盐缓冲液(phosphate buffer solution,PBS)及RIPA裂 解 液(P0013B)购于上海碧云天生物技术有限公司;4%~12% Bis-Tris预制胶、蛋白质电泳缓冲液、蛋白质转膜缓冲液、聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜、驴抗鼠488 Ⅱ抗(A-21202)、驴抗兔594 Ⅱ(A-21207)、山羊抗鼠HRP Ⅱ抗(31430)及山羊抗兔HRP Ⅱ抗(31460)购自Invitrogen;DMSO购自北京索莱宝科技有限公司;腺病毒感染性滴度快速测定试剂盒LABKIT®AD-010(24Tests)购自深圳莱伯克生物科技有限公司;新生小鼠心脏解离试剂盒(130-098-373)购自MiltenyiBiotec;UHRF1抗体(sc-373750)购自Santa Cruz;Phospho-H2AX(γH2AX)抗体(9718S)、H2AX抗体(2595S)、Bax抗体(5023S)、Bcl-2抗体(4223S)及α-Tubulin抗体(2144S)购自Cell Signaling Technology;重 组 Anti-cardiac troponin T(CT3)(ab209813)购自Abcam;含DAPI的封片剂购自北京中杉金桥生物技术有限公司。
3 主要方法
3.1 含有鼠源Uhrf1基因序列片段的合成 从原代小鼠心肌细胞中提取总RNA,总RNA反转录后得到cDNA。根据NCBI GenBank中小鼠Uhrf1基因编码序列(NM_001111078.1)设计含有酶切位点的引物,上游引物序列为5’-GCGATCGATGTGGATCCAGGTTCGAAC-3’,下 游 引 物 序 列 为5’-GACGCGTTCACCGGCCGCTGCCATAGC-3’。进行PCR扩增后得到Uhrf1基因片段,经AsisI/MluI双酶切后回收,酶切体系为:基因片段20 μL(约2 μg),10×缓冲液5 μL,ddH2O 24 μL,AsisI 0.5 μL,MluI 0.5 μL,总体系50 μL。37 ℃反应3 h。
3.2 质粒载体pADM-CMV-C-FH酶切 用AsisI和MluI双酶切质粒载体pADM-CMV-C-FH,将合成的Uhrf1基因片段连接至酶切后的质粒载体pADMCMV-C-FH中。酶切体系为质粒DNA 20 μL(约2 μg),10×缓冲液 5 μL,ddH2O 24 μL,AsisI 0.5 μL,MluI 0.5 μL,总体系50 μL。37 ℃反应3 h。
3.3 目的基因片段和质粒载体pADM-CMV-C-FH的连接鉴定 取上述酶切回收后的Uhrf1基因片段及质粒载体进行连接反应,连接体系如下:DNA片段6 μL,pADM-CMV-C-FH 1 μL,T4 DNA连接酶2 μL,DNA连接酶缓冲液1 μL。16 ℃转化到感受态细胞DH5α,挑取单克隆菌落过夜培养后提取质粒,利用AsisI和MluI双酶切鉴定,1 %琼脂糖凝胶电泳检测验证片段长度。
3.4 基因测序 重组质粒由山东维真生物科技有限公司进行测序验证序列信息。
3.5 重组腺病毒pADM-CMV-C-FH-UHRF1包装、扩增及纯化 将重组腺病毒转染至HEK293T细胞中,放置于CO2细胞培养箱中培养。观察大部分细胞出现细胞病变效应后,收集细胞,采用1 000 × g离心7 min后,留细胞沉淀和约5 mL上清液,充分溶解。将细胞悬液于干冰与37 ℃恒温器反复冻融4次,12 000 ×g离心2 min。收集病毒上清液,放置于-80 ℃冰箱中保存。重复上述步骤,可以达到病毒扩增的目的。使用碘克沙醇密度梯度离心法对病毒进行纯化,得到高滴度的病毒浓缩液。
3.6 ADM-Uhrf1腺病毒滴度测定 根据腺病毒感染性滴度快速测定试剂盒说明,分为9个梯度稀释病毒样品后感染细胞,37 ℃培养48 h。甲醇固定10 min后洗涤,先后加入Ⅰ抗稀释液和Ⅱ抗稀释液37 ℃孵育1 h。加入配制的3,3′-二氨基联苯胺(3,3'-diamino-benzidine,DAB)工作液显色30 min,用显微镜对阳性细胞进行计数。数出倒数两孔的阳性细胞数,根据腺病毒滴度计算公式:病毒滴度(pfu/mL)=(倒数第二孔阳性细胞+倒数第一孔阳性细胞×10)×1 000/2/倒数第二孔病毒量(μL),计算ADMUhrf1腺病毒滴度。
3.7 分离原代心肌细胞并加入重组腺病毒转染配制心肌细胞解离酶,每个C管包含62.5 μL酶P,12.5 μL酶A,100 μL酶D,2 300 μL缓冲液X和25 μL缓冲液Y。在超净台中使用眼科剪正中切口刺入小鼠胸口,挤出并用镊子摘下心脏,放入PBS中剪去心耳,将心脏放入C管后放置gentleMACS消化1 h,加入含10 %FBS的培养液终止消化,300 × g离心5 min后弃去上清,加入2 mL红细胞裂解液裂解2 min,加入PBS清洗,再次300 ×g离心5 min后弃去上清,加入10 mL培养液吹打重悬细胞,利用差速贴壁法收集心肌细胞种板。待种板20 h后,使用不加FBS的DMEM培养液饥饿4 h,加入Uhrf1过表达腺病毒(MOI=50),培养20 h。
3.8 心肌细胞免疫荧光染色 加入4%多聚甲醛固定心肌细胞15 min后PBS洗3次,每次5 min。将适量Triton-X 100加入到5%驴血清封闭液中制成0.3%~0.5%封闭通透液,室温孵育1 h后洗涤。4 ℃过夜孵育UHRF1抗体及CT3抗体,次日复温30 min后再次洗涤。避光室温孵育相应种属Ⅱ抗1 h,洗涤后加入含DAPI的封片剂于共聚焦显微镜拍摄。
3.9 H2O2细诱导胞氧化损伤模型制备 将其余加入Uhrf1过表达腺病毒组的细胞随机均分为两组,其中一组更换含有200 μmol/L H2O2的DMEM培养液,另一组更换普通DMEM培养液。对照病毒组进行相同处理,培养2 h后收样。
3.10 提取原代心肌细胞蛋白 饥饿4 h后将其余细胞更换为含有200 μmol/L H2O2的DMEM培养液培养2 h后收样。加入RIPA裂解液,刮下贴壁细胞充分裂解,收集细胞及裂解液至EP管,20 000 ×g离心15 min,取上清液BCA法测浓度,调整至一致浓度后上样行Western blot,孵育UHRF1抗体、γH2AX抗体、H2AX抗体、Bax抗体、Bcl-2抗体及α-Tubulin抗体验证腺病毒过表达水平并研究DNA损伤程度。
4 统计学处理
使用GraphPad Prism 9.5软件分析数据。所有数据用均数±标准误(mean±SEM)表示。多组间比较采用双因素方差分析(two-way ANOVA)进行统计学分析。以P<0.05为差异有统计学意义。
结 果
1 重组质粒pADM-CMV-C-FH的验证
质粒pADM-CMV-C-FH图谱及酶切位点见图1。经酶切后,1%琼脂糖凝胶电泳显示两条带,一条为2 kb左右,一条为4 kb 左右,证明重组质粒获得长约2 349 bp的插入片段(即目的基因Uhrf1),见图2。

Figure 1.Plasmid pADM-CMV-C-FH map and restriction enzyme cleavage sites.图1 质粒pADM-CMV-C-FH图谱及酶切位点

Figure 2.The electrophoretic analysis of DNA fragments after enzymatic digestion on an agarose gel.图2 酶切产物DNA片段琼脂糖凝胶电泳检测分析
2 重组腺病毒ADM-Uhrf1感染细胞观察及病毒滴度测定
根据两组阳性细胞梯度图(图3),最终计算得出ADM-Uhrf1病毒滴度为1.8×1013pfu/L。

Figure 3.DAB staining of gradient dilution viral sample.A:DAB-positive cells at a viral dilution of 10-6 μL;B:DAB-positive cells at a viral dilution of 10-7 μL.图3 梯度稀释病毒样品的DAB染色
3 UHRF1在心肌细胞中的免疫荧光染色表达水平
免疫荧光染色检测UHRF1在心肌细胞中表达情况显示,与ad-Ctrl组相比,ad-Uhrf1组UHRF1表达水平显著增加,且其表达主要位于心肌细胞核内,见图4。
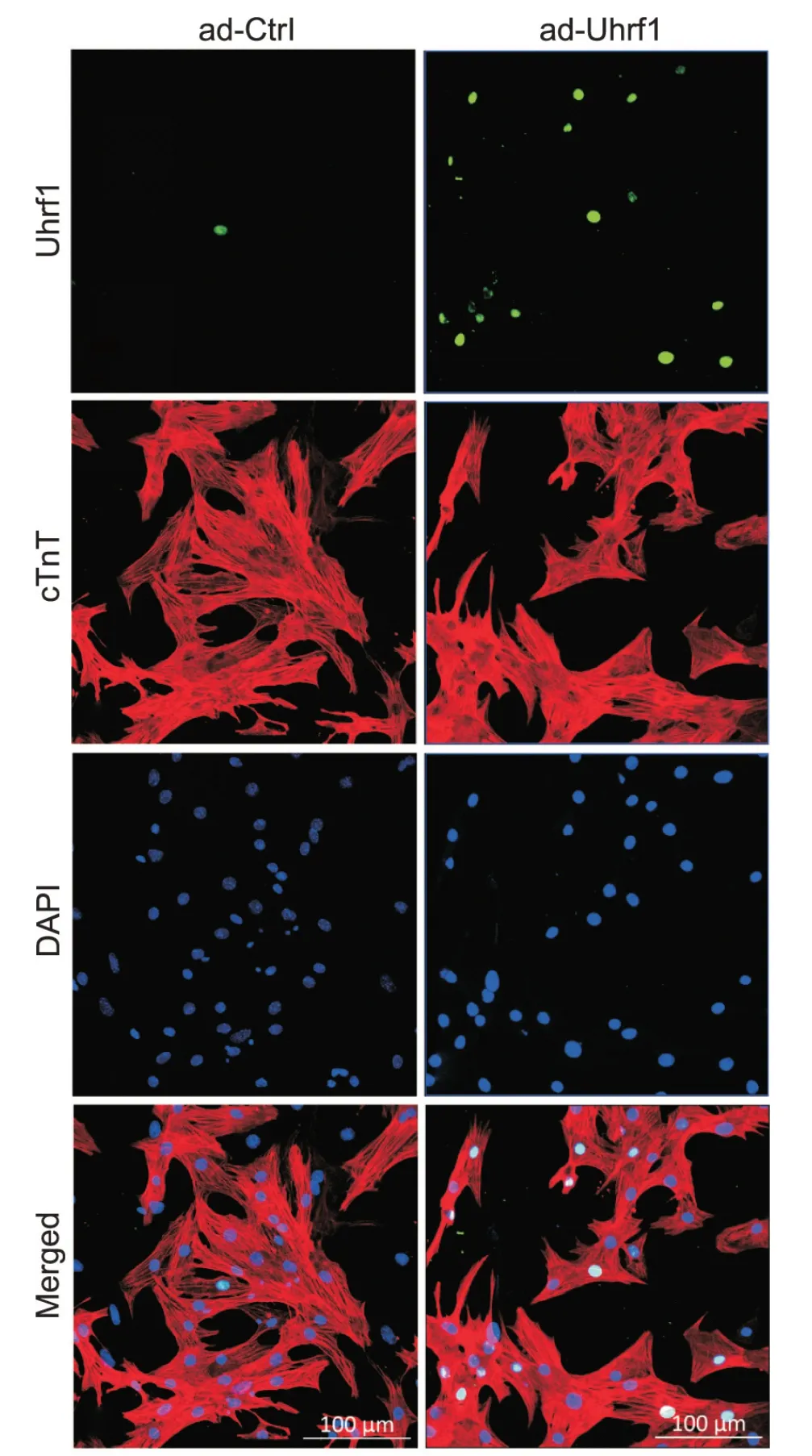
Figure 4.Representative immunofluorescence images of cardiomyocytes from the ad-Ctrl group and the ad-Uhrf1 group were presented, showing various channels and merged images.Monochromatic channel images depicted Uhrf1, cardiac troponin T (cTnT) and DAPI.The merged images combined the information from all three channels.图4 新生小鼠原代心肌细胞免疫荧光染色各通道代表图
4 过表达Uhrf1减轻心肌细胞DNA损伤而不影响细胞凋亡
Western blot分析结果显示,无论H2O2处理与否,与ad-Ctrl组相比,ad-Uhrf1组的UHRF1蛋白表达水平均呈现显著上调(P<0.05)。H2AX和DNA损伤的标志物γH2AX(Ser139)的蛋白表达水平在不经H2O2处理的情况下未观察到显著差异,而在H2O2处理情况下,ad-Uhrf1组的γH2AX蛋白表达水平相比ad-Ctrl组显著下调(P<0.01)。此外,在各组中均未检测到Bax和Bcl-2等细胞凋亡蛋白表达水平的改变,见图5。
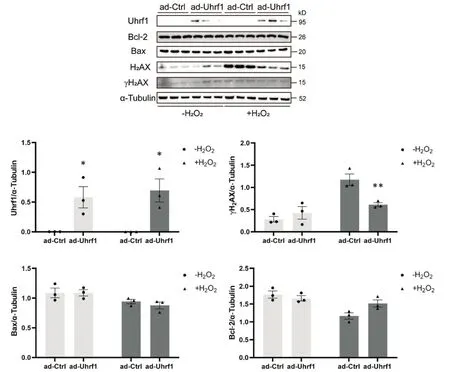
Figure 5.Impact of Uhrf1 overexpression on H2O2-induced oxidative injury in cardiomyocytes.The protein expression levels of Uhrf1,γH2AX, H2AX, Bax, Bcl-2 and α-tubulin upon hydrogen peroxide treatment and Uhrf1 overexpression were detected by Western blot.Mean±SEM.n=3.*P<0.05, **P<0.01 vs ad-Ctrl group.图5 过表达Uhrf1对心肌细胞H2O2氧化损伤模型的影响
讨 论
作为全身血液循环系统的核心器官,心脏在代谢过程中以及发生缺血再灌注损伤后会产生大量的活性氧,包括但不限于H2O2和自由基,这些活性氧物质过量积聚可能引发心肌细胞膜脂质的过氧化、DNA的损伤以及蛋白质的氧化,直接影响心肌细胞的功能和整体心脏健康。近年来,Uhrf1作为维持DNA甲基化的基本表观遗传学调节因子一直受到广泛关注[7],除了在复制过程中起到维持DNA甲基化的重要作用外,Uhrf1在DNA损伤修复方面同样扮演着关键的协同角色。鉴于腺病毒过表达的直接特性[8],本实验成功构建了携带Uhrf1基因的重组腺病毒载体的实验模型,并确认了其滴度[9],在实现体外心肌细胞Uhrf1特异性过表达的前提下进一步研究了其对H2O2诱导的DNA损伤的影响。
实验结果表明,与对照组相比,心肌细胞过表达Uhrf1组的γH2AX蛋白表达水平显著降低,而H2AX蛋白的总表达水平并未发生变化,这表明过表达Uhrf1能够减轻H2O2引发的心肌细胞DNA氧化损伤。这一结果与先前的研究结果一致,即SRA和RING结构域在与受损DNA结合以及募集DNA修复相互作用因子方面发挥作用,使得DNA修复机制能够迅速检查、修复和替换受损DNA上的错误遗传信息,从而保障DNA在遗传过程中的准确性[10-11]。
此外,有研究报道H2O2能够诱导细胞凋亡[12],我们检测了细胞凋亡通路相关蛋白Bax及Bcl-2的表达水平,但过表达Uhrf1并未改变其表达水平,这表明UHRF1可能不通过抗凋亡通路促进心肌细胞应对DNA损伤的反应能力[13]。综合考虑到Uhrf1在细胞增殖[14]、DNA甲基化[7]及调控AMPK能量代谢方面的作用[15-16],这提示UHRF1可能通过DNA甲基化或其他结构域的功能来抵抗心肌细胞受到的DNA损伤,抑或是心肌细胞本身可能通过某种机制来对抗细胞凋亡,以应对日常产生的大量活性氧的损伤。然而,需要进一步的实验研究来探索Uhrf1基因在抵抗心肌细胞死亡中的确切作用机制。
总之,本研究通过利用腺病毒载体构建技术建立了体外心肌细胞H2O2氧化损伤模型,为深入了解与氧化损伤相关的心血管疾病提供了实验基础。

