糖尿病肝脏病变中GLUTs和SIRTs表达水平的研究*
郭 玉, 白文帆, 田亚平, 罗飞扬, 贾淑元, 罗明秀, 姚 青
(宁夏医科大学基础医学院,宁夏 银川 750004)
糖尿病肝损伤(diabetic liver injury, DLI)是糖尿病(diabetes mellitus, DM)引起的肝脏慢性并发症。由于肝脏高代偿的特性,所以在DM早期患者肝损伤的症状并不明显[1],但是随着病情的发展,肝内逐渐出现炎性水肿、脂肪组织浸润、脂肪性肝炎、肝纤维化,直至发展成为肝硬化甚至肝癌[2]。因此,作为DM的慢性并发症之一,DLI越来越受到关注。
葡萄糖转运体(glucose transporters, GLUTs)是由SLC2基因编码的一类调控葡萄糖进入细胞内的跨膜蛋白家族,专职负责组织器官的能量供给和机体葡萄糖水平稳态调节功能。GLUTs家族中已鉴定出14种蛋白质,其中GLUT1在人体所有细胞/组织中普遍表达,是葡萄糖转运的主要载体蛋白[3];GLUT2主要存在于胰岛B细胞和肝细胞中,将葡萄糖进行转运以维持血糖水平的稳定[4];GLUT4主要存在于骨骼肌和脂肪细胞中,在胰岛素信号的刺激下,通过易位作用在细胞膜上调控葡萄糖进入细胞[5]。
沉默信息调节因子(silent information regulators,SIRTs)是一类具有烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)依赖性脱乙酰酶活性的蛋白质。哺乳动物有7种SIRT同系物,分别为SIRT1~SIRT7[6]。SIRTs能够调节多种细胞过程,包括细胞存活、衰老和代谢稳态[7]。本实验通过检测GLUTs和SIRTs在DM大鼠肝脏和高糖培养下的人肝细胞系LO2中的表达情况,进一步了解DLI的发生机制,为其治疗靶点提供新的思路。
材料和方法
1 实验动物
选取20只8周龄SPF级健康雄性SD大鼠,体质量(200±20) g,购自宁夏医科大学动物实验中心(实验动物合格证号为No.10752309202200094;动物伦理批准号为No.IACUC-NYLAC-2021-115)。实验在宁夏医科大学实验动物中心SPF级实验室进行,室内温度20~22 ℃,相对湿度40%~70%。
大鼠适应性饲养5~7 d后禁食12 h,将链脲佐菌素(streptozocin, STZ)溶解于柠檬酸缓冲液[A液:称取2.10 g柠檬酸(分子量210.14)加入纯水100 mL充分溶解;B液:称取2.94 g柠檬酸三钠(分子量294.10)加入纯水100 mL充分溶解;A液和B液按1∶1混合,pH 4.2~4.5)中,按60 mg/kg剂量给予大鼠一次性腹腔注射以诱导DM,正常对照(normal control,NC)组大鼠注射等体积柠檬酸缓冲液。常规喂养1周后禁食12 h,尾部采血检测大鼠空腹血糖(fasting blood glucose, FBG),以FBG≥16.7 mmol/L设置为DM组,其余为NC组。以后每隔2周检测大鼠FBG并称量体质量。本实验通过宁夏医科大学医学实验动物伦理委员会审查。
2 细胞培养
本实验采用人肝细胞系LO2进行实验。使用含10%胎牛血清的DMEM高糖完全培养基,放置于37 ℃、5% CO2培养箱中培养。24 h后观察细胞生长状态,并更换一次新鲜的培养基,待细胞长至80%用胰酶消化(0.05%胰酶+0.02% EDTA溶于500 mL DHanks液),按1∶4比例传代。
3 主要仪器和材料
STZ、无水乙醇、二甲苯、70%乙醇、80%乙醇、95%乙醇、清洁盖玻片、中性树胶和苏木精-伊红(hematoxylin-eosin, HE)染色试剂盒购自北京索莱宝科技有限公司;油红O染色试剂盒购自Sigma-Aldrich;过碘酸-席夫(periodic acid-Schiff, PAS)染液购自武汉塞维尔蛋白含量检测试剂盒;全蛋白提取试剂盒和化学发光液购自江苏凯基生物技术股份有限公司;SDS-PAGE蛋白上样缓冲液和预染蛋白Maker购自上海雅酶生物医药科技有限公司;柠檬酸和柠檬酸三钠购自天津市大茂化学试剂厂;SIRT1和SIRT6抗体购自Cell Signaling Technology;β-actin、SIRT2、SIRT3和SIRT7抗体购自Affinity;SIRT4、STRT5和GLUT1/4抗体购自Proteinch。台式高速冷冻型微量离心机购自DragonLab;荧光定量PCR仪购自Bio-Rad;化学发光成像仪购自Thermo Scientific;黏附载玻片、YD-14P1.5智能环保型双吊篮生物组织脱水机、YD-6LA生物组织冷冻包埋机、RWDS700轮转式切片机、YD-700全自动生物组织染色机和Minux FS800冰冻切片机购自深圳瑞沃德生命科技有限公司;ML31生物显微镜购自广州市明美科技有限公司;SCIENCE数字切片扫描系统购自山东志盈医学科技有限公司。
4 主要方法
4.1 肝脏指数的测定 1%戊巴比妥钠注射液(50 mg/kg)右下腹腔注射麻醉大鼠,腹主静脉取血致大鼠死亡,用生理盐水冲洗血迹,采集肝脏并进行称重,计算肝脏指数。肝脏指数=肝脏质量/体质量,其值越高表示肝脏损伤越严重。
4.2 血清生化指标检测 将大鼠血液离心后,分离血清,采用全自动生化分析仪检测血清甘油三酯(triglyceride, TG)、丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate aminotransferase, AST)、糖化血清蛋白(glycated serum protein,GSP)、FBG、碱性磷酸酶(alkaline phosphatase, ALP)、γ-谷氨酰转移酶(γ-glutamyltransferase, γ-GT)、胆固醇(cholesterol, CHO)、总 胆 红 素(total bilirubin,TBIL)、直接胆红素(direct bilirubin, DBIL)、白蛋白(albumin, ALB)、总胆汁酸(total bile acid, TBA)等指标。
4.3 大鼠肝组织病理形态学观察 使用4%中性多聚甲醛固定肝组织,取出后进行组织脱水、包埋、切片(4 μm),按照说明分别进行HE、PAS和油红O染色后,在光学显微镜下观察大鼠肝组织形态学变化。
4.4 不同浓度葡萄糖对细胞活力的影响 正常培养LO2细胞按5×103mL-1接种于96孔板中,培养24 h后,弃去低糖培养基,PBS洗3次后,分别以含25、50、75、100、125、150、175和200 mmol/L葡萄糖的DMEM培养液培养,每组设置5个复孔,干预48 h后每空加入10 μL CCK-8试剂,37 ℃培养2 h,采用酶标仪在450 nm波长测每孔吸光度(A)并计算不同糖浓度下细胞活力:细胞活力(%)=(A加药-A完培)/(ANC-A完培)×100%。每组取5个复孔的平均值,实验重复3次。
4.5 Western blot检测大鼠肝组织和LO2细胞中GLUTs和SIRTs的表达水平 根据CCK-8实验结果,收集含25和150 mmol/L葡萄糖的培养液干预各组细胞48 h,用显微镜观察细胞形态变化并拍照记录。将不同分组的肝组织和LO2细胞分别置于裂解液中,充分研磨,离心取上清液。通过BCA试剂盒检测样本蛋白浓度,将蛋白通过SDS-PAGE分离后转印到PVDF膜上,用10%的脱脂牛奶封闭2 h后孵育Ⅰ抗(β-actin抗体,1∶5 000;SIRT1~7抗体,1∶1 000;GLUT1抗体,1∶4 000;GLUT4抗体,1∶2 000)。摇床4 ℃孵育过夜。次日,PBS洗膜后孵育Ⅱ抗(1∶5 000),摇床孵育后TBST洗膜,配制ECL发光液(VA液∶VB液=1∶1),在凝胶系统成像仪上曝光,灰度值结果与β-actin蛋白表达水平相比较并进行分析。
5 统计学处理
用GraphPad Prism统计软件进行分析。数据均采用均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析,两两比较采用最小显著性差异法(LSD法)。以P<0.05为差异有统计学意义。
结 果
1 大鼠FBG和体质量的变化
与NC组大鼠相比,DM大鼠均出现多饮、多食、多尿、体质量减轻的症状。STZ注射2周后,DM组大鼠FBG水平均显著高于NC组(均P<0.05),见图1A;8周后DM组大鼠体质量显著低于NC组(均P<0.05),见图1B。

Figure 1.Changes of fasting blood glucose (FBG;A) and body mass (B) of the rats in normal control (NC) group and diabetes mellitus (DM) group.Mean±SD.n=6.**P<0.01 vs NC group.图1 NC组和DM组大鼠空腹血糖和体质量的变化
2 大鼠肝脏指数变化比较
与NC组相比,DM组大鼠肝脏明显增大,肝脏指数显著升高(P<0.01),见图2。
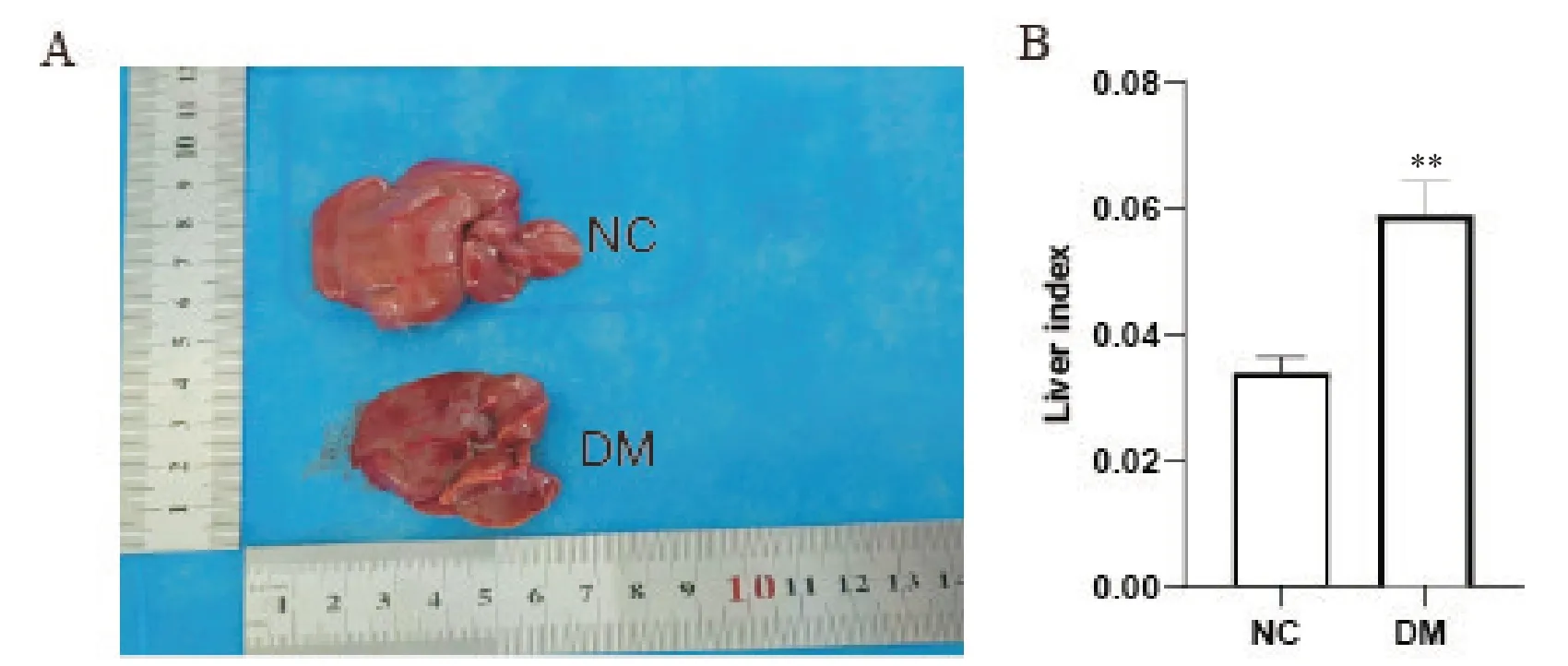
Figure 2.Changes of liver size and liver index of the rats in normal control (NC) group and diabetes mellitus (DM) group.A: size of rat liver;B: liver index.Mean±SD.n=6.**P<0.01 vs NC group.图2 NC组和DM组大鼠肝脏大小和肝脏指数的变化
3 大鼠血清生化指标变化比较
与NC组相比,DM组大鼠血清中AST、ALT、ALP、γ-GT、DBIL、TBIL、TBA、FBG、GSP、TG和CHO水平均显著升高,ALB水平显著降低,见图3。

Figure 3.Changes of serum biochemical indexes of the rats in normal control (NC) group and diabetes mellitus (DM) group.A: alanine transferase (ALT);B: aspartate aminotransferase (AST);C: alkaline phosphatase (ALP);D: γ-glutamyltransferase(γ-GT);E: total bilirubin (TBIL);F: direct bilirubin (DBIL);G: total bile acid (TBA);H: albumin (ALB);I: fasting blood glucose (FBG);J: glycated serum protein (GSP);K: triglyceride (TG);L: cholesterol (CHO).Mean±SD.n=3.**P<0.01 vs NC group.图3 NC组和DM组大鼠血清生化指标的变化
4 大鼠肝组织病理变化比较
HE染色结果显示,正常对照组大鼠肝小叶轮廓清晰完整,肝索排列整齐,肝窦无扩张,肝细胞结构清晰,细胞核形态正常;模型组大鼠近中央静脉肝血窦扩张充血,肝细胞轻度水肿,少量炎细胞散在浸润(图4A)。油红O染色结果显示,正常对照组大鼠肝小叶轮廓清晰完整,模型组大鼠肝细胞内有多量红色脂肪小滴弥漫散在分布于细胞浆内,以中央静脉区肝细胞内明显(图4B)。PAS染色(PAS阳性显示为细胞浆内糖原着浅紫色)结果显示,与正常对照组相比,模型组大鼠中央静脉区肝细胞内有多量浅紫色圆形小滴弥漫分布于细胞浆内(图4C)。

Figure 4.Patological changes of rat liver tissues in normal control(NC) group and diabetes mellitus (DM) group.A: hematoxylineosin (HE) staining;B: oil red O staining;C: periodic acid-Schiff (PAS) staining.图4 NC组和DM组大鼠肝组织病理变化
5 大鼠肝组织中GLUTs和SIRTs的表达情况
Western blot结果显示,与NC组相比,DM组大鼠肝组织中的GLUT1、GLUT2和GLUT4蛋白表达水平升高,SIRT1、SIRT3、SIRT5、SIRT6和SIRT7蛋白表达水平下降,差异均有统计学意义(均P<0.05),见图5。

Figure 5.Expression levels of GLUTs (A) and SIRTs (B) in liver tissues of the rats in normal control (NC) group and diabetes mellitus (DM) group.Mean±SD.n=3.**P<0.01 vs NC group.图5 各组大鼠肝组织GLUTs和SIRTs蛋白的表达水平
6 高浓度葡萄糖对肝细胞活力的影响
将LO2细胞用不同浓度的葡萄糖干预24 h后检测细胞活力。CCK-8实验结果显示,与25 mmol/L葡萄糖组比较,50 mmol/L葡萄糖组细胞活力显著升高(P<0.01);75 mmol/L、100 mmol/L和125 mmol/L葡萄糖组细胞活力有所下降,但与25 mmol/L葡萄糖组相比均无显著差异(均P>0.05);而150 mmol/L、175 mmol/L和200 mmol/L葡萄糖组细胞活力均显著下降(均P<0.01),见图6。这提示高浓度葡萄糖能够降低LO2细胞的活力。
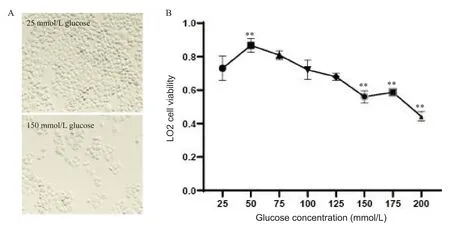
Figure 6.The viability of human hepatocytes (LO2 cells) after treatment with different concentrations of glucose for 48 h.A: morphological changes of LO2 cells (×40);B: the viability of LO2 cells.Mean±SD.n=3.**P<0.01 vs 25 mmol/L group.图6 不同浓度葡萄糖干预48 h后人肝细胞系LO2的活力
7 LO2细胞中GLUTs和SIRTs的表达情况
Western blot结果显示,与25 mmol/L葡萄糖组相比,150 mmol/L葡萄糖组细胞中GLUT1、GLUT2和GLUT4蛋白表达水平升高,SIRT1、SIRT3、SIRT5、SIRT6和SIRT7蛋白表达水平下降,差异均有统计学意义(均P<0.05),见图7。

Figure 7.Expression levels of GLUTs (A) and SIRTs (B) in LO2 cells.Mean±SD.n=3.**P<0.01 vs 25 mmol/L group.图7 LO2细胞中GLUTs和SIRTs蛋白表达情况
讨 论
DLI是DM的并发症之一,也是非酒精性脂肪肝的一种类型,随着DM病程的延长与发展,DLI会逐渐加重,继而转变为肝硬化,更有甚者发展为肝癌[8]。DLI的发生伴随着肝脏病理结构的改变、肝脏内脂肪堆积、出现炎症细胞浸润,进而肝脏发生纤维化,最终发展为肝癌。DLI的发病机制目前尚未完全阐明,目前有炎症反应、氧化应激、内质网应激和自噬等学说[9]。因此,探索DLI的发病机制,找寻安全有效的方法预防及治疗DLI的发生具有积极的意义。
在本次的实验研究显示DM大鼠血糖指标显著升高,体质量降低,DM大鼠血清中的AST、ALT、ALP、γ-GT、DBIL、TBIL和TBA均升高,ALB降低,说明DM大鼠的肝功能有一定程度的损伤。通过病理学检测发现DM大鼠的肝脏体积变小,肝体指数显著升高。肝组织HE染色显示DM大鼠近中央静脉肝血窦扩张充血,肝细胞轻度水肿,证明DM大鼠的肝脏发生病变。另外,DM大鼠FBG和血清GSP均升高,肝组织PAS染色结果显示肝细胞着色较深,提示大鼠肝脏的损伤与糖代谢异常有关。同时,本研究发现DM大鼠血清中的TG和CHO升高,进一步对大鼠肝脏切片进行油红O染色可见DM大鼠肝组织内有大量的甘油三酯聚集,提示大鼠肝脏的脂质代谢也发生紊乱。这些结果说明大鼠糖脂代谢紊乱造成肝脏的损害,而肝功能的下降会进一步促进体内物质代谢紊乱,从而加重对机体的损害。
GLUTs是被动膜转运蛋白,有14种不同的类型,按照序列相似性和底物亲和力可被分为3类:I类GLUTs(1~4和14)能够促进葡萄糖和其他己糖的摄取,但不能促进果糖的摄取;II类GLUTs(5、7、9和11)是果糖转运蛋白;III类GLUTs(6、8、10、12和13)是结构非典型成员[10]。GLUT1是已知体内分布最广的GLUT,几乎存在于各种组织细胞膜上,不仅参与葡萄糖跨膜转运的正常生理过程,还与DM慢性并发症的发生直接相关,如在糖尿病心肌病、糖尿病胃肠病变、糖尿病肾病等中发挥重要作用[11]。相关研究也发现,在空腹和DM状态下,患者肝细胞中GLUT1表达也增加[12]。我们对DM大鼠肝组织中的GLUT1进行了检测,与上述研究结果相一致。同时,我们通过CCK-8实验发现在适当范围内增加葡萄糖的浓度可以提高LO2细胞的活力,而当葡萄糖浓度达到75 mmol/L时,细胞活力开始下降,结合光镜下细胞形态的观察,提示当葡萄糖浓度达到150 mmol/L时,LO2细胞发生明显的损伤。因此,我们选取150 mmol/L作为细胞高糖损伤条件。对LO2细胞高糖损伤模型检测发现细胞中GLUT1的表达显著高于正常糖对照组,与DM大鼠肝组织的表现一致。GLUT2是胰岛β细胞和肝细胞中的葡萄糖转运蛋白,在小肠、肾脏和中枢神经系统中也有表达。在正常条件下,GLUT2对葡萄糖的亲和力相对较低,它的变化与各种激素分泌水平和细胞代谢紊乱有关[11]。当血糖升高时,葡萄糖会刺激胰岛β细胞分泌GLUT2来摄取葡萄糖,将葡萄糖代谢为葡萄糖-6-磷酸,然后通过糖代谢的一系列反应生成ATP,从而增加细胞质中的ATP/ADP比例,促进胰岛素的分泌[11,13]。在本次研究中,我们发现DM大鼠肝组织中GLUT2的表达明显高于NC组,与高糖培养的LO2细胞GLUT2的表达相一致,这提示GLUT2可能与细胞内糖代谢异常有关,而这一结论与韩文祺等[14]的研究结果相一致。GLUT4主要存在于脂肪、心脏和骨骼肌等胰岛素敏感组织中,介导跨膜葡萄糖转运,促使外周葡萄糖的利用,其水平影响靶组织对葡萄糖的处置[15-16]。在正常情况下,胰腺β细胞会随着能量底物(例如葡萄糖、脂肪酸和氨基酸)、激素和能量需求变化(例如,空腹-喂养周期、运动和压力)的存在而分泌胰岛素,以维持正常的血糖水平[17]。在本研究中,大鼠肝组织中GLUT4蛋白的表达和LO2细胞的表达符合上述研究结果。
SIRTs是依赖NAD+的脱乙酰酶,其功能包括组蛋白和非组蛋白的脱乙酰化和ADP-核糖基化。该酶家族由7种亚型组成,其活性主要与DNA修复、细胞周期、代谢和衰老的调节有关[18]。SIRT1和SIRT6存在潜在治疗靶点,包括癌症、心血管疾病、呼吸系统疾病和其他疾病[19-20]。SIRT1主要定位在细胞核中;SIRT2定位在细胞质中,但也存在于细胞周期G2至M相变的细胞核中;SIRT3~5主要定位于线粒体,并具有线粒体靶向序列;SIRT6和SIRT7是核蛋白;其中,SIRT6主要位于染色质中,SIRT7主要存在于核仁中[21]。此外,SIRT的定位和亚细胞穿梭取决于不同类型的细胞类型和细胞周期振荡;SIRT1、SIRT3和SIRT6参与葡萄糖代谢。在饮食诱导的胰岛素抵抗发展期间增加肝脏SIRT3的全身益处也已被证明;SIRT3通过抑制缺氧诱导因子1α负调节有氧糖酵解。SIRT6参与维持全身及肝脏、骨骼肌等局部组织的葡萄糖代谢稳态[22-23]。SIRT1能减轻糖尿病肾病[24]。研究表明,胰腺β细胞中的SIRT6使FOXO1脱乙酰化,随后增加GLUT2的表达,以维持胰腺β细胞的葡萄糖敏感能力和全身葡萄糖耐量[25-26]。同时,肝硬化患者肝脏中SIRT1和SIRT6蛋白水平降低[27]。
本研究显示,GLUTs在DM大鼠肝组织和高糖处理的LO2细胞中均呈高表达状态,而SIRTs中的SIRT1、SIRT3、SIRT5、SIRT6和SIRT7呈低表达状态,说明GLUTs和SIRTs可能与DLI的发生发展有一定的相关性。而DLI引起GLUTs和SIRTs表达发生变化的相关性及其信号机制尚待进一步的研究。

