沉默信息调节因子3通过调节线粒体功能障碍减轻特发性肺纤维化的研究进展*
杨树森, 刘禹杉, 张仪霖, 惠 毅, 李京涛, 闫曙光,2△
(1陕西中医药大学基础医学院,陕西 咸阳 712046;2陕西省胃肠病证方药重点研究室,陕西 咸阳 712046;3陕西中医药大学附属医院,陕西 咸阳 712000)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种以进行性肺瘢痕形成为主要特征慢性进行性肺部疾病[1]。IPF属于典型且常见的纤维性间质性肺病,其病理进程不可逆转,往往会进展为呼吸衰竭和死亡[2],确诊后的平均预期寿命为3~5年[3]。抗纤维化药物pirfenidone和nintedanib可以改善IPF患者的肺功能,但其疗效不佳且副作用较大[4]。肺移植是目前延长IPF患者生存期最为有效的方法,但由于供体器官不足等因素限制了其推广[5]。所以新的治疗靶点及药物亟待发现并应用于临床。
线粒体功能障碍是IPF的重要病理特征[6]。活性氧(reactive oxygen species, ROS)水平增加、线粒体DNA损伤和脂质代谢异常等因素是线粒体功能障碍的相关诱因[7]。沉默信息调节因子3(silent information regulator 3, SIRT3)是一种组蛋白脱乙酰酶,它是线粒体独有的脱乙酰酶,其通过去乙酰化线粒体内生物功能相关蛋白来调节线粒体的诸多功能[8]。既往研究常聚焦于SIRT3在调节线粒体功能与延缓衰老的方面,近年来关于SIRT3减轻IPF的研究方兴未艾,相关研究表明SIRT3可以通过修复线粒体DNA、稳定ROS水平和调节线粒体脂质代谢失调来缓解线粒体功能障碍,继而减轻IPF[9]。本文将对IPF病理背景下SIRT3对线粒体功能障碍的调节作用进行综述。
1 IPF中的线粒体功能障碍
1.1 先行条件:线粒体ROS异常 ROS是氧化代谢的副产物,线粒体是细胞内ROS的主要来源[10]。内源性ROS主要来自线粒体氧化磷酸化(oxidative phosphorylation, OXPHOS)过 程 中 的 电 子 传 递 链(electron transport chain, ETC)泄漏[11]。线粒体通过ETC进行OXPHOS,这在三磷酸腺苷(adenosine triphosphate, ATP)的合成中起着重要作用[12]。正常情况下,线粒体消耗氧气并产生ATP和少量ROS,但IPF患者ATP的产生降低并伴随ROS异常升高,这暗示了IPF患者的线粒体功能存在异常[13]。低水平的ROS可调节信号传导等多种细胞反应[14],但过量的ROS会破坏脂质和DNA等细胞生物分子,诱发氧化应激并导致细胞凋亡、衰老和基因突变,同时还会激活过量的炎症介质,如肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、核因子κB(nuclear factor kappa-B, NF-κB)、核苷酸结合寡聚化结构域样受体蛋白3
(nucleotide-binding oligomerization domain-like receptor protein 3, NLRP3)和转录因子激活蛋白1(activator protein-1, AP-1),尽管目前关于炎症反应在推动IPF进程中的关键地位存在争议,但无法忽略的是,炎症反应普遍存在于IPF的病理进程中[15-16]。IPF中线粒体功能障碍也促进了细胞凋亡和衰老,有报告表明过量ROS显著降低了IPF患者肺泡上皮细胞内ETC复合体I和IV的活性,这会诱导细胞凋亡并推动IPF病理进程[17]。ROS会推动细胞衰老继而诱发IPF,而衰老细胞中的线粒体会产生更多的ROS,这加剧了细胞内氧化应激水平并形成一个促IPF的恶性循环[18-19]。除了对线粒体本身的影响,ROS释放到细胞质会加速细胞内氧化还原动态失衡并破坏细胞内环境稳态[20]。总之,ROS异常所诱发的诸多病理改变是线粒体功能障碍的先行条件,同时ROS所导致的氧化应激程度会随着IPF的进展而加重。
1.2 核心环节:线粒体DNA损伤 线粒体有少量自己的DNA,每个线粒体包含一个或多个线粒体DNA拷贝,它们位于线粒体基质中[21]。研究表明线粒体DNA受损推动了IPF病理进程[22]。线粒体DNA损伤常与氧化应激时相伴而行,由于线粒体是体内ROS的主产地,所以线粒体DNA对氧化损伤高度敏感[23]。碱基切除修复酶8-氧代鸟嘌呤DNA糖基化酶1(8-oxoguanine DNA glycosylase1, OGG1)在修复线粒体DNA损伤中起重要作用,由ROS所诱导的加合物 8-羟基-2′-脱氧鸟苷(8-oxo-7,8-dihydro-2'-deoxyguanosine, 8-oxo-dG)异常是导致线粒体DNA损伤的重要原因, OGG1通过特异性识别和切除8-oxo-dG来启动碱基切除修复途径。在IPF中OGG1存在功能异常,而相关研究也表明这会加速肺纤维化进程[24-25]。甲基化也是诱导线粒体DNA损伤的因素之一。线粒体DNA由环状结构组成,含有大量未甲基化的DNA,如CpG岛。DNA甲基化是主要的表观遗传修饰形式,CpG岛基因内甲基化的发生会推动肺纤维化和其他纤维化疾病进程[26-27]。线粒体DNA损伤和突变会推动线粒体膜电位崩溃等线粒体功能的异常,这反过来又会加速ROS的产生并加重线粒体畸形和受损[28]。线粒体DNA损伤是导致线粒体功能障碍的核心环节,线粒体内遗传信息及转录水平的异常改变对于线粒体的稳态无疑是毁灭性打击。
1.3 潜在因素:线粒体脂质代谢异常 线粒体是脂质代谢的关键细胞器[29]。IPF患者的脂质组学研究显示脂肪酸、胆固醇和其他脂质的合成和活性发生改变[30]。磷脂和鞘脂是线粒体脂质的主要组成部分,其代谢异常被认为是推进IPF病理进程的潜在因素[31-32]。在线粒体损伤过程中,肺表面活性物质合成和肺泡动态平衡所需的胆固醇和磷脂产生减少,这与线粒体融合蛋白(mitofusin, Mfn)的异常相关;Mfn是协调线粒体膜外融合的GTP酶,IPF中Mfn调节胆固醇与磷脂合成的功能异常会破坏上皮屏障完整性并推动纤维化过程[33-34]。有报告显示,IPF患者肺中棕榈酸(palmitic acid, PA)等饱和长链脂肪酸(longchain fatty acid, LCFA)水平较高,表明在IPF存在脂肪酸的异常积累[35]。存在于线粒体的β氧化是脂肪酸(fatty acid, FA)降解的主要途径,在功能障碍的线粒体中这一降解过程被阻滞[36]。FA降解不足导致其在细胞与组织中异常堆积,FA的异常堆积和成分的变化可能与 IPF的病理进展有关[37]。线粒体功能异常也会影响脂质代谢的相关因子,过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor, PPARγ)是调节脂肪组织合成代谢的关键因子,其对线粒体的生物发生起着重要作用,同时PPARγ还能够阻断转化生长因子β来延缓纤维化的进程,但相关研究表明IPF中PPARγ的表达被显著抑制[38-39]。作为PPARγ的结合蛋白,PPARγ辅激活因子1α(PPARγ coactivator-1α, PGC-1α)可调节多种组织中的线粒体功能,研究表明其在调节脂质代谢、减轻炎症和激活抗氧化剂中起重要作用,但在功能障碍的线粒体中,PGC-1α的表达显著降低[40-41]。线粒体脂质代谢异常会导致组织中的能量耗竭和细胞信号的改变,这进一步加速了IPF的进程。
IPF中的线粒体功能障碍总结见图1。
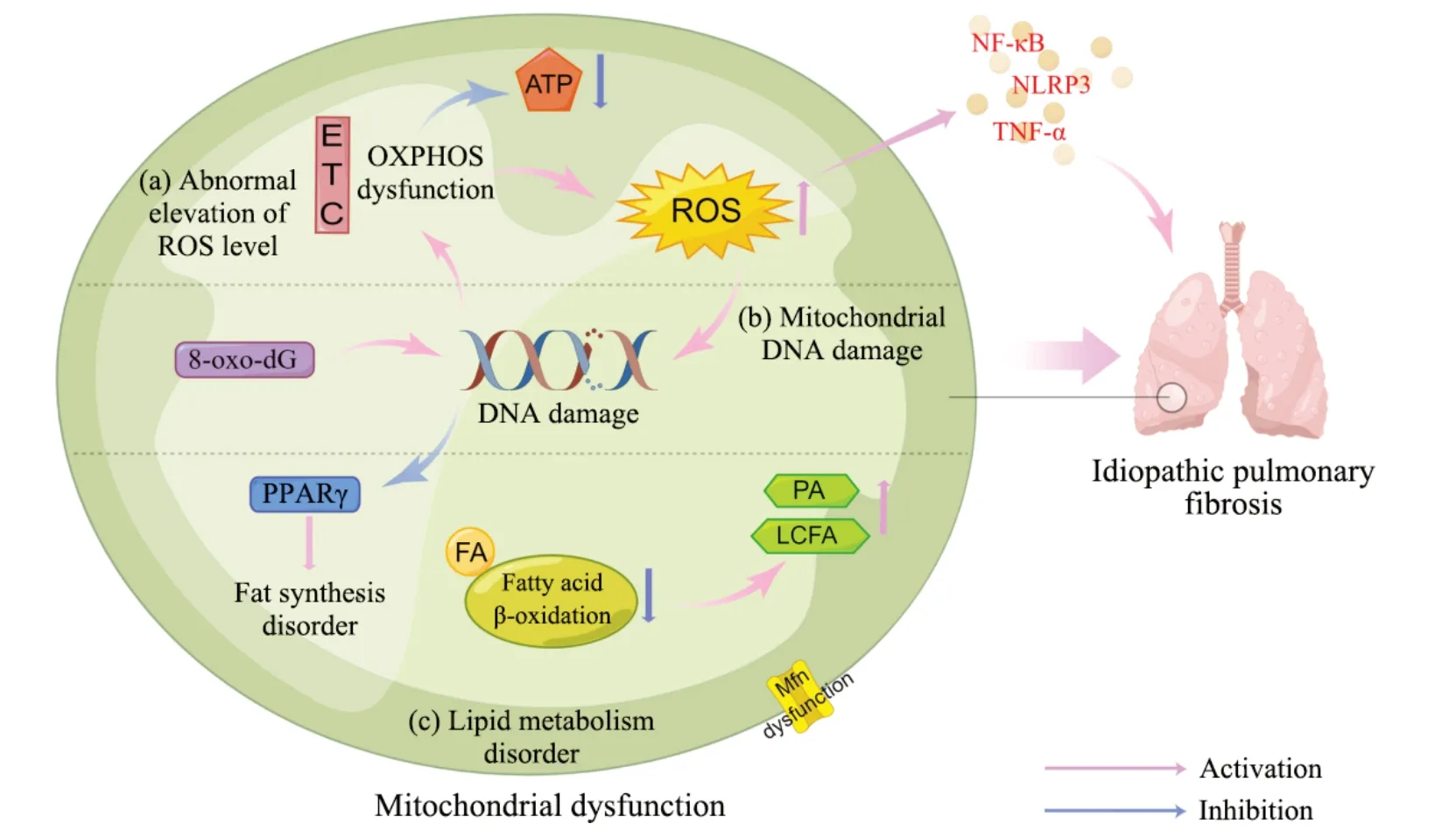
Figure 1.Mitochondrial dysfunction in idiopathic pulmonary fibrosis(created with Figdraw).ROS: reactive oxygen species;ETC:electron transport chain;OXPHOS: oxidative phosphorylation;ATP: adenosine triphosphate;8-oxo-dG: 8-oxo-7,8-dihydro-2'-deoxyguanosine;PPARγ: peroxisome proliferator-activated receptor γ;FA: fatty acid;PA: palmitic acid;LCFA:long-chain fatty acid;NF-κB: nuclear factor-κB;NLRP3: nucleotide-binding oligomerization domain-like receptor protein 3;TNF-α: tumor necrosis factor-α.图1 特发性肺纤维化中的线粒体功能障碍
2 SIRT3对线粒体功能障碍的调节作用
2.1 SIRT3概述 在归属上,SIRT3是“长寿蛋白”sirtuins家族的一员,sirtuins是依赖烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)的一类脱乙酰酶,参与细胞代谢,调节包括DNA修复、炎症反应,细胞周期或细胞凋亡等多种细胞功能[42]。在结构上,SIRT3含有一个保守的具有两个结构域的酶核心,包括一个与NAD结合的大罗斯曼折叠结构域和一个与锌原子结合的大结构域的两个插入形成的小结构域,乙酰化肽底物结合在两个结构域之间的缝隙上[43]。从人类遗传学的角度来看,衰老和sirtuins家族之间最有力的联系是SIRT3的多态性和长寿之间的关联,在sirtuins家族中目前只有SIRT3被报道可以影响人类寿命[44-45]。在分布上,SIRT3同SIRT4和SIRT5一样都只存在于线粒体中[46]。在功能上,SIRT3已被证实参与线粒体代谢和体内平衡的几乎所有方面,可以保护线粒体免受各种损伤,其作为线粒体的主要去乙酰酶,在应激和细胞代谢中发挥重要作用[47]。相关的研究表明SIRT3与多种疾病有关,包括与年龄有关的疾病,心脏病、肿瘤和代谢疾病等一系列疾病[48]。SIRT3分布的特殊性决定了其与线粒体生理功能之间的关联性,其减轻IPF也主要是通过恢复线粒体受损的功能来实现的,见图2。

Figure 2.Mechanism of silent information regulator 3 (SIRT3) reversing mitochondrial dysfunction (created with Figdraw).ROS: reactive oxygen species;GSSG: oxidized glutathione;GSH: glutathione;NADPH: nicotinamide adenine dinucleotide phosphate;IDH2: isocitrate dehydrogenase 2;FOXO3a: forkhead box protein O3a;PPARγ: peroxisome proliferator-activated receptor γ;PGC-1α: PPARγ coactivator-1α;SOD2: superoxide dismutase 2;OGG1: 8-oxoguanine DNA glycosylase 1;8-oxo-dG: 8-oxo-7,8-dihydro-2'-deoxyguanosine;TFAM: mitochondrial transcription factor A;VLCAD: very-long-chain acyl-CoA dehydrogenase;LCAD: long-chain acyl-CoA dehydrogenase;MCAD: medium-chain acyl-CoA dehydrogenase;FA: fatty acid.图2 SIRT3扭转线粒体功能障碍的相关机制
2.2 SIRT3调节线粒体ROS水平 SIRT3主要通过激活体内的抗氧化机制来清除多余的超氧化物。超氧化物歧化酶2(superoxide dismutase 2, SOD2)可以将超氧化物转化为H2O2来清除线粒体内多余的ROS[49]。研究表明SIRT3通过去乙酰化激活SOD2来控制超氧化物水平,从而保护细胞免受氧化应激诱导的损伤[50]。此外,有报告表明线粒体SIRT3将叉头框蛋白O3a(forkhead box protein O3a, FOXO3a)封存在细胞核中,这增加了Sod2转录,从而增强线粒体清除ROS的能力[51]。同样遏制ROS的还包括PGC-1α,但PGC-1α主要通过激活ROS解毒酶来加速内源性ROS的清理,研究表明SIRT3可以通过对FOXO3的去乙酰化来上调PGC-1α的表达来遏制氧化损伤[52-53]。作为重要的细胞抗氧化剂之一,GSH前体N-乙酰半胱氨酸也可以直接清除ROS[54]。还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)是谷胱甘肽还原酶将氧化型谷胱甘肽(oxidized glutathione, GSSG)转化为还原型谷胱甘肽(glutathione, GSH)所必需的,异柠檬酸脱氢酶2(isocitrate dehydrogenase 2, IDH2)是线粒体NADPH主要生产者[55-56]。研究表明SIRT3通过对IDH2去乙酰化来增加NADPH水平,这提高了GSH的水平[57]。SIRT3通过激活体内多种抗氧化剂来提高抗氧化能力,改善线粒体生物发生,并通过维持线粒体形态和完整性来保护细胞免受氧化损伤。
2.3 SIRT3调节线粒体DNA损伤修复 线粒体DNA损伤部分上由氧化损伤所诱导,所以激活ROS的清除机制是减少线粒体DNA损伤的重要手段,SIRT3所激活的抗氧化机制弱化了ROS对线粒体DNA的威胁。过量的ROS可将鸟嘌呤残基氧化为8-oxo-dG,这些加合物加入线粒体DNA会导致DNA损伤[58]。碱基切除修复酶OGG1是DNA中8-oxo-dG的主要水解酶,研究表明SIRT3可以通过去乙酰化OGG1来修复线粒体DNA损伤[59]。线粒体转录因子A(mitochondrial transcription factor A, TFAM)是线粒体转录起始和线粒体DNA包装中的关键因子,在病理条件下,TFAM的转录中断会导致线粒体DNA的耗竭和线粒体生物能的不足[60-61]。研究表明SIRT3通过去乙酰化增加TFAM的表达来促进线粒体生物生成,这在一定程度上保证了线粒体DNA的稳定[62]。除了调节线粒体DNA修复酶之外,SIRT3还可以调节抗氧化剂来保护DNA免受氧化损伤,研究显示SOD2和OGG1的过度乙酰化会导致肺泡上皮细胞线粒体DNA损伤和凋亡,但SIRT3可以通过对SOD2和OGG1的去乙酰化逆转这一进程[63]。因此,SIRT3主要通过调节修复线粒体DNA损伤相关酶和激活体内的抗氧化系统来保护线粒体DNA的稳定。
2.4 SIRT3调节线粒体脂质代谢 SIRT3通过对线粒体中脂质代谢相关酶的去乙酰化来发挥其代谢调节作用。研究表明SIRT3靶向如长链酰基辅酶A脱氢酶、中链酰基辅酶A脱氢酶和极长链酰基辅酶A脱氢酶等参与脂肪酸氧化的酶来清除累积的脂肪酸[64]。除了对线粒体酶去乙酰化之外,SIRT3还可以通过降解β-连环蛋白继而激活其下游的PPARγ,这不仅可以维持线粒体脂质代谢稳态,还能够阻断由转化生长因子β诱导的纤维化进程[65]。脂质代谢的关键因子PGC-1α也可以被SIRT3所激活,但SIRT3是否可以通过调节PGC-1α来直接作用于线粒体脂质代谢还需要进一步的研究来证实。除了以上方式外,SIRT3还可以通过调节脂联素来激活PPARγ与PGC-1α,脂联素可以降低甘油三脂水平并以AMP活化蛋白激酶(AMP-activated protein kinase, AMPK)和PPARγ依赖性方式刺激脂肪酸氧化[66]。此外,有研究显示SIRT3的激活会提高Mfn水平,作为验证,SIRT3被敲低后Mfn水平无明显变化,这表明SIRT3可以通过Mfn来调控磷脂和胆固醇水平[67]。总而言之,SIRT3主要通过调节线粒体内脂质代谢相关因子来维持脂质代谢水平的稳定。
3 SIRT3通过调节线粒体功能障碍减轻肺纤维化
无论是线粒体DNA损伤还是线粒体的脂质代谢异常都与线粒体内ROS水平息息相关,ROS参与了线粒体功能障碍的全过程。SIRT3可以通过调节一系列的抗氧化酶来稳定线粒体ROS水平继而延缓IPF的进程。研究表明SIRT3缺乏并由此导致的SOD2去乙酰化限制存在于IPF中,抗氧化剂限制会增加由ROS诱导的线粒体DNA损伤,该研究为SIRT3通过调节抗氧化剂来减轻IPF提供了直接证据[68]。加合物8-oxo-dG异常是引起线粒体DNA损伤的重要原因之一,它通过复制过程中的错误配对诱导基因突变,而SIRT3可以调节线粒体DNA修复酶OGG1的乙酰化来水解氧化8-oxo-dG,从而减少线粒体DNA的损伤。相关的研究表明在IPF的病理环境下,SIRT3的过表达恢复了OGG1的水平和活性并阻止了线粒体DNA损伤,从而保护肺部免于纤维化或减轻已经存在的纤维化,这表明SIRT3也可以通过修复线粒体DNA来减轻IPF[69]。在IPF中FA降解不足会导致脂肪代偿性消耗以满足机体正常需求,FA的异常累积又会加速了IPF进程[70]。SIRT3既通过抑制线粒体ROS的过量产生以及改善线粒体功能的来保障线粒体的脂质代谢功能稳定,又可作用于脂肪酸分解相关酶来直接参与脂质代谢。衰老也是IPF的一个重要的驱动因素,线粒体功能障碍可以驱动衰老细胞表型,作为延缓衰老的重要因子,SIRT3通过改善线粒体生物功能来逆转衰老进程,进而延缓了IPF进程[71-72]。线粒体功能障碍是导致IPF的重要因素,作为线粒体内主要的脱乙酰酶,SIRT3通过维持线粒体内氧化还原动态平衡、促进线粒体DNA修复以及调节脂质代谢来恢复线粒体的正常功能,而这对于延缓IPF的病理进程具有重要意义。
4 小结与展望
综上所述,线粒体DNA的损伤,线粒体ROS的异常以及线粒体脂质代谢的异常存在于功能障碍的线粒体中,功能障碍的线粒体会营造一个促IPF的环境,而IPF的病理进程又进一步加剧了线粒体的功能障碍,SIRT3作为一个关键因子,它既能清除过量的ROS来保障线粒体DNA及其脂质代谢功能免于氧化应激所带来的损伤,又可以直接调节相关因子来保护线粒体DNA以及缓解线粒体脂质代谢的异常。
近年来,关于SIRT3调控线粒体功能障碍以及线粒体功能异常对IPF影响的研究不断深入,但SIRT3直接调控IPF的研究还相对不足,相关调控机制尚未完善,尤其是在IPF病理环境下SIRT3以何种机制缓解线粒体的多种功能障碍。同时,SIRT3在癌症中的作用也存在争议,由于IPF的病理环境使其更容易发展为肺癌,所以使其靶向抑癌并且不触发相应的促癌机制也是研究的重点。当前尚无特异性或选择性的SIRT3激活剂和抑制剂,因此靶向SIRT3的单体药物及联合药物的研发具有广阔的前景。总的来说,目前亟需深入对IPF背景下SIRT3调节线粒体功能障碍的研究,并以此为基础探寻疾病发生发展的新机制。此外,将SIRT3与线粒体相联系将有望成为未来治疗IPF的突破口。

