铁自噬介导铁死亡机制和检测方法的研究进展*
郭 婕, 王玉龙, 麦凤怡, 杨文涛, 梁靖蓉, 舒俊翔, 李陈广1,△
(1深圳大学医学部生物医学工程学院,医学超声关键技术国家地方联合工程实验室,广东省生物医学信息检测与超声成像重点实验室,广东 深圳 518060;2深圳市第二人民医院,广东 深圳 518025;3华中科技大学协和深圳医院,广东 深圳 518052)
1 铁死亡发生机制
在多细胞生物组织稳态的正常发育和维持过程中,以及消除受损、感染或衰老的细胞过程中依赖于程序性细胞死亡(programmed cell death, PCD)信号事件的严密调控。PCD主要包括细胞凋亡、坏死性凋亡、细胞焦亡、铁死亡以及自噬等死亡方式[1]。而铁死亡这一概念最早在2012年由Dr.Dixon提出,它是一种铁依赖性的脂质过氧化、活性氧自由基大量累积所致的细胞死亡方式,与氨基酸、脂质和糖等生化分子的代谢生理过程紧密相关,且是心血管疾病、肿瘤和肾衰竭等疾病的病理基础之一[2]。受到细胞内多种代谢途径的调控,其中包括氧化还原稳态、铁代谢、线粒体活性和氨基酸、脂质、糖的代谢等[3]。
现阶段铁死亡的主要机制有两个,一是system Xc-/GPX4途径,即胱氨酸(cystine)经嵌于细胞膜表面SLC7A11和SLC3A2二聚体(system xC-)进入细胞,然后被氧化成半胱氨酸(cysteine),经谷氨酸-半胱氨酸连接酶和谷胱甘肽合成酶的催化作用下合成谷胱甘肽(glutathione)。谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)利用GSH能够将脂质过氧化的过氧键(L-OOH)转变为羟基(L-OH),失去其过氧化物的活性;此过程起到抑制细胞铁死亡的作用(图1)。另一重要途径为铁代谢途径(iron metabolic),即Fe3+经转铁蛋白(transferrin, TF)及转铁蛋白受体(transferrin receptor protein 1, TFR1)摄取,被金属还原酶(six-transmembrane epithelial antigen of the prostate 3, STEAP3)。还原为Fe2+,后经DMT1、铁代谢调节因子蛋白(ZIP8/14)转运进入胞质不稳定铁池(labile iron pool, LIP)。在过量Fe2+存在的情况下,可通过芬顿反应增加活性氧生成,促进过氧化脂质形成,从而诱发细胞铁死亡。铁在脂质过氧化的过程中介导活性氧的产生和酶活性的改变,因此,铁代谢的许多方面,如铁的摄取、储存和利用等,都受到严格的调控,铁代谢和铁死亡密切相关。在正常生理状态下,细胞内未被利用的Fe2+被铁蛋白的重链亚基(ferritin heavy chain, FTH)氧化为Fe3+,Fe3+既可以储存在铁蛋白中,也可以通过细胞膜上的铁转运输出蛋白1(ferroportin 1, FPN1)运输出至细胞外[4]。研究发现, NCOA4与FTH1相互结合并介导FTH1发生自噬性降解,从而释放Fe2+,这一过程被称为铁自噬(ferritinophagy)。铁自噬促进Fe2+的释放引起细胞内游离铁的浓度升高,最终促进铁死亡的发生[5](图1)。铁自噬与多种癌症、神经退行性疾病、心血管疾病和肝脏等疾病的发生发展过程密切相关,通过调控铁自噬的发生将有望成为治疗相关疾病的潜在治疗策略和靶点[6-8]。

Figure 1.Ferroptosis signaling pathways[3].图1 铁死亡信号通路
1.1 铁死亡的关键指标 目前研究者主要根据铁死亡在细胞形态、代谢和分子生物学方面的改变进行检测。
1.1.1 形态学特征 透射电子显微镜是目前最为直观的观察手段,超微结构显示铁死亡时,线粒体变小、线粒体嵴消失、线粒体膜密度增加及外膜破碎等变化,但细胞核形态正常[3]。
1.1.2 细胞内亚铁离子检测 Fe2+的不稳定性和高反应活性,通过芬顿反应产生羟自由基,可直接与细胞膜、质膜中的多不饱和脂肪酸反应,产生大量脂质ROS,导致铁死亡。铁离子的变化是铁死亡的关键,通过荧光探针FerroOrange、RhoNox-1和FRET iron probe 1可简单快速高效地对活细胞内的Fe2+进行荧光成像[9-11]。
1.1.3 谷胱甘肽含量的检测 谷胱甘肽的耗竭是细胞执行铁死亡的重要原因之一[3]。谷胱甘肽包括还原型谷胱甘肽(reduced glutathione, GSH)和氧化型谷胱甘肽(oxidized glutathione disulfide, GSSG)两种形式。它的检测原理为GSH能够与二硫代二硝基苯甲酸反应,产生一种在波长为412 nm处有最大光吸收的黄色产物,通过比色法可对 GSH 的水平进行定量测定[12]。
1.1.4 ROS及脂质过氧化 铁依赖性脂质ROS积累与所有途径的铁死亡相关。不受限制的脂质过氧化是铁死亡的标志。因此,铁死亡表现为脂质过氧化和ROS水平升高。目前主要使用2',7'-二氯荧光素二乙酸酯(2',7'-dichlorodihydrofluorescein diacetate, DCFH-DA)荧光探针检测细胞内ROS水平,DCFH-DA本身没有荧光,可自由穿过细胞膜,被细胞内的酯酶水解生成DCFH;细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的DCF。检测DCF的荧光强度间接反应细胞内活性氧的水平[13]。另外使用C11-BODIPY581/591[14](细 胞 内)、Liperfluo[15](细 胞内)和MitoPeDPP[16](线粒体内)试剂的检测,反映脂质过氧化水平。LOOHs作为脂质过氧化物的初级产物会被分解成一系列醛类化合物,检测丙二醛(malondialdehyde, MDA)和4-羟基壬烯醛(4-hydroxynonenal, 4-HNE)的含量,能够在一定程度上间接反映铁死亡中脂质氧化的程度[17]。
1.1.5 铁死亡关键调控基因和蛋白水平的检测当铁死亡发生时,谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)、溶质载体家族7成员11(solute carrier family 7 member 11, SLC7A11)和TFR等主要调控分子的基因表达和蛋白表达水平会发生相应变化,利用荧光定量PCR和Western blot检测关键蛋白的基因转录和翻译水平的变化[7-8,17],可为细胞铁死亡检测提供依据。
2 铁自噬及过程
2014 年,Mancias[5]等通过自噬体分离和定量蛋白质组学的结合已经确定核受体辅激活因子NCOA4是负责自噬依赖性铁蛋白降解的货物受体,NCOA4的C末端结合了吞噬体中FTH1上的一个保守的表面精氨酸(R23),随后FTH1在NCOA4的介导下被吞噬体“吞噬”,吞噬体逐渐扩展成一个完整的囊泡,称之为“自噬体”,随后吞噬FTH1和NCO4A的自噬体和溶酶体融合成一个自噬溶酶体,对FTH1进行降解,释放铁离子[18]。这一过程为铁自噬(ferritinophagy)。铁自噬是降解铁蛋白释放游离铁的过程,当细胞内的游离铁不足以维持生命活动时,细胞通过启动铁自噬维持铁稳态。而铁离子在胞内积累过多超过体内调节平衡时,过多的铁离子则通过芬顿反应产生大量的活性氧造成细胞损伤,最终引起铁死亡(图2)。
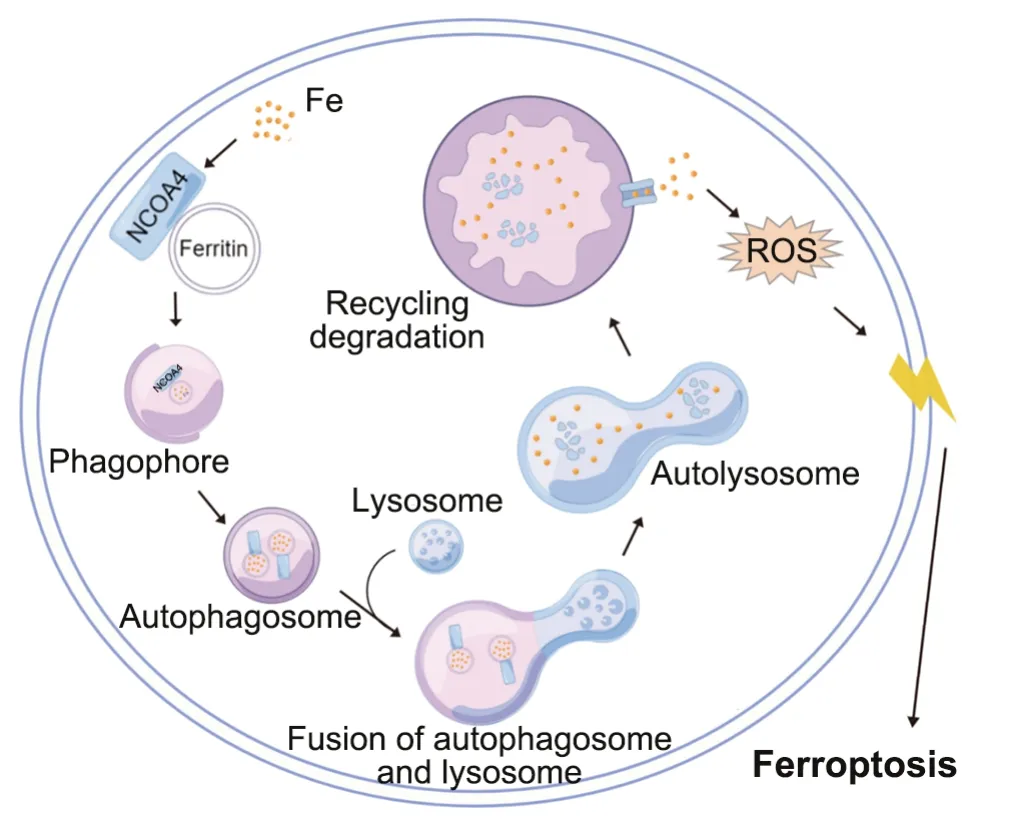
2.1 参与铁自噬的关键分子
2.1.1 NCOA4 NCOA4是一种雄激素受体(androgen receptor, AR)辅激活因子。以配体依赖的方式与AR相互作用以增强其转录活性,同时也是定位在细胞核的选择性运载受体[19]。近年来研究表明NCOA4是铁自噬过程中的关键分子,NCOA4保守的C末 端 及 NCOA4α中 的L494、L498、I489、S492、W497区段选择性识别FTH1的R23,并结合形成NCOA4-FTH1复合体,然后与自噬相关基因LC3结合并形成自噬体,最终降解铁蛋白并释放游离铁[6]。E3泛素蛋白连接酶HERC2是细胞内调节NCOA4水平的重要蛋白。当胞内铁离子水平较高时,NCOA4与HERC2结合增强,并在泛素蛋白酶体系统中降解,有利于铁离子储存于铁蛋白中[6,20]。相反,在细胞铁离子较低时,NCOA4与HERC2的结合强度明显减弱,使得细胞内NCOA4水平增高,大大增加了NCOA4与FTH1的结合,从而使铁蛋白被降解,释放出游离铁,以补充细胞铁水平。HERC2、FTH1两者与NCOA4结合位点相同,这样的竞争结合关系可以调控细胞内铁含量的平衡及铁自噬的发生程度[5]。
2.2.2 FTH1 铁蛋白是细胞内铁离子储存的重要结构,由24个铁蛋白重链(FTH1)和轻链(ferritin light chain, FTL)亚基组成铁蛋白复合体,能够储存多达4500个Fe3+[21]。在细胞内,铁离子主要与FTH1结合,因此FTH1在铁超载与铁稳态中扮演至关重要的角色。2017年Gryzik[22]的研究结果表明,每个铁蛋白复合物最多能够结合24个NCOA4分子。NCOA4通过C端结构域选择性识别FTH1的亚基,并与之相结合;进一步研究发现,由于FTH1表面有16个高度保守的残基,而FTL表面没有,因此决定了NCOA4对FTH1的特异性识别和结合。FTH1可以结合及催化Fe2+,氧化为Fe3+[21],从而降低芬顿反应及ROS的产生。而细胞内高浓度的铁水平会抑制FTH1与NCOA4的结合,加速NCOA4的降解,同时导致铁蛋白降解和抑制铁死亡。当细胞对铁的需求增加或处于低水平时,可增强FTH1与NCOA4结合,分解和释放游离铁以维持正常细胞稳态[23]。
2.2.3 自噬相关基因与铁自噬 在特定条件下对大分子或细胞器的靶向结合并降解称为选择性自噬。铁自噬作为选择性自噬的一种,在铁耗竭时,FTH1自噬性降解并释放铁离子,从而维持体内的铁稳态。研究发现铁自噬的发生需要自噬相关基因(autophagy-related gene, ATG)的介导[24]。微管相关蛋白1轻链3(MAP1-LC3),是铁自噬发生的重要参与蛋白。 在铁自噬发生过程中,LC3与 NCOA4-FTH1复合物结合,最终将形成自噬体。敲除或敲低ATG5和ATG7,可抑制Erastin诱导的铁死亡,表现为细胞内游离铁水平降低,Fe2+介导的芬顿反应减弱,ROS减少及GSH水平增加。另一方面,在自噬体膜的形成阶段,ATG7可使ATG5和ATG12通过共价方式结合。在口腔鳞癌细胞中,抑制ATG7表达,可增强肿瘤细胞迁移,在机制上可能与铁自噬受到抑制有关[25]。
3 铁自噬的检测
铁自噬最终也是导致细胞发生铁死亡,除了铁死亡常规检测方法外,则需针对铁自噬过程中如FTH1与NCOA4的结合、自噬溶酶体的形成以及最后铁离子释放等方面进行实验检测,以证明铁自噬参与介导铁死亡的发生(表1)。

表1 铁死亡和铁自噬检测方法比较Table 1.Comparative detection methods for ferroptosis and ferritinophagy
3.1 FTH1及NCOA4基因及蛋白水平的检测 在铁自噬过程中,NCOA4能够结合FTH1并将其转运到自噬体内,通过自噬途径降解FTH1释放游离的铁离子。因此,NCOA4和FTH1的基因及蛋白水平的变化可以作为确定铁自噬发生的重要指标之一。常用的检测方法包括实时荧光定量PCR技术检测mRNA的表达水平,Western blot、免疫荧光和免疫组化检测细胞或组织的蛋白表达水平。Western blot作为较为常规的方法,具有高灵敏性、特异性、可重复性及可定量等优点,但在具体实验中需结合实验设计,检测不同时间及诱导剂的作用,对NCOA4及FTH1的蛋白质表达变化。铁自噬是一个通过自噬降解FTH1的过程,与此同时,NCOA4也会被泛素化降解。虽然蛋白水平下降,但 mRNA转录水平不一定有所变化,因此利用荧光定量PCR方法检测NCOA4及FTH1的基因的转录水平变化,可以从基因表达水平上更好地了解铁自噬的发生和调控的相关机制。
铁死亡的不同诱导剂(表2)可明显诱导NCOA4和FTH1的蛋白质表达水平下降。如Mancias[5]等利用Deferoxamine处理,通过减少细胞内的铁离子,诱导NCOA4和FTH1蛋白质的水平降低。但是NCOA4的缺失抑制了铁蛋白吞噬作用,增加了铁蛋白水平,使细胞对Erastin更有抵抗力,但意外地对RSL3更敏感。研究发现Erastin可促进过表达NCOA4的HeLa细胞中铁蛋白的结合作用,增加了游离铁、脂质过氧化和对铁自噬的敏感性,降低NCOA4和FTH1的表达。相反,RSL3没有调节铁蛋白吞噬作用,而NCOA4的过量表达反而延迟了RSL3诱导的细胞死亡,这表明RSL3的作用机制与铁蛋白降解过程是无关的[26]。因此,在执行铁蛋白吞噬过程中,铁蛋白-铁的释放似乎取决于诱导剂的种类、其目标分子和细胞死亡激活的下游途径。

表2 铁死亡的诱导剂Table 2.Summary of the representative inducers of ferroptosis
3.2 FTH1与NCOA4相互结合 由于铁自噬的第一步是FTH1和NCOA4的相互结合(图2)。检验蛋白之间相互作用的常用方法有免疫共沉淀(co-immunoprecipitation, Co-IP)、邻近连接酶分析(proximity ligation assay, PLA)和pull-down等技术。如Liu等运用免疫共沉淀技术,验证了NCOA4和FTH1相互结合作用[8]。PLA也是一种较新的检测细胞或组织中蛋白质相互作用的技术,是通过DNA寡核苷酸探针进行检测,能放大相互作用信号,具有高度灵敏性。但Duolink-PLA不能用于活细胞,因为抗体和探针需要渗透才能找到靶蛋白。而且一些PLA试剂如酶或DNA寡核苷酸可能破坏细胞的活性。铁自噬中FTH1和NCOA4的结合在起始阶段,因而处理的反应时间很影响实验的结果,不一定可以捕获最好的结合时间。另一方面,pull-down技术能够确定两种或多种蛋白之间相互作用的检测方法,首先要利用基因重组技术构建含有亲和标签与诱饵蛋白基因的载体,然后通过表达纯化得到带亲和标签的诱饵蛋白,该诱饵蛋白可固定在某种基质上以吸附细胞裂解液中的能与诱饵蛋白互作的蛋白,洗脱后即可得到目的蛋白,对目的蛋白进行检测可实现诱饵蛋白与目的蛋白相互作用的分析。常见的诱饵蛋白有亲和标签包括谷胱甘肽S-转移酶(GST)标签、多组氨酸(6×His)标签进和生物素biotin标签等。如Li[27]等使用biotin-NCOA4的 pull-down实验发现 PTBP1参与铁自噬的过程。
值得注意的是,FTH1和NCOA4结合后,进行自噬性降解,其蛋白水平逐渐下降。因此在检验这两个蛋白相互作用时,应在铁自噬发生的早期检测,否则将会因为蛋白质的降解而影响了实验的结果。如Li等[7]发现LPS处理细胞6小时后FTH1的蛋白表达水平开始下降。因此应在更早期(6小时前),应用co-ip实验技术验证NCOA4和FTH1互作作用。
3.3 溶酶体与FTH1-NCOA4复合物形成自噬溶酶体 铁自噬过程中,NCOA4和FTH1结合后会与溶酶体融合形成自噬溶酶体中,并发生自噬性降解(图2),通常使用免疫荧光共定位进行分析。1973年Trump等人通过电子显微镜发现,溶酶体和自噬小泡中有大量的铁蛋白颗粒,从而证实了FTH1的降解与溶酶体和自噬小体密不可分[28]。Fang等[29]通过使用溶酶体和FTH1的特异性抗体或荧光标记,验证FTH1进入溶酶体这一过程。值得注意的是,Joseph[5]等在铁自噬早期通过免疫荧光共定位分析发现,NCOA4的降解阻断了FTH1进入溶酶体,也进一步说明NCOA4结合FTH1,对其与溶酶体融合的重要性。因此,也可通过敲低/除细胞内的NCOA4或FTH1,以反向验证铁自噬的发生。但当溶酶体发生溶解后,溶酶体膜破碎后,溶酶体标志物溶酶体相关膜 蛋白2(lysosomal-associated membrane protein 2,LAMP2)或者溶酶体的荧光探针Lyso-Tracker则较难结合到溶酶体膜上或者随着被降解消失;因此,验证溶酶体与FTH-NCOA4复合物形成自噬溶酶体的过程,需精确控制反应时间点。或者将FTH1用荧光蛋白GFP标记,同时使用溶酶体的荧光探针Lyso-Tracker,通过时差荧光显微镜,采用时间间隔(如15 s)不断拍摄,捕获荧光图像进行融合,即可动态观察FTH1-NCOA4进入溶酶体这一过程。
3.4 自噬相关蛋白检测 检测自噬相关蛋白的动态变化,有助于确认铁自噬途径是否被激活以及激活程度。Mancias完整提取自噬小体并采用质谱法鉴定出NCOA4为最富集的蛋白质,通过与NCOA4共定位确定了其他自噬标记物如LC3在铁自噬中的重要作用[5]。研究表明除了LC3,自噬相关基因Atg5、Atg 7和p62在铁自噬中都扮演重要角色。
LC3被认为是细胞自噬信号通路最为关键的标志性蛋白。利用Western blot检测LC3-II/ I的比值的变化以评价自噬形成的水平。或者利用mCherry-EGFP-LC3双荧光指示系统,Lenti-mCherry-EGFPLC3-II慢病毒感染细胞后,在非自噬的条件下,荧光显微镜下mCherry-EGFP-LC3-II以弥散的黄色荧光(mCherry和EGFP的综合效果)形式存在于细胞质中;而发生自噬时,荧光显微镜下mCherry-EGFPLC3-II则聚集在自噬体膜上,以黄色斑点的形式表现出来(LC3-II dot or punctae);当自噬体与溶酶体融合后,溶酶体内的酸性环境会导致EGFP荧光淬灭而最终以红色斑点的形式表现出来。因此,可以通过LC3双荧光指示系统监测自噬流的发生。另外,GFP-LC3单荧光系统也可以与NCOA4或FTH1免疫荧光共定位,从而直接证明铁自噬的发生。
除了LC3外,其他自噬基因如ATG5、ATG7和p62的表达量变化也可以用于监测自噬流。因此,通过qPCR和Western blot检测相关自噬基因的表达量也可评价自噬水平。
3.5 胞内铁离子(Fe2+和 Fe3+)检测 FTH1发生自噬性降解后释放出Fe2+,因此检测铁离子的变化是铁自噬的关键指标。目前检测铁离子最常用的实验手段之一是荧光探针法,荧光探针能够与游离铁进行结合形成配合物,并且在特定波长下发出荧光信号,从而检测细胞中铁含量。例如FerroOrange是一种特异性检测不稳定的Fe2+的荧光探针。一旦与Fe2+反应后,不可逆的生成一种橙色荧光产物(Absmax=542 nm,FLmax=572 nm)。Fe3+或其它除铁离子以外的二价金属离子都不会使其荧光增强。FerroOrange也不会与铁蛋白和其它物质中的螯合铁反应。FerroOrange具强细胞膜渗透性和低细胞毒性,非常适用于活细胞成像。Gao等[30]利用荧光共振能量转移效应机制设计出一款对细胞内Fe3+可视化的荧光探针RhoNox-1和FRET iron probe 1。除了荧光探针外,如原 子吸 收光谱 法(atomic absorption spectroscopy,AAS)及电感耦合等离子法(inductively coupled plasma mass spectrometry, ICP-MS)也能够检测铁离子。AAS是一种分析铁离子含量的常用方法,利用特定波长的光辐射原子,使其处于激发态,然后测量其吸收的光强度。由于每种元素的原子具有特定的能级结构和光谱特性,因此可以通过测量光强度来确定样品中铁元素的浓度。ICP-MS技术是将样品原子化,并使其离子化后,采用质谱进行检测,是目前应用于量化细胞内或生物体内总铁含量最为准确的技术之一,高精度和高灵敏是该方法的优点,但这种方法也存在一些检测局限性,如样品需要进行复杂的前处理、设备和操作成本相对较高,需要专业的技术人员来操作和维护设备。目前这一技术也被应用在铁死亡的相关研究中,该技术具有灵敏度高、准确性高、适用性广及稳定性好的特点,但在检测铁自噬中铁离子变化时,二价铁和三价铁可能会发生相互转化,这可能会影响它们在原子吸收光谱中的吸收峰的位置和峰高度,可以通过分离铁蛋白的方式来检测游离铁离子的含量。
3.6 铁自噬相关基因检测 发生铁自噬时会涉及相关基因表达的变化,这些基因的产物参与调控铁自噬的发生,因此检测这些基因的表达变化也是确定细胞是否发生铁自噬的方法之一。可以通过荧光定量PCR检测铁自噬相关基因的表达变化,同时可以进一步利用Western blot检测验证这些基因对应的蛋白表达水平。利用GeneCards数据库图(https://www.genecards.org/),通过输入“ferritinophagy”关键字,数据库自动从125个数据库获取数据,整合出20个铁自噬相关基因(表3)。同时我们通过实验室优化和整理,获得了这20个基因所对应的引物序列信息(表4),并使用GENEMANIA (http://genemania.org/)在线分析工具,展示了这20个基因之间的相互作用网路关系图(图3)。

表3 铁自噬相关基因的名称和ID列表Table 3.List of ferritinophagy-related genes with gene symbol and ID

表4 铁自噬相关基因的正向引物和反向引物列表Table 4.List of ferritinophagy-related genes with forward and reverse primers sequences

Figure 3.Gene-gene interaction analysis for the ferritinophagy using the GENEMANIA database.图3 通过GENEMANIA数据库对铁自噬相关基因间的相互作用分析
4 结语
铁死亡作为一种新的死亡方式,与多种疾病的发生发展密切相关,而自噬作为一种大分子或细胞器的降解过程,在病理情况下也会导致细胞的死亡[31]。虽然越来越多研究证实铁死亡的发生伴随着自噬的激活,但铁死亡的发生并不是总依赖于自噬,可独立于自噬的激活而存在。铁死亡与自噬的关系目前仍未明确,其内在联系更为复杂,需要研究者们更多的研究与探索。
铁自噬调控机制和相关分子的研究正在迅速发展,涉及到许多复杂的调节过程。本综述针对目前关于铁自噬及其不同发生阶段的检测方法进行了归纳与总结。在实验中检测NCOA4和FTH1的结合,以及结合后发生的自噬性降解是验证铁自噬的关键。目前NCOA4是已知唯一铁自噬受体,介导FTH1进入溶酶体,融合成自噬溶酶体。Goodwin等[32]报道了一种与NCOA4不同的铁蛋白降解途径,该途径需要FIP200、ATG9A/VPS34和TAX1BP1的参与。因此后续可利用蛋白质免疫沉淀的方法来探究是否有存在除NCOA4以外的其他蛋白质能够与FTH1结合。使用特异性抗FTH1或NCOA4抗体将FTH1或NCOA4蛋白沉淀下来,再通过质谱检测分析与FTH1或NCOA4共沉淀的其它蛋白质,这可以促进铁自噬相关分子机制的深入研究。针对铁自噬的研究方法和策略仍需不断优化和改进。例如铁蛋白进入溶酶体的动态过程,很难用抗体检测到动态变化。因此需要将Lenti-EGFP-FTH1以及LentimCherry-NCOA4融合蛋白的慢病毒,感染细胞或组织后进行铁自噬检测,同时使用溶酶体的荧光探针Lyso-Tracker Deep Red以更好地动态观察NCOA4和FTH1结合后进入溶酶体的过程。
目前针对铁自噬的研究方法主要是基于细胞水平研究,迄今为止,铁自噬在体内尚无办法可以实现测量。Howard[33]等研发了一种自噬检测纳米颗粒,能够对自噬进行成像并在体内非侵入性地测量其通量。这些纳米颗粒具有近红外荧光色素Cy5.5的功能。通过静脉注射,可以使用磁共振或近红外荧光成像技术测量体内自噬体的通量。打破了自噬检测仅限于细胞水平的局限性,实现体内检测自噬程度,将有助于更好地了解自噬在各种疾病状态中的作用。因此需要研发新的技术和方法,以深入地了解铁自噬在疾病治疗中的潜在作用。
本综述主要介绍了铁自噬研究过程中较为常见的检测方法;在实际应用中,应针对不同的实验设计选择合适的实验方法,需结合不同的检测手段来分析铁自噬的过程,将有助于更准确地分析铁自噬的发生并深入探讨其机制。随着科学研究的不断进步与发展,我们期待未来能有更多实验技术和新型实验设备对铁自噬研究有更新的突破,为后续开展铁自噬在各类疾病在的发生发展提供便捷有利的技术支持。

