基于CRISPR/Cas9技术PCSK9基因敲除小鼠模型的构建及表型验证
托罗娜依·米吉提, 陈小翠, 崔元峰, 阿比旦·阿卜杜如苏力, 陈邦党, 马秀敏
(新疆医科大学1附属肿瘤医院医学检验中心, 乌鲁木齐 830000, 2基础医学院, 乌鲁木齐 830017;3第一附属医院临床医学研究院, 乌鲁木齐 830011)
前枯草杆菌蛋白原转换酶9(Preprotein convertase subtilisin/kexin type9,PCSK9)是一种主要由肝脏合成的丝氨酸蛋白酶,由12个外显子组成,位于染色体1p32.3上。PCSK9蛋白由N-端信号肽、前结构域、催化结构域和C-端结构域构成[1-2]。PCSK9是胆固醇稳态的重要调节因子[3],不仅与常染色体显性遗传高胆固醇血症相关,还能够有效调节体内脂质代谢水平,根据PCSK9对低密度脂蛋白胆固醇(Low-density lipoprotein cholesterol,LDL-C)调节作用的不同,可分为功能获得性突变(Gain-of-function,GOF)和功能缺失性突变(Loss-of-function,LOF)[4-5]。功能缺失性突变(Y142X或C679X)导致PCSK9合成、自身催化裂解、成熟和分泌障碍,使其在血浆中的水平降低,肝脏低密度脂蛋白受体(Low-density lipoprotein LDL receptor,LDL-R)的表达增加,LDL-C浓度降低,循环中的甘油三酯和胆固醇水平降低,对心血管疾病(CVD)具有保护作用[6]。而PCSK9功能获得性突变(D374Y)导致LDL-R降解增强,肝细胞表面LDL-R水平降低,血浆LDL-C水平升高,最终导致高胆固醇血症,进而引发心血管疾病[7-8]。由于PCSK9功能缺失性突变会引起LDL-C水平降低,因此成为降脂治疗药物的干预靶点,目前在临床上广泛应用的PCSK9单克隆抗体alirocumab和evolocumab,能够将LDL-C从基线水平降低60%,同时血清甘油三酯(Triglyceride,TG)降低15%[9],有研究证实,在动脉粥样硬化(ApoE KO)小鼠模型中使用PCSK9抑制剂可以有效减轻斑块面积[10],延缓动脉粥样硬化疾病的进展,而PCSK9的过度表达则造成主动脉胆固醇的聚集和更为严重的动脉粥样硬化表型[11]。
近年来,PCSK9抑制剂被证实具有良好的降脂、抗炎、降低心血管风险作用,主要适用于治疗纯合子型家族性高胆固醇血症和动脉粥样硬化性心血管疾病[12]。研究表明PCSK9与血脂异常、糖尿病、非酒精性脂肪肝等代谢性疾病密切相关[13],但其作用机制尚未完全阐明。本研究利用CRISPR/Cas9技术构建全身性PCSK9基因敲除(PCSK9 KO)小鼠,并通过q-PCR、Western Blot证实获得全身性PCSK9基因敲除小鼠,对其表型进行初步验证,为进一步研究PCSK9在心血管疾病中的作用机制奠定实验基础。
1 材料与方法
1.1 实验动物遗传背景为C57BL/6J的雄性野生型(WT)小鼠购自上海南方模式生物科技股份有限公司,实验动物生产许可证号:SCXK(沪)2019-0002,饲养于新疆医科大学动物实验中心SPF级屏障系统中,环境温度控制在22~25℃,相对湿度达40%~70%,光暗周期12 h,空气洁净度达1万级,自由进食和饮水。本实验经新疆医科大学第一附属医院动物实验医学伦理委员会批准实施(审批号:20211018-03)。
1.2 主要试剂与仪器基因组DNA提取试剂盒(Omega,货号:D4035-01);一步法反转录荧光定量试剂盒(北京天根生化科技有限公司,货号:FP313-01);QuantiNova SYBR Green 染料法PCR 试剂盒(QIAGEN GmbH,货号:208054);2X Taq PCR mix(北京天根生化科技有限公司,货号:KT202);BCA蛋白定量(赛默飞,货号:23225);RNA提取(TRIzolTM)试剂(赛默飞,货号:15596018);羊抗兔IgG-辣根过氧化物酶(abcam,货号:ab6789);兔抗山羊 IgG-辣根过氧化物酶 (proteintech, 货号:ab6721);ECL化学发光检测试剂盒(biosharp公司);Wako LabAssay cholesterol/Triglyceride(DAOS method)试剂盒(日本和光纯药,货号:635-50981,632-50991);PCSK9抗体(NOVUS,1∶100);LDL-R抗体(abcam,1∶1 000);HSP90抗体(proteintech,1∶1 000)。全波长酶标仪;低温冷冻高速离心机(美国Thermo Scientific公司);冷冻研磨仪(浙江美壁仪器有限公司);凝胶成像分析仪ChemiDoc M、凝胶电泳仪以及PCR扩增仪(美国Bio-Rad公司);琼脂糖凝胶电泳仪(北京市六一仪器厂)。
1.3 实验方法
1.3.1 单链向导RNA(Single guide RNA,sgRNA)靶点的选择及sgRNA、Cas9体外转录、显微注射及扩群 根据小鼠PCSK9基因的结构,利用非同源末端连接(NHEJ)修复引入突变的方式,通过在线sgRNA设计网站(http://crispor.tefor.net/)设计sgRNA,本研究敲除策略针对的转录本是(Ensembl号):PCSK9-201(ENSMUST00000049507.5),引导Cas9核酸酶定点发生剪切,敲除外显子2~5片段,敲除策略如图1。导致基因读码框发生移码突变,最终使蛋白功能缺失,经活性检测,确定序列为sgRNA 1(5′-3′): ACTGAGATGAGGTCATGCTGGG,sgRNA 2(5′-3′):CTTCCTGCTAAGCTTT-
GGCTGGG。在高倍显微镜下获得及鉴定阳性基因敲除品系,用显微操作器控制显微注射针向C57BL/6野生型(WT)小鼠的受精卵中注射Cas9 mRNA和sgRNA,并将注射后的受精卵移植到假孕母鼠中,新出生的小鼠为F0代小鼠。由于受精卵早期卵裂速度很快,因此得到的F0代小鼠为嵌合体,通过传代获得具有稳定遗传能力的F1代小鼠。
通过PCR扩增及测序方法鉴别出阳性F0代小鼠,挑选出阳性F0代小鼠与WT小鼠交配,获得PCSK9敲除F1代杂合子小鼠,鉴定方法同F0代阳性小鼠。PCR反应条件为:94℃预变性3 min;98℃变性15 s,61℃退火15 s,68℃延伸4 min,共35个循环;最后68℃延伸5 min。将获得的PCSK9杂合子小鼠通过自交得到F2代PCSK9基因敲除纯合子(PCSK9-/-)小鼠,并进行敲除验证和表型分析。
1.3.2 基因鉴定 (1)鼠尾基因组DNA提取:小鼠出生至2月龄后,剪取小鼠尾尖 0.5~1 cm,置于2 mL EP管中,参照Omega基因组DNA提取试剂盒操作方法,加入200 μL TL Buffer和25 μL OB蛋白酶,55℃水浴锅过夜。次日,12 000 r/min离心5 min,转移上清至DNA吸附柱,加入200 μL BL Buffer和200 μL无水乙醇,12 000 r/min离心1 min,弃废液,加入500 μL HBC Buffer,12 000 r/min离心1 min,弃废液,加入700 μL Wash Buffer 洗2次,将DNA吸附柱转移到1.5 mL EP管,加入20 μL加热至70℃的Elution Buffer,室温静置2 min,12 000 r/min离心1 min,收集DNA,NanoDrop 2000测定DNA纯度。(2)PCR扩增及琼脂糖凝胶电泳:鉴定引物序列(表1)由上海南方模式生物科技有限公司合成,PCR P1、P2、P3和P4反应体系如下(20 μL):2×Power Tag PCR Master Mix 10 μL,P1 0.5 μL,P2 0.5 μL,模板DNA 1 μL,灭菌ddH2O 8 μL。采用PCR 扩增仪进行循环扩增,反应条件:预变性95℃5 min;变性95℃ 15 s,复性60℃ 15 s,延伸72℃ 1 min,循环35次;最后延伸72℃5 min;12℃停留。取PCR产物8 μL,在1%琼脂糖凝胶中进行电泳分析,以110 V恒压由负极向正极电泳 25 min,在化学发光凝胶成像系统中拍照分析。

表1 引物序列信息
1.3.3 Western Blot检测肝脏PCSK9及LDL-R蛋白表达,心脏、脑、肾脏及脂肪组织中PCSK9蛋白表达 使用RIPA裂解液裂解肝脏、心脏、脑、肾脏及脂肪组织,研磨机研磨,超声破碎细胞,4℃下,13 000 r/min离心15 min,取上清,BCA蛋白定量,100℃金属浴变性10 min,取60 μg蛋白提取液,室温下SDS-PAGE分离蛋白,先以80 V恒压电泳30 min,待样品跑过浓缩胶后,再以110 V恒压电泳90 min,用湿转法以80 V恒压3 h转至PVDF膜上。5%脱脂奶粉封闭液中封闭2 h,0.1% PBST 洗膜 5次,每次5 min。PCSK9(1∶100)、LDL-R(1∶1 000)及HSP90(1∶1 000)在4℃下孵育过夜。PBST洗膜5 次,每次5 min,孵育二抗(1∶3 000)2 h,同上洗膜,ECL发光液孵育后,取出PVDF膜于凝胶成像分析仪上进行曝光分析,以HSP90为内参照,Image Lab对目的蛋白与HSP90灰度的比值进行蛋白表达分析。
1.3.4 实时荧光定量PCR检测肝组织PCSK9基因表达 使用TRIzol法提取肝组织总RNA,按照RNA逆转录试剂将RNA逆转录为cDNA,使用实时荧光定量PCR检测试剂盒扩增基因片段,反应条件:95℃ 2 min;95℃ 5 s,60℃ 10 s,循环40次。以18S作为内参照,采用2-ΔΔCt法进行计算。其中所用引物:PCSK9上游引物为5′-TATCCCAGCATGGCACCAGA-3′,下游引物为5′-ATGGTGACCC-TGCCCTCAA-3′; 18S上游引物为5′-TTGACGG-AAGGGCACCACCAG-3′, 下游引物为5′-GCACCACCACCCACGGAATCG-3′。
1.3.5 血清胆固醇(TC)、TG水平检测 小鼠饲养至4月龄,WT和PCSK9 KO小鼠禁食不禁水12 h后称重,腹腔注射1%戊巴比妥钠麻醉小鼠,心脏穿刺采血,血样室温放置1 h后,4℃冰箱放置2 h,4℃条件下以3 500 r/min离心15 min,收集血清样本冻存。取2 μL血清,用Wako LabAssay cholesterol/Triglyceride (DAOS method)试剂盒测定。
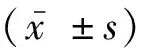
2 结果
2.1 F1代小鼠的筛选F0代小鼠与WT小鼠杂交后得到F1代杂合子小鼠,通过基因测序结果显示,目标区域缺失4 878个碱基对(图2A)。F1代小鼠,PCR后P1和P2出现837 bp,P3和P4出现568 bp两个条带的则为F1代杂合(HE)小鼠,如图2B。

注: A, PCSK9敲除前后测序结果对比; B, F1代杂合子PCR鉴定结果。
2.2 PCSK9基因敲除小鼠PCR鉴定将获得的F1代杂合子小鼠自交获得F2代小鼠,琼脂糖凝胶电泳结果显示,P3、P4扩增出568 bp条带的是WT小鼠,P1、P2扩增出837 bp条带的是PCSK9基因敲除小鼠(图3),继续繁育扩群,获得更多纯合小鼠。
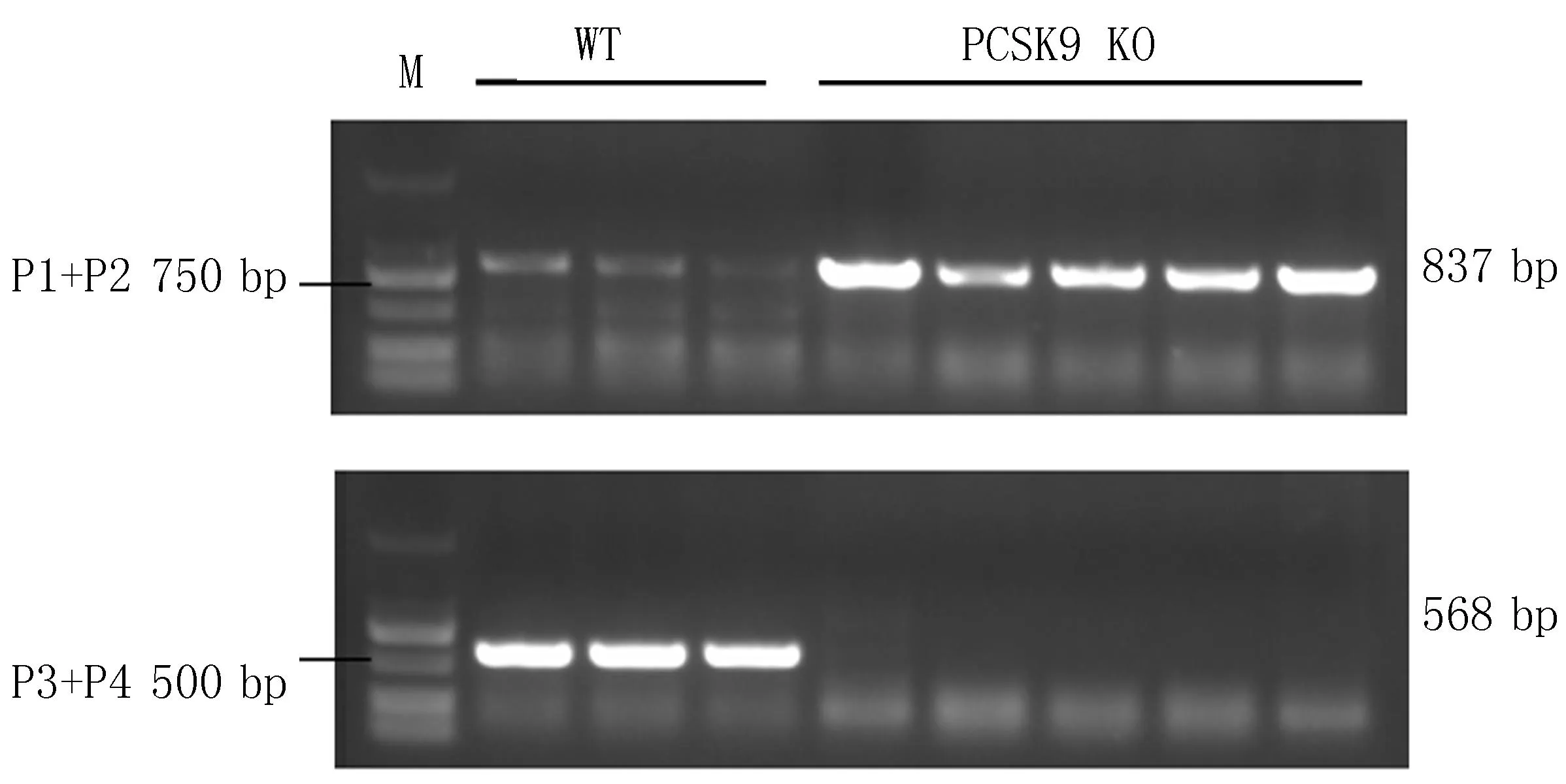
图3 PCSK9 KO小鼠PCR鉴定
2.3 小鼠肝组织中mRNA表达水平q-PCR结果显示,与WT小鼠(0.94±0.12)相比,基因敲除小鼠PCSK9 在转录水平表达量为0,差异有统计学意义(P<0.000 1),见图4。
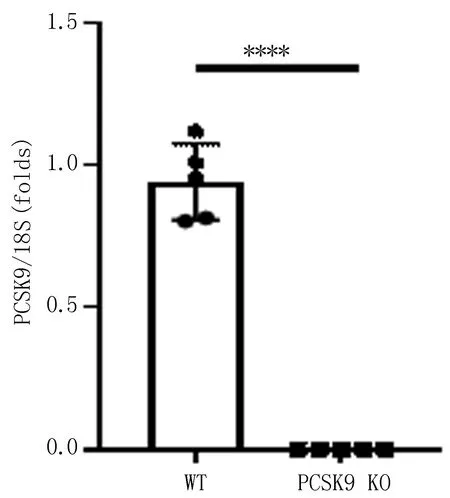
注: n=5, ****P<0.000 1。
2.4 PCSK9蛋白表达Western Blot检测结果显示,WT小鼠肝脏中PCSK9蛋白表达(1.000±0.250)较PCSK9 KO小鼠(0.007±0.003)升高;PCSK9 KO小鼠肝组织中LDL-R蛋白表达(3.42±0.56)较WT(1.00±0.21)显著升高,差异有统计学意义(P均<0.000 1)(图5A)。在PCSK9 KO小鼠心、脑、肾、脂肪组织中几乎检测不到PCSK9蛋白表达,证明成功构建获得PCSK9基因敲除小鼠(图5B)。
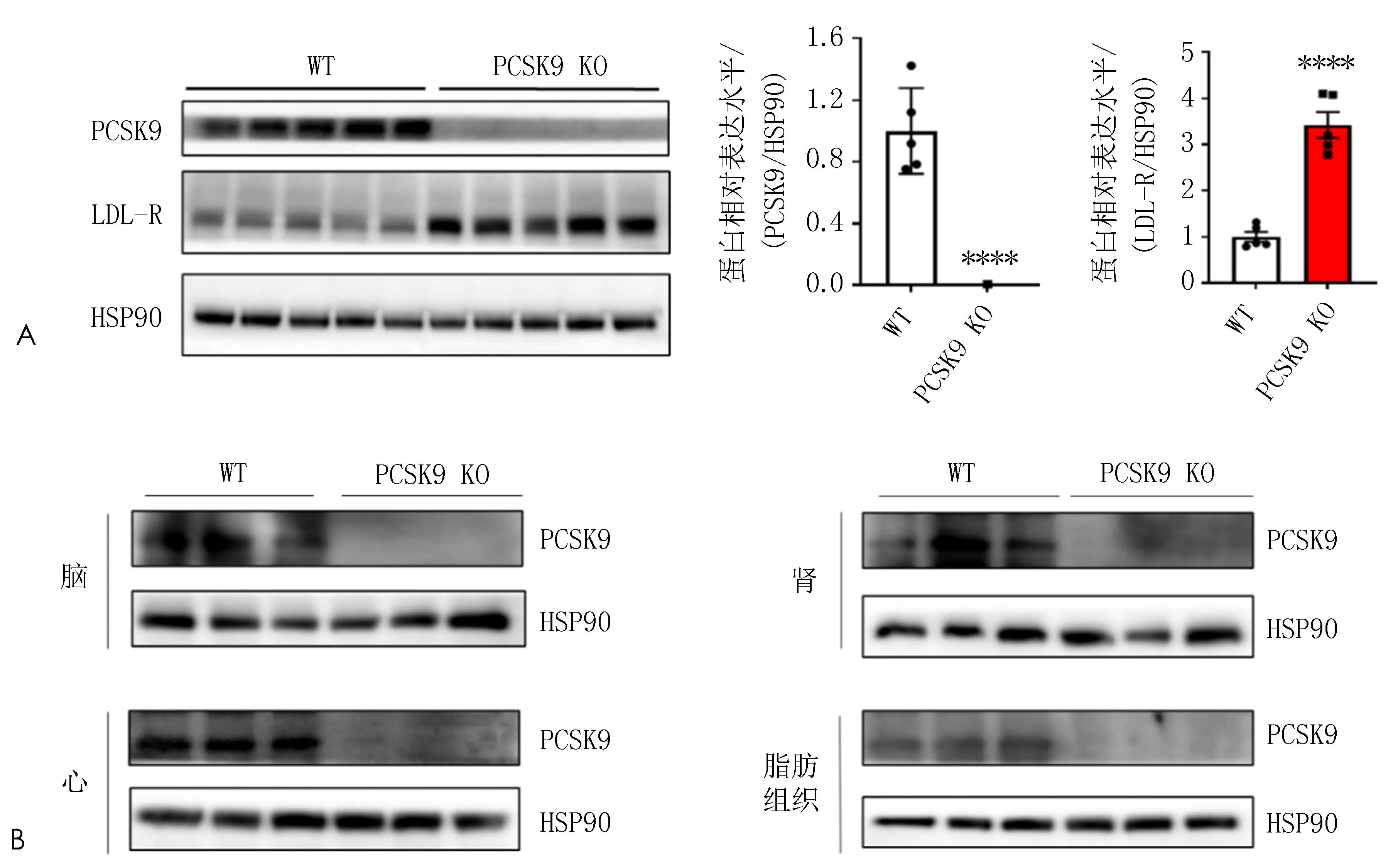
注:A,小鼠肝组织PCSK9、LDL-R蛋白表达水平(n=5, ****P<0.000 1); B, PCSK9在不同组织中的表达水平(n=3)。
2.5 PCSK9基因敲除对小鼠血清TC、TG水平的影响与WT小鼠相比,PCSK9 KO小鼠循环血清总胆固醇(TC)浓度显著降低(90.75±17.81 mg/dLvs54.19±2.42 mg/dL),甘油三酯(TG)浓度显著降低(81.26±11.98 mg/dLvs50.92±11.93 mg/dL),差异有统计学意义(P均<0.001)。
3 讨论
血脂异常是冠心病发病的重要危险因素之一,其中高胆固醇血症是诱发冠心病和动脉粥样硬化的关键风险因素[14-15],因此降低血液中LDL-C的水平成为防治动脉粥样硬化及冠心病极具价值的治疗手段。体内外实验和人类基因组研究表明,PCSK9是一种主要由肝脏合成的、在小肠和肾脏中表达较少[16],在胆固醇代谢中起关键作用的酶。有研究表明,PCSK9功能获得性突变是家族性高胆固醇血症的原因,而功能缺失性突变降低了LDL-C水平,由此认为PCSK9是降低胆固醇的生物靶点[17]。
本研究利用 CRISPR/Cas9 系统,将PCSK9基因2-5号外显子(exon 2-5)区域进行有效敲除,使该编码区域 4 878 bp 的基因序列缺失,造成PCSK9基因蛋白读码框移码,功能缺失,成功构建了全身性PCSK9基因敲除小鼠模型,使该品系在后续繁育保种过程中具有遗传稳定性的特点[18],是一个高效快速获得PCSK9基因敲除小鼠的方法。
PCSK9通过降解肝细胞表面的LDL-R来调节血脂代谢。临床研究显示,使用PCSK9抑制剂通过阻断PCSK9与LDL-R的结合,增加LDL-R的表达,促进肝细胞对LDL-C的清除,从而将血液中LDL-C从基线水平降低53%至56%,同时血清TG亦显著降低[19-21]。重组腺相关病毒载体介导PCSK9基因靶向转染小鼠肝脏以及PCSK9转基因小鼠模型中,PCSK9通过降低肝脏LDL-R表达,显著增加血浆胆固醇、甘油三酯和LDL-C水平[22-23]。本研究发现全身性PCSK9基因敲除小鼠,其血清TC、TG水平较WT小鼠显著降低,且肝脏组织中LDL-R蛋白显著上调,与既往报道相一致。本研究利用全身性PCSK9基因敲除小鼠模型,进一步证实PCSK9是调节肝脏脂质代谢的关键性蛋白酶,PCSK9介导LDL-R降解可能是其调节血脂异常的关键机制,PCSK9可作为防治血脂异常的药物研发的干预靶标。因此,通过敲低或者阻断PCSK9的合成和分泌,可能成为调脂治疗和防治动脉硬化性心血管疾病的有效干预策略。
PCSK9主要在肝细胞中合成,在小肠、肾脏、胰腺β细胞、巨噬细胞和血管平滑肌细胞甚至脂肪细胞中也有表达,PCSK9在多种器官和细胞中的表达意味着除控制LDL代谢之外,可能还发挥多种生物学功能。研究发现PCSK9在中枢神经系统发育、动脉粥样硬化发病、免疫应答和肿瘤发生等多种生物学功能中发挥作用[24]。基于遗传学的研究资料显示,在PCSK9基因功能缺失性突变的健康人群中,PCSK9基因功能的缺失与血浆LDL-C水平显著下降及冠心病发病率降低密切相关[25]。条件性敲除仅能研究靶基因在特定组织或细胞中的功能,因此,本研究构建全身性PCSK9基因敲除小鼠模型,能够更好地模拟人PCSK9基因功能缺失的临床特征,初步验证其表型并探讨PCSK9基因缺失对血脂水平的影响及其可能的机制,可为后续研究PCSK9在脂代谢紊乱相关疾病中的分子调控机制及药物研发奠定实验基础。

