粪菌移植治疗DSS诱导的小鼠溃疡性结肠炎的免疫学机制研究
刘 扬, 刘 青, 路 明
(新疆医科大学第一附属医院肛肠外科, 乌鲁木齐 830054)
溃疡性结肠炎(Ulcerative colitis,UC)属于一类复发性、慢性结肠炎症性疾病。研究认为,其发病机制可能与免疫功能紊乱、环境、肠道微生物、遗传等多因素相关[1],但具体机制仍需深入研究。UC的治疗主要依赖内科药物,如氨基水杨酸、糖皮质激素及免疫抑制剂等,但其疗效较为局限且副作用明显,而粪菌移植(Fecal microbiota transplantation,FMT)作为一种特殊的微生物移植方法,在功能性便秘、肝衰竭、自身免疫性脑脊髓炎、溃疡性结肠炎(UC)等疾病方面具有较好的治疗效果[2]。然而,FMT在UC中的具体作用机制尚不明确。有实验结果显示,经FMT治疗后,由葡聚糖硫酸钠(DSS)所致UC小鼠的体重、大便性状和远端结肠病理改变均有显著改善,说明FMT能够改善DSS所致的小鼠结肠炎[3]。FMT通过重建肠道微生态平衡、调整和抑制肠道紊乱引起的免疫炎症反应,稳定肠道免疫以达到治疗效果[4]。本研究旨在通过DSS诱导形成小鼠UC模型,验证FMT的疗效及其可能的免疫学作用机制。
1 材料与方法
1.1 实验动物与试剂雄性C57BL/6J,SPF级小鼠60只,8周龄,体重20~24 g,由湖北省疾病预防控制中心提供(使用许可证号:202310061)。葡聚糖硫酸钠(DSS)(源叶公司,货号:02160111080);HE染色试剂盒(经科化学,货号:L9406);ELISA试剂盒(货号: JL15150)、 小鼠白介素-6(IL-6)试剂盒(货号:FB-0111F1)、小鼠白介素-17(IL-17)试剂盒(货号:FB-0063F1)、小鼠白介素-22(IL-22)试剂盒(货号:FB-0079F1)、小鼠白介素-35(IL-35)试剂盒(货号:FB-0071F1)、小鼠肿瘤坏死因子α(TNF-α)试剂盒(货号:FB-0189F1)、小鼠可溶性Fas试剂盒(货号:FB-0182F1)均购自武汉丰宾生物科技有限公司。本实验已通过新疆医科大学第一附属医院伦理委员会的审批(审批号:202310061)。
1.2 粪菌的制备取10只雄性 C57BL/6J小鼠(不参与后续实验)的新鲜晨便5 g,溶于10 mL无菌生理盐水中,分别经2.0、1.0、0.5和0.25 mm不锈钢筛过滤,6 000 r/min,离心15 min,收集菌体,无菌生理盐水洗涤3遍,25 mL灭菌生理盐水重悬,置于4℃冰箱中保存备用。
1.3 动物分组、模型制备及处理[5]对50只雄性 C57BL/6J小鼠逐个称重,编号。采用随机数字表法随机分为空白组(n=10)、模型组(n=20)、研究组(n=20)。空白组自分组首日起自由饮用灭菌蒸馏水,正常饮食,连续30 d。模型组和研究组自分组首日起自由饮用2%DSS溶液,正常饮食,连续30 d,诱导形成溃疡性结肠炎小鼠模型。判定标准:光镜下结肠黏膜病理学检查提示,黏膜变薄,上皮结构缺失,腺体分布无规则性,固有层充血水肿,伴大量炎症细胞浸润及毛细血管充血、淋巴管明显扩张,弥漫分布小溃疡等病变。临床观察排便次数≥3次、排便质量为稀便或黏液便、排便量的增加符合溃疡性结肠炎的临床症状时确认模型成功。造模成功后,空白组不予处理,模型组予以生理盐水灌肠,研究组予以粪便混悬液生理盐水混合物灌肠,每3天灌肠1次,共2次。根据小鼠体重,本研究灌肠量设定为1.0 mL/次。在造模及实验过程中,用于留取大便的小鼠存活6只,空白组存活6只,模型组存活7只,研究组存活8只,共27只。
1.4 HE染色观察结肠组织病理形态表现[6]取最终存活的所有小鼠病变结肠部分组织,置于4%多聚甲醛中固定24 h,常规脱水、包埋和切片,根据HE试剂盒说明书进行苏木素-伊红染色,中性树胶封片,通过显微镜观察结肠组织病理受损情况。
1.5 ELISA法检测血清中炎症因子水平[7]在第2次灌肠结束后第2天处死小鼠,采集小鼠眼底静脉血1.0~1.5 mL,置于干燥的灭菌血清分离管内,室温静置2 h,待自然凝固,2 000 r/min,离心15 min,分离血清,-20℃冰箱存储备用。通过ELISA法测定肿瘤坏死因子α(TNF-α)、白介素-6(IL-6)、白介素-35(IL-35)、白介素-22(IL-22)、白介素-17(IL-17)与可溶性Fas等细胞因子水平。通过空白孔调零,测定每孔450 nm处的吸光度值(OD)。
1.6 肠道菌群测定[8]采用光冈氏肠内细菌群分析法定量测定肠道菌群值及双歧杆菌与肠杆菌的数量比值(B/E值),取模型组和研究组小鼠各0.5 g粪便,加入灭菌生理盐水充分振摇做成1︰10的均匀稀释菌液。取20 μL稀释菌液接种于肠杆菌、肠球菌、酵母菌、拟杆菌、双歧杆菌、乳酸杆菌及梭菌的选择性培养基中。需氧菌置于37℃普通培养箱培养48 h,厌氧菌置于28℃~37℃厌氧培养箱中培养72 h。参照API细菌鉴定系统(API bacterial identification system)的厌氧菌三级鉴定法鉴定菌种至属水平,计算各平板的平均菌落数,结果以每克湿粪的菌落形成单位(CFU)的对数值表示,即为菌群值。若B/E>1表示肠道菌群组成正常,若B/E<1表示肠道菌群失调,且B/E比值越低,提示菌群失调越严重。
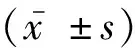
2 结果
2.1各组小鼠排便次数、排便量及体重的比较与空白组比较,模型组平均每日排便次数和排便量明显增多,体重下降(P<0.05);与模型组比较,研究组每日排便次数和排便量减少,体重上升(P<0.05),见表1。
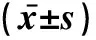
表1 各组小鼠排便次数、排便量和体重的比较
2.2 各组小鼠结肠组织病理形态表现空白组黏膜形态未见异常,腺体规则分布,各层结构完全且清晰,未见溃疡与炎性细胞浸润。模型组黏膜变薄,上皮结构缺失,腺体分布无规则性,固有层显示充血水肿,伴大量炎症细胞浸润及毛细血管充血、淋巴管明显扩张,弥漫分布小溃疡;研究组小鼠结肠黏膜病变程度较模型组有所减轻,但部分仍可见淋巴管轻度扩张,伴少量炎症细胞浸润,见图1。
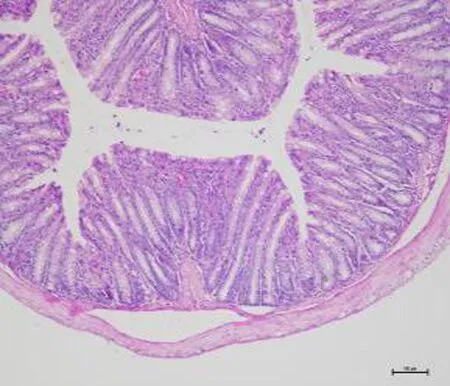
空白组 模型组 研究组
2.3 各组小鼠肠道菌群的变化与空白组比较,模型组和研究组肠杆菌、肠球菌、拟杆菌和梭菌的菌群值显著升高,B/E值降低(P<0.05);与模型组比较,研究组酵母菌、双歧杆菌和乳酸杆菌的菌群值显著增加,B/E值升高(P<0.05),见表2。

表2 各组小鼠肠道菌群的比较湿粪)
2.4 各组小鼠血液中炎症因子水平比较与空白组比较,模型组和研究组TNF-α、IL-6、IL-22与IL-17水平升高,IL-35与可溶性Fas水平降低(P<0.05);与模型组比较,研究组TNF-α、IL-6、IL-22与IL-17水平降低,IL-35和可溶性Fas水平升高(P<0.05),见表3。
3 讨论
结肠黏膜连续性炎症是UC的主要特征[9],但其发病原因尚不完全清楚。FMT是指向患者的肠道内植入健康者粪便内所含的所有菌群,以调控肠道微生态平衡,减轻炎症反应,帮助修复肠黏膜[10]。因此,FMT作为一类新疗法受到广泛重视。FMT可使UC小鼠肠道菌群结构发生改变,增强有益菌群数量,抑制有害菌群生长。Zhang等[11]研究表明,粪便菌群移植可通过调节肠道菌群,改善Th1/Th2和Th17/Treg失衡以控制实验性溃疡性结肠炎。但关于FMT治疗UC的免疫学机制研究尚有待深入研究。
本研究探讨利用FMT治疗DSS所致UC小鼠的效果及相关的免疫学机制。结果显示,与空白组比较,模型组小鼠平均每日排便次数和排便量明显增多,体重下降。提示模型组小鼠肠道发生炎症侵害,免疫功能受到影响,体重下降。与模型组比较,研究组每日排便次数和排便量减少,体重上升。说明粪菌移植治疗后肠道菌群趋于平衡,有益菌成为优势菌,肠道炎症改变逐渐减轻,小鼠肠道吸收功能及免疫功能逐步恢复,体重逐步增加。本研究结果显示,与空白组比较,模型组和研究组小鼠TNF-α、IL-6、IL-22与IL-17水平显著升高,而可溶性Fas与IL-35水平显著降低。与模型组比较,研究组小鼠TNF-α、IL-6、IL-22与IL-17水平显著降低,而可溶性Fas与IL-35水平升高。提示小鼠结肠受到炎症侵害时TNF-α、IL-6、IL-22与IL-17等促炎因子表达水平增高,可溶性Fas与IL-35水平等抑炎因子水平降低,炎症反应剧烈。对小鼠进行FMT治疗后,TNF-α、IL-6、IL-22与IL-17等促炎因子水平显著降低,可溶性Fas与IL-35等抑炎因子水平增高,炎症反应被控制,提示肠道FMT治疗可抑制肠道炎症反应,稳定肠道免疫[12]。组织病理形态结果显示,空白组小鼠结肠黏膜形态无异常,腺体规则分布,各层结构完整且清晰,未见溃疡与炎性细胞浸润。模型组小鼠结肠黏膜变薄,上皮结构缺失,腺体分布无规则性,固有层显示充血水肿,可见广泛的炎症细胞浸润、淋巴管明显扩张和弥漫分布小溃疡。表明在溃疡性结肠炎模型中,DSS处理会引起免疫失调和炎症反应的增强[13]。溃疡性结肠炎模型的建立导致了结肠组织的病理性损伤,免疫反应失衡及炎症因子的异常表达[14-15]。
基于以上结论,通过FMT治疗UC小鼠。结果显示,与模型组比较,研究组小鼠结肠黏膜病变程度有所减轻,部分小鼠仍可见轻度的淋巴管扩张,伴有少量的炎症细胞浸润。提示粪菌移植可改善溃疡性结肠炎小鼠的结肠组织病理损伤。在菌群值方面,与空白组比较,模型组和研究组小鼠肠杆菌、肠球菌、拟杆菌和梭菌的菌群值显著升高,B/E值降低。与模型组比较,研究组小鼠酵母菌、双歧杆菌和乳酸杆菌的菌群值显著升高,B/E值升高。提示粪菌移植可重建肠道菌群,维护肠道微生态平衡,降低溃疡性结肠炎的炎症反应[16],促进肠道菌群平衡,且抑制炎症因子的释放,促进肠黏膜的修复[17-18]。
综上所述,FMT能够改善DSS所致的UC小鼠的结肠组织病理性损伤,抑制TNF-α、IL-6、IL-17与IL-22等促炎因子水平的上调,通过升高IL-35和可溶性Fas等抑炎因子的水平来降低炎症反应。FMT通过重建肠道微生态平衡、调整和抑制肠道紊乱引起的免疫炎症反应,稳定肠道免疫以达到治疗效果。这为进一步研究UC的免疫学机制提供了新的线索和证据。
(本文编辑: 王艳、 尼丽帕尔·亚热)

