乙肝相关慢加急性肝衰竭患者6个月预后影响因素分析及模型构建
高冉冉, 曹 阳, 郑嵘炅, 张紫怡, 杨 丽, 唐努尔, 鲁晓擘
(新疆医科大学1第一附属医院急救创伤中心, 2第一附属医院感染中心, 3第一临床医学院, 乌鲁木齐 830054)
慢加急性肝衰竭(Acute-on-chronic liver failure, ACLF)是指在慢性肝病基础上由各种诱因引起以急性黄疸加深、凝血功能障碍为肝衰竭表现的临床症候群,可合并包括肝性脑病、腹水、电解质紊乱、感染、肝肾综合征、肝肺综合征等并发症,以及肝外器官功能衰竭[1]。ACLF以肝硬化急性失代偿、肝内外器官衰竭和高短期死亡率为特征,病程长,易发生病情突然恶化,且预后不佳[2-4]。研究发现相比无细菌感染的ACLF患者,细菌感染诱发的ACLF患者病情加重的风险高,90天生存期降低[5]。嗜肝性病毒感染包括乙型肝炎病毒(Hepatitis B virus, HBV)再活化和甲型肝炎病毒或戊型肝炎病毒的过度感染,其中HBV感染是我国ACLF发生的主要原因[6-7]。目前,对HBV-ACLF的主要治疗方法是内科综合治疗、人工肝支持治疗和肝移植治疗[8]。肝移植是严重ACLF唯一有效的治疗方法[9-10]。人工肝支持治疗可清除血清中的有毒代谢物和促炎因子,同时补充凝血因子、白蛋白、免疫球蛋白等,促进肝细胞再生和肝功能修复[11-12]。本研究回顾性分析HBV-ACLF患者预后6个月的临床资料,筛选患者预后影响因素,并构建预后效果模型,现报道如下。
1 资料与方法
1.1 一般资料以2017年5月-2022年5月在新疆医科大学第一附属医院感染中心住院的131例HBV-ACLF患者为研究对象,其中男性110例,女性21例,年龄22~81岁,平均年龄(46.16±13.59)岁。纳入标准:(1)符合《肝衰竭诊治指南》中有关HBV-ACLF的诊断标准[13];(2)年龄≥18岁;(3)各指标资料完整。排除标准:(1)合并其他肝炎病毒感染;(2)合并重要脏器的严重病变;(3)合并肝癌等实质肿瘤患者;(4)合并血液系统疾病伴有弥漫性血管内凝血;(5)妊娠或哺乳期妇女。本研究通过新疆医科大学第一附属医院伦理委员会审批,所有患者均签署知情同意书。
1.2 方法
1.2.1 治疗方法 所有患者均采取内科综合诊疗,包括静养、积极预防并发症以及抗病毒、保肝和利胆退黄药物治疗,辅以人血白蛋白和血浆等进行治疗。药物治疗包括:(1)抗病毒治疗药物:恩替卡韦片(北京百奥药业有限责任公司,国药准字H20193077) 1 mg 1次/d 口服,或富马酸丙酚替诺福韦片(正大天晴药业集团股份有限公司, 国药准字H20213538) 25 mg 1次/d 口服;(2)抗炎保肝药物:甘草酸二胺肠溶胶囊(正大天晴药业集团股份有限公司,国药准字H20040628) 150 mg 3次/d 口服,或异甘草酸镁注射液(正大天晴药业集团股份有限公司,国药准字H20051942) 200 mg 1次/d 静脉滴注;抗氧化解毒保肝药物:水飞蓟宾胶囊(天津天士力圣特制药有限公司,国药准字H20040299)105 mg 3次/d 口服;肝细胞膜保护剂:多烯磷脂酰胆碱胶囊[赛诺菲(北京) 制药有限公司,国药准字H20059010]456 mg 3次/d 口服;选择其中1种进行保肝治疗;(3)利胆退黄药物:注射用丁二磺酸腺苷蛋氨酸(吉林敖东药业集团延吉股份有限公司,国药准字H20213159)1.0 g 1次/d,静脉滴注。
1.2.2 分组方法 截止到患者院内死亡或出院6个月内死亡,随访方式为电话或门诊,依据随访终点的预后情况将131例HBV-ACLF患者分为存活组(n=60)和死亡组(n=71)。
1.3 指标测定
1.3.1 一般资料的收集 收集患者年龄、性别及入院时的抗病毒药物种类。
1.3.2 血液指标的测定 收集患者入院后晨起9∶00-10∶00的空腹静脉血,检测实验室指标,包括血常规、肝肾功能、血气分析、电解质和凝血七项等检测指标,如白细胞(White blood cell, WBC)、中性粒细胞计数、红细胞(Red blood cell, RBC)、血红蛋白(Hemoglobin, HB)、血小板计数、pH值、二氧化碳分压(Carbon dioxide partial pressure, PCO2)、氧分压(Partial pressure of oxygen, PO2)、乳酸、钾、钠、钙、氯、肌酐、尿素、总蛋白、白蛋白、球蛋白、天冬氨酸氨基转移酶(Aspartate transaminase, AST)、丙氨酸氨基转移酶(Alanine aminotransferase, ALT)、总胆红素、直接胆红素、非结合胆红素、r-谷氨酰转肽酶、空腹血糖、甘油三酯、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、总胆汁酸、C反应蛋白(C reactive protein, CRP)、甲胎蛋白(Alpha fetoprotein, AFP)、凝血酶原时间(Prothrombin time, PT)、凝血酶原的活动度(The activity of prothrombin, PTA)、国际标准化比值(International normalized ratio,INR)、纤维蛋白原测定(Fibrinogen, FIB)、活化部分凝血活酶时间(Activated partial thromboplastin time, APTT)、降钙素原、白介素6。
1.3.3 HBV-ACLF患者并发症的记录 记录患者入院到随访6个月内,是否发生肝性脑病、自发性腹膜炎、肝肾综合征、低蛋白血症、电解质紊乱、感染、消化道不良反应(如恶心、呕吐及腹泻等)等。
1.3.4 随访记录 患者出院后分别于1周、1个月、3个月和6个月与患者或其家属进行电话随访,记录患者是否规律服用抗病毒药物,是否有消化道不良反应,以及患者在当地医疗卫生机构复查生化指标和电解质后,是否有低蛋白血症和电解质紊乱等。
2 结果
2.1 两组HBV-ACLF患者临床资料比较131例HBV-ACLF患者按照随访的结果分为存活组60例和死亡组71例。存活组与死亡组患者年龄、性别及抗病毒药物种类差异无统计学意义(P>0.05)。入院24 h内存活组与死亡组实验室指标比较显示两组患者在红细胞计数、血小板计数、pH、白蛋白、r-谷氨酰转肽酶、甘油三酯、低密度脂蛋白、PT、PTA、INR、FIB、APTT、白介素6间差异有统计学意义(P<0.05),见表1。
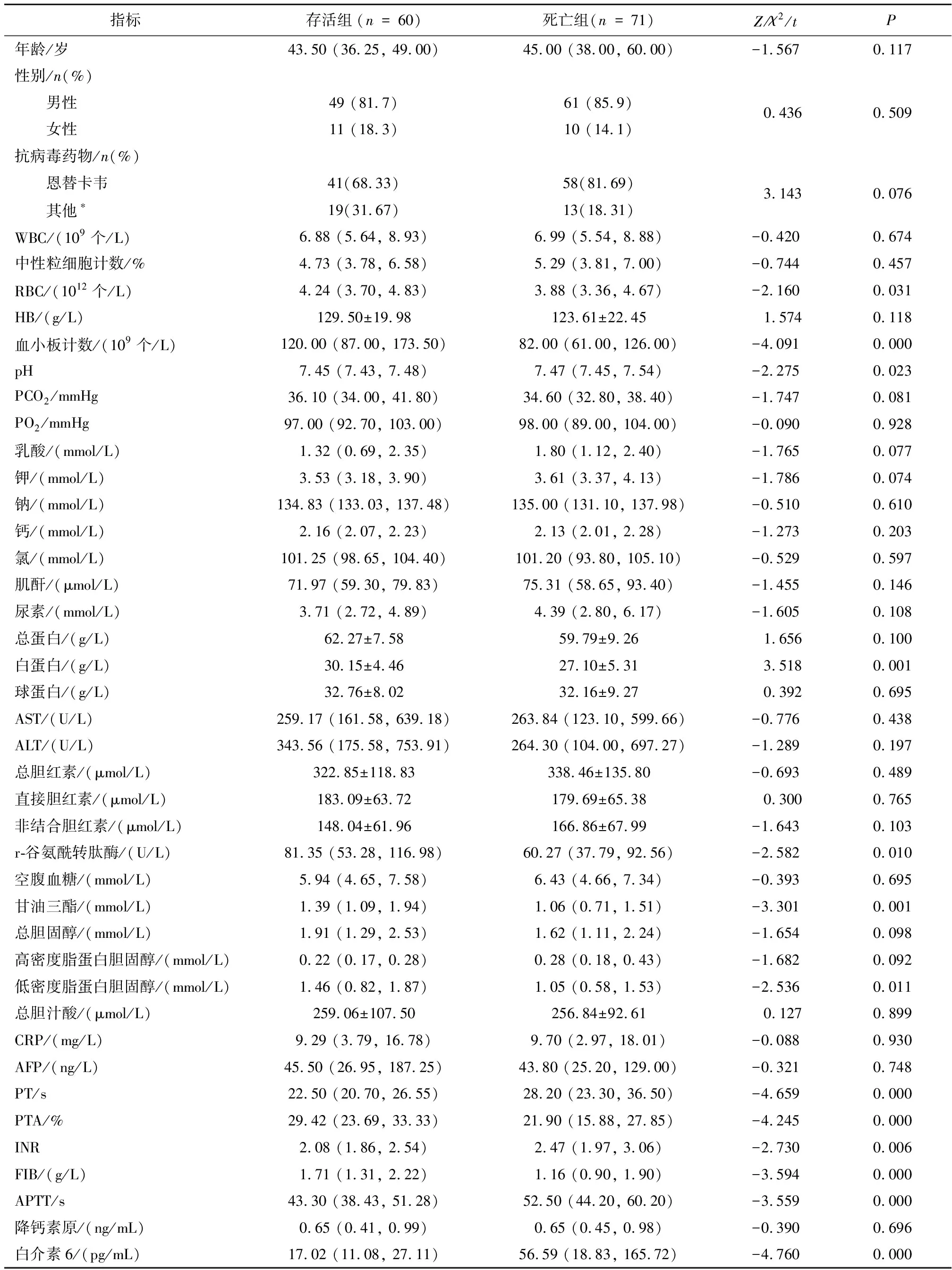
表1 入院时两组HBV-ACLF患者临床资料的比较
2.2 影响HBV-ACLF患者预后的多因素及列线图分析将表1中统计值P<0.05的13个指标:RBC、血小板计数、pH、白蛋白、r-谷氨酰转肽酶、甘油三酯、低密度脂蛋白、PT、PTA、INR、FIB、APTT、白介素6进行二元Logistics回归分析,见表2。血小板计数[OR(95%CI)=0.985 (0.974~0.995),P=0.005]和白蛋白[OR(95%CI)=0.868 (0.780~0.966),P=0.009]指标可能是HBV-ACLF患者预后独立保护因素,PT[OR(95%CI)=1.195 (1.055~1.353),P=0.005]可能为HBV-ACLF患者预后独立危险因素。利用筛选得到的变量及获得的回归系数构建预测模型:Logit(P)=-44.178-0.142×白蛋白-0.015×血小板计数+0.178×PT。即P=1/[1+expLogit(P)]。将白蛋白、血小板计数和PT纳入并构建影响HBV-ACLF患者预后的列线图模型,见图1。列线图中根据使用HBV-ACLF患者不同指标逐一选择对应端点,向上对评分轴做垂直直线得到单项评分值,具体分值:血小板计数为300×109个/L时得分为0分,为0时得分为75分;白蛋白为45 g/L时得分为0分,为10 g/L时得分为70分;PT为10 s时得分为0分,为65 s时得分为100分;总分越高HBV-ACLF患者预后的风险越大。

图1 HBV-ACLF患者预后模型的列线图
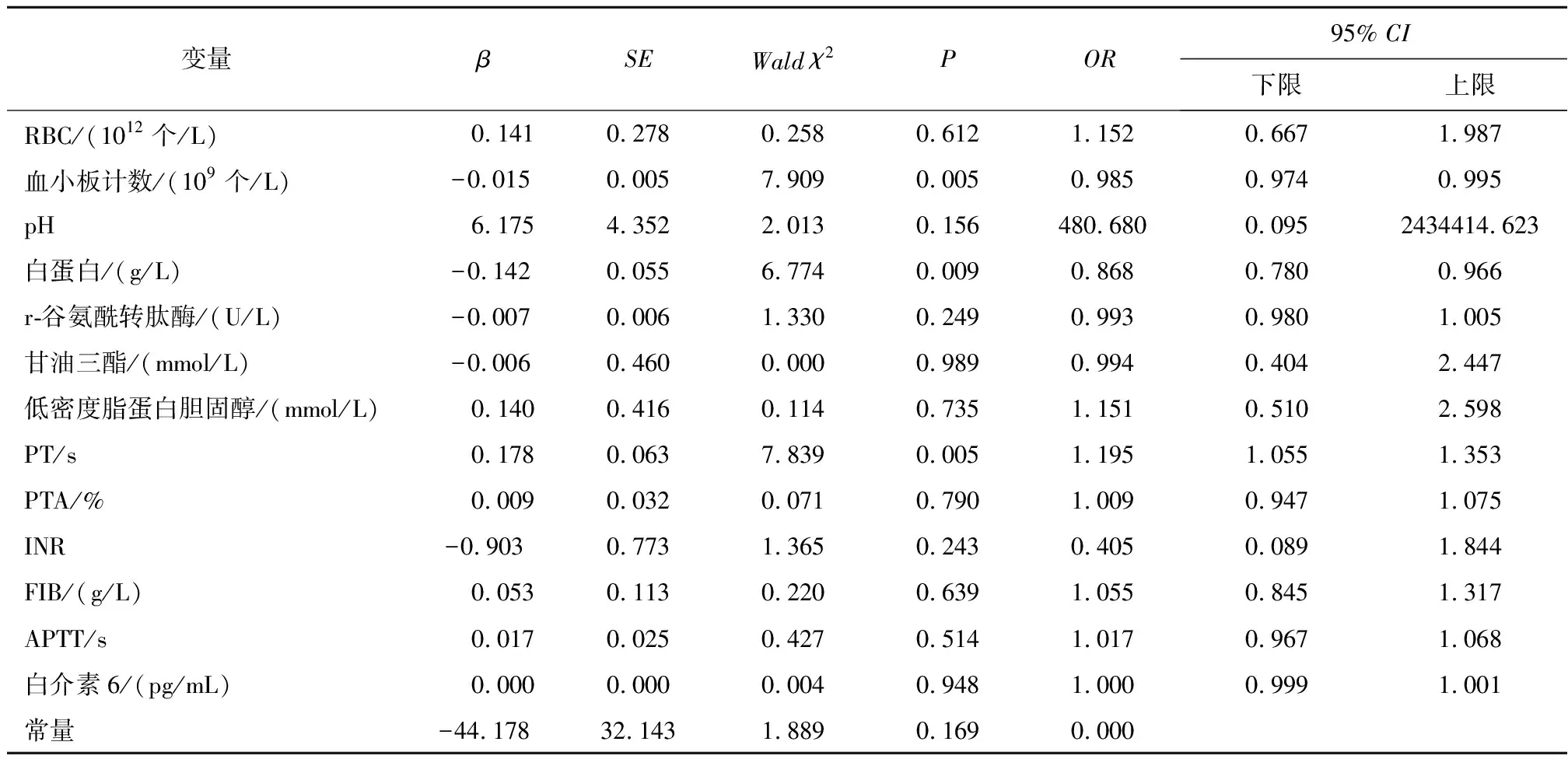
表2 纳入患者临床指标的多因素逻辑回归分析
2.3 HBV-ACLF患者预后模型的验证与评价通过对HBV-ACLF患者预后模型的区分度研究,结果显示ROC曲线下面积为0.829,95%CI为0.760~0.897,敏感度和特异度分别为71.83%和80.00%,提示模型预测效能较好,见图2。Hosmer-Lemeshow检验结果显示,模型拟合优度较好(χ2=6.805,P=0.558)。校准曲线结果显示,模型预测概率与实际发生率有较好的一致性,见图3。通过决策曲线分析,结果显示在大部分高风险阈值范围内(0.28~1.00),预测模型表现更好的净获益,见图4。
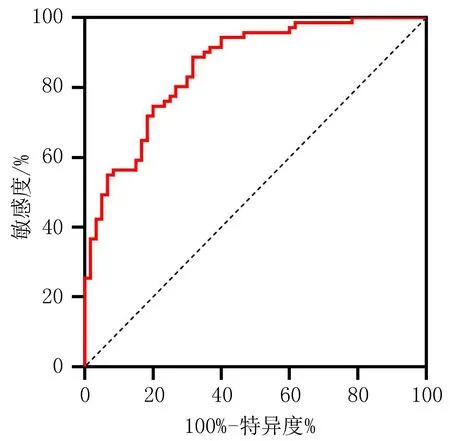
图2 HBV-ACLF患者预后模型ROC曲线图
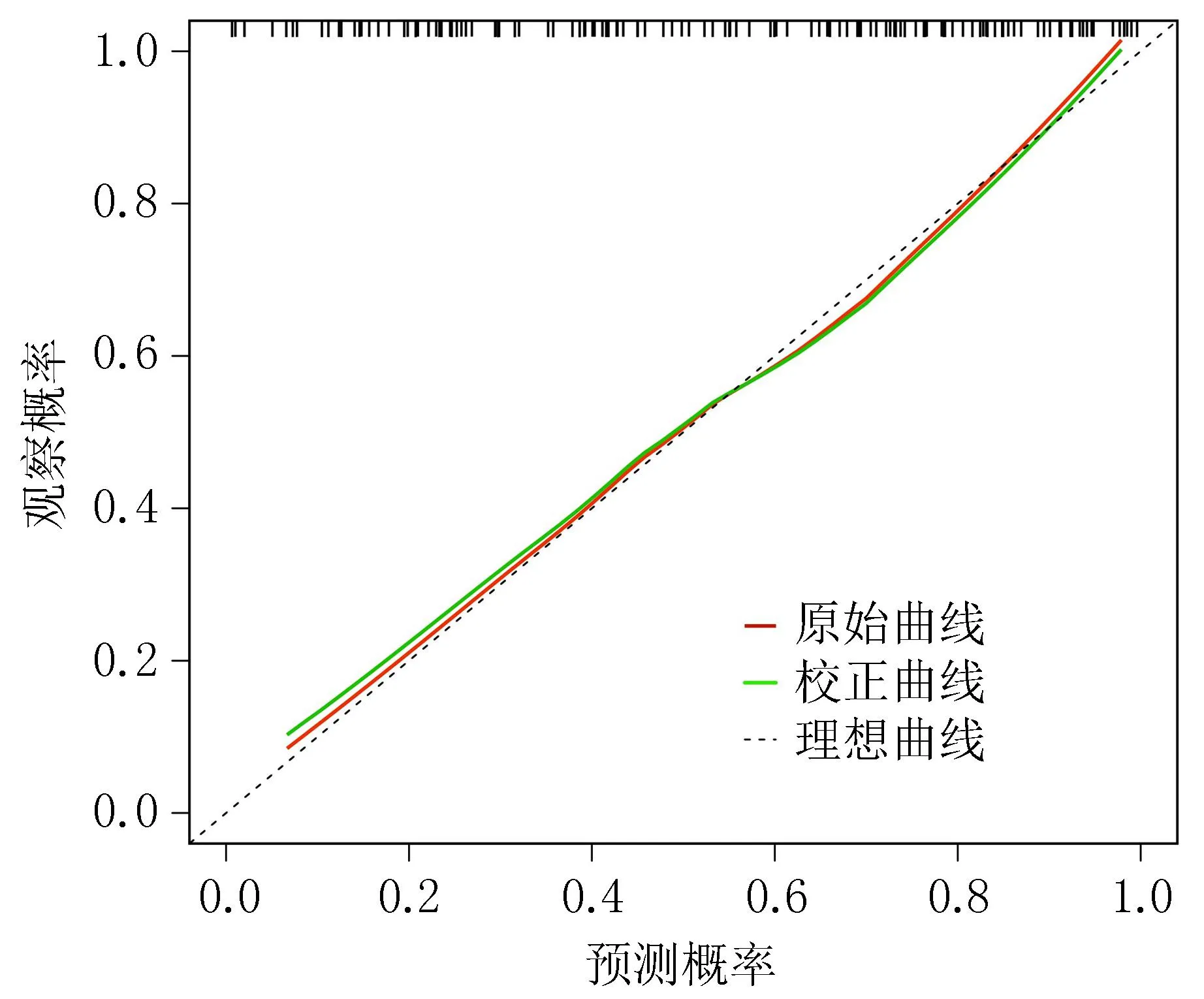
图3 HBV-ACLF患者预后模型校准度图
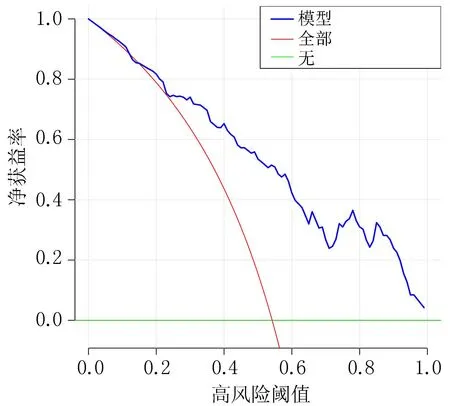
图4 HBV-ACLF患者预后模型决策曲线
2.4 两组HBV-ACLF患者并发症的比较存活组和死亡组HBV-ACLF患者的并发症比较分析结果,见表3。存活组HBV-ACLF患者并发症多为自发性腹膜炎(75.00%)、消化道不良反应(61.67%)、低蛋白血症(23.33%)和电解质紊乱(11.66%),死亡组HBV-ACLF患者并发症以自发性腹膜炎(80.28%)、消化道不良反应(69.01%)、肝肾综合征(45.07%)和肝性脑病(43.66%)为主。两组HBV-ACLF患者在肝性脑病和肝肾综合征存在显著差异(P<0.001),其他并发症组间比较无显著差异(P>0.05)。表明肝肾综合征并发症的发生是影响HBV-ACLF患者生存预后的关键。
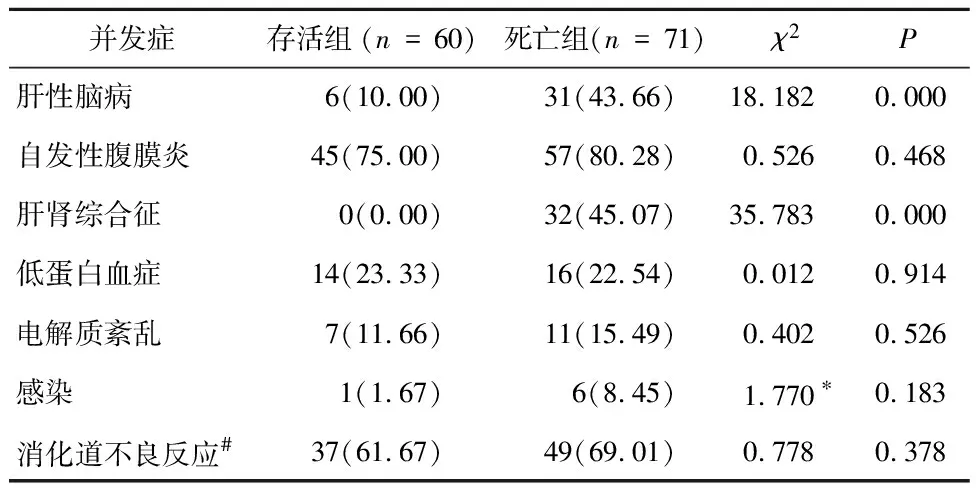
表3 两组HBV-ACLF患者并发症的比较/例(%)
3 讨论
本研究基于随访6个月存活率将HBV-ACLF患者分为存活组与死亡组,临床资料分析发现两组患者的RBC、血小板计数、白蛋白、PT、PTA、INR、纤维蛋白原和白介素6水平存在显著差异。Tan等[14]通过回顾性分析HBV-ACLF患者临床特征,发现病例组的白蛋白水平显著低于正常对照组,且PT、 INR和终末期肝病模型评分在不同分期 (早、 中和晚)的HBV-ACLF患者中有显著差异。根据HBV-ACLF患者30 d的存活情况,分为死亡组和存活组,结果发现与存活组相比,死亡组患者年龄较大,血清白蛋白水平较低,而中性粒细胞计数、总胆红素水平和终末期肝病模型评分较高[15]。另有研究发现高龄、PTA、白蛋白、总胆固醇和血小板水平与HBV-ACLF患者感染显著相关[16]。HBV诱导的ACLF同样伴随着过度的全身性炎症,ACLF初期肝巨噬细胞释放促炎因子白介素6,它是急性期蛋白释放的主要刺激物之一[17]。白介素6也是影响HBV-ACLF预后的独立因素,高水平白介素6的HBV-ACLF患者的死亡风险增加一倍[18]。上述研究提示,白蛋白、PT和血小板水平是影响HBV-ACLF发生发展和预后的重要因素。
本研究通过对HBV-ACLF患者随访分组和Logistics回归分析发现白蛋白、血小板计数和PT是HBV-ACLF患者6个月预后的独立影响因素,该预测模型有较好的区分度、校准能力和临床价值。先前研究通过回顾性分析浙江省HBV-ACLF患者的临床资料,发现血清胆红素、INR和肝性脑病是影响HBV-ACLF的重要变量,其临床模型具有良好的区分度[19]。对于细胞感染导致HBV-ACLF的患者,研究发现COSSH-ACLF评分、急性肾损伤和PTA等是影响患者28天预后的独立因素[20]。有研究显示年龄、基础病因、总胆红素、肌酐、PTA和肝性脑病分期都是ACLF的独立预后因素,多因素构建的模型可以结合基线特征和临床指标的动态变化来预测ACLF的病程[21]。Qiang等[22]研究发现INR、总胆红素和肌酐是四川HBV-ACLF患者90天预后的危险因素,多指标构建的模型具有较高的预后预测价值。
HBV-ACLF患者常伴随多种并发症。本研究发现HBV-ACLF患者并发症主要为自发性腹膜炎、肝肾综合征和肝性脑病等,且肝性脑病和肝肾综合征更易影响HBV-ACLF患者的预后。有研究证实HBV-ACLF患者肝衰竭并发症(肺部感染、肝性脑病和肝肾综合征等)的发生率明显升高,且肺部感染和肝肾综合征是HBV-ACLF患者短期预后的独立危险因素[23]。回顾性分析同样发现肝性脑病、肝肾综合征和消化道出血易发生在HBV-ACLF感染性或非感染性患者中[24]。肝肾综合征是一种严重的器官衰竭并发症,HBV-ACLF相关的肝肾综合征患者多为高龄,白蛋白和纤维蛋白原水平降低[25]。HBV-ACLF患者常伴随肝性脑病和肝肾综合征等多种并发症,会影响患者预后。
本研究发现白蛋白、血小板计数和PT是HBV-ACLF患者预后的重要影响因素,建立的模型对HBV-ACLF患者6个月预后有较好的预测价值。

