去氢骆驼蓬碱对细粒棘球蚴中EgTP53蛋白生物信息学表达的影响
林玉霞, 巩月红, 朱莉娜, 赵美玲, 潘美驰, 赵一聪, 王建华
(1新疆医科大学药学院, 乌鲁木齐 830011; 2新疆医科大学第一附属医院药学部,3省部共建中亚高发病成因与防治国家重点实验室, 乌鲁木齐 830054)
囊型包虫病(Cystic Echinococcosis, CE)是由细粒棘球蚴(Echinococcusgranulosus,Eg)引起的人畜共患寄生虫疾病,在我国新疆、青海、宁夏等地为囊型包虫病高发区,该病流行区人群平均患病率为1.08%[1]。目前WHO推荐的治疗CE的药物为阿苯达唑,但该药物吸收性差、治愈率低、复发率较高[2]。本课题组前期研究发现多年生草本蒺藜科植物骆驼蓬种子提取物中的去氢骆驼蓬碱(Harmine, HM)具有良好的抗包虫疗效,但因其具有神经系统毒性一直未应用于临床[3]。因此明确HM及其衍生物的抗囊型包虫作用机制和作用靶点是提高药物疗效的关键。TP53为核糖核酸结合蛋白家族中一种肿瘤抑制蛋白,在大多数人体肿瘤组织中都能观察到TP53突变或失活[4-5]。TP53是一个巨大蛋白质网络中心,允许多种信号整合,当细胞受到DNA损伤时,会导致该网络的激活,激活后TP53结合启动子区域的特定DNA共识序列,刺激相应靶基因的转录,这些基因产物负责诱导DNA修复机制,如果修复不成功,则诱导程序性细胞死亡[6-8]。TP53在DNA损伤通路中的关键作用,成为药物和疫苗开发的热点。本研究利用生物信息学技术对细粒棘球蚴中TP53(EgTP53)的蛋白结构和功能进行分析,检测HM对EgTP53蛋白表达的影响,现报道如下。
1 材料与方法
1.1 细粒棘球蚴收集从绵羊的肝脏包囊中采集细粒棘球蚴原头节,用含有2%青链霉素(双抗)的无菌生理盐水进行冲洗,添加RPMI1640培养基,得到含有原头蚴的混悬液,其中原头蚴的活性维持在95%以上。
1.2 仪器与试剂胎牛血清(美国Gibco公司),青链霉素(美国 Hyclone公司),总RNA提取试剂和反转录试剂盒(Takara生物技术有限公司),Trizol试剂(美国Invitrogen公司),PCR反应试剂盒(北京康为世纪生物科技有限公司),HM(新疆华世丹药物研究所),实时荧光定量PCR仪(Thermo Fisher scientific公司),细胞培养箱(Thermo Fisher scientific公司)。
1.3 HM与EgTP53蛋白分子对接验证采用TCMSP (https://old.tcmsp-e.com/tcmsp.php) 数据库获取HM的MOL2格式文件,从PDB( https://www.rcsb.org/)数据库中检索EgTP53蛋白的3D结构,使用AutoDock Vina软件进行分子对接,获得相互作用中结合能最低的模型,将其模型经Pymol软件进行可视化处理。当对接能量小于0时,认为配体与受体之间具有强烈的结合活性。
1.4 EgTP53蛋白的生物信息学分析
1.4.1 EgTP53蛋白理化性质预测及亲疏水性分析 从NCBI数据库(https://www.ncbi.nlm.nih.gov/)获得登录号Gene ID:3633851,通过Protparam蛋白分析工具(http://web.expasy.org/protparam/)对EgTP53蛋白理化性质进行预测。当不稳定指数大于40时,蛋白质被认为是相对不稳定的[8]。通过生信在线软件工具ProtScale(https://web.expasy.org/protscale/)评估EgTP53蛋白亲疏水性,平均疏水指数正值表示相对疏水性,负值表示相对亲水性。
1.4.2 EgTP53蛋白跨膜区结构预测与信号肽分析 采用SignalP5.0在线软件(http://www.cbs.dtu.dk/services/SignalP/)对EgTP53蛋白进行信号肽预测,以确定其是否含有信号肽序列。通过生物学在线软件工具TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)分析EgTP53蛋白存在的跨膜区域。
1.4.3 EgTP53蛋白二级结构和三级结构分析 使用SOPMA在线软件(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析EgTP53蛋白二级结构和可溶性区域预测。使用SWISS-MODEL在线软件(https://swissmodel.expasy.org/)对EgTP53蛋白进行同源建模,预测EgTP53蛋白三级结构。
1.4.4 预测EgTP53蛋白磷酸化位点及结构域 使用在线软件NetPhos 3.1 Server(https://services.healthtech.dtu.dk/services/NetPhos-3.1/)预测EgTP53蛋白存在的丝氨酸、苏氨酸、酪氨酸磷酸化位点。通过Conserved Domain Database(CDD)数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/cdd.shtml)分析EgTP53蛋白结构域。
1.4.5 EgTP53B细胞抗原表位的测定 使用IEDB在线软件(https://www.iedb.org/)分析EgTP53蛋白B细胞抗原表位,得出易形成抗原表位的区域。
1.4.6 EgTP53蛋白系统进化关系 登录NCBI的蛋白质数据库,获得不同种属EgTP53蛋白的氨基酸序列,使用MEGA6.0软件对EgTP53蛋白和其他物种的TP53蛋白序列构建系统发育树并进行分析。
1.5 去氢骆驼蓬碱对EgTP53蛋白表达检测取“1.1”项下的细粒棘球蚴,随机分为3组,每组3份,按照密度3 000头/孔分别加入24孔培养板中,分别加PBS缓冲液,1% DMSO,100 μmol/L HM干预24 h,收集细粒棘球蚴样本,用PBS清洗,采用Trizol溶液提取各样本总RNA,将RNA进行琼脂糖凝胶电泳检测,按Takara试剂盒说明书方法将RNA逆转录成cDNA,引物信息见表1。准备模板DNA、配置PCR反应液、进行PCR反应,测定各组的EgTP53蛋白mRNA 表达水平。以β-actin为内参。每组实验重复3次,采用2-△△Ct方法计算各组EgTP53蛋白的相对表达水平。
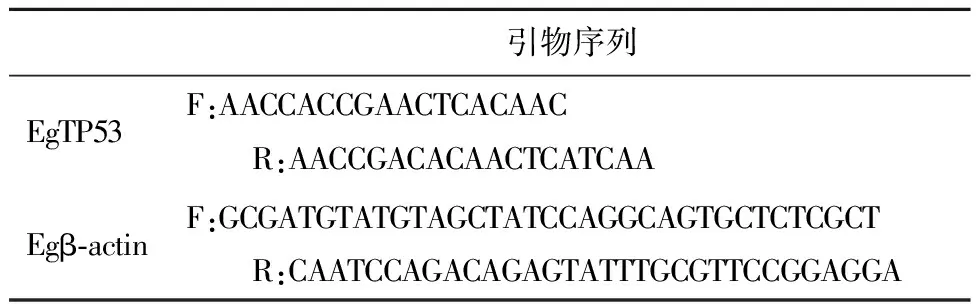
表1 EgTP53蛋白及内参引物信息
2 结果
2.1 EgTP53蛋白与HM的对接结果使用AutoDock Vina 软件对EgTP53蛋白与HM进行分子对接,结果显示结合能为-4.44 kcal/mol。对接结果模型运用Pymol软件进行可视化,对接结果显示HM与EgTP53蛋白有较好的结合,见图1。
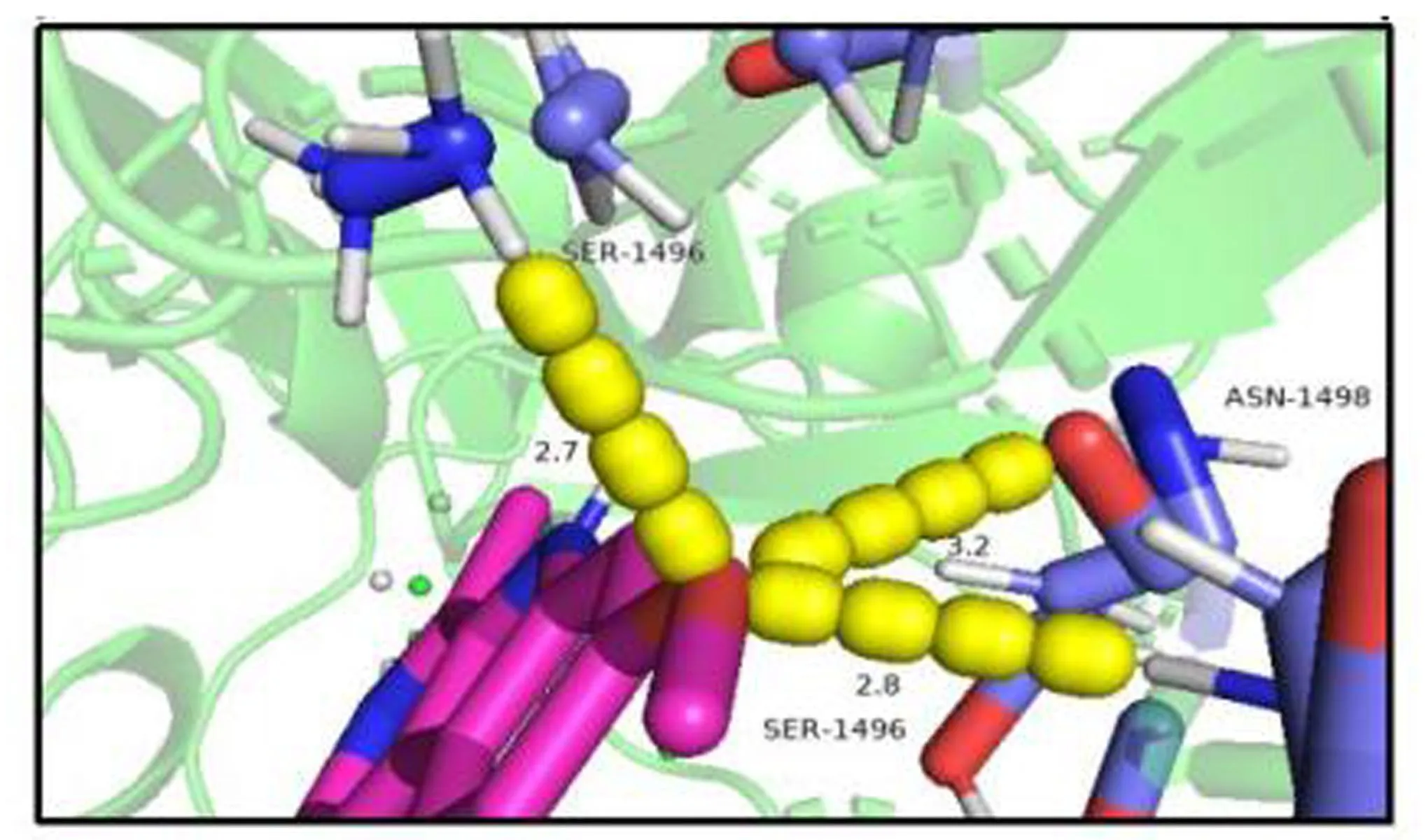
图1 EgTP53蛋白与HM的分子对接位点图
2.2 EgTP53蛋白的理化性质及亲疏水性分析EgTP53蛋白的相对分子量:121 799.11,等电点:9.29,氨基酸数量1 108,带正电残基:139,带负电残基:118,原子总数:17 183。不稳定指数:59.19,表明EgTP53蛋白为不稳定蛋白。脂肪族氨基酸指数:82.17。含有多个亲水性较高的区域,其平均疏水指数为-0.347,判断EgTP53g蛋白属于亲水性蛋白,见图2。
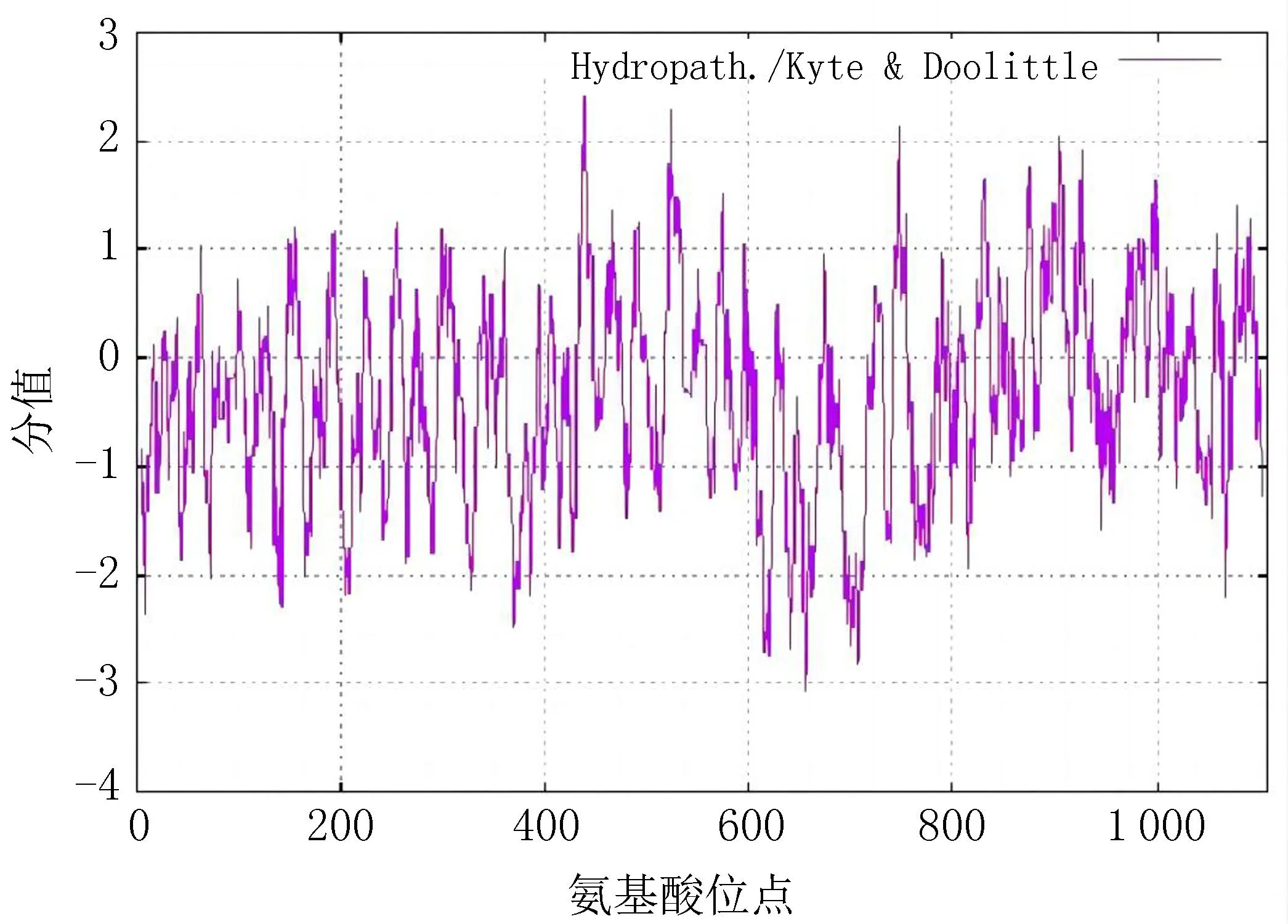
(注: 正值表示疏水性,负值表示亲水性)
2.3 EgTP53蛋白信号肽与跨膜区域经Netphos3.1在线软件预测EgTP53蛋白的信号肽Sec/SPI:0.000 6,无信号肽裂解位点和跨膜区域,见图3。表明EgTP53蛋白为非分泌性、非膜质的蛋白,在细胞内部发挥调控基因表达或者参与信号传导等重要功能。
图3 EgTP53蛋白的跨膜区域预测图
2.4 EgTP53蛋白的磷酸化位点及结合域EgTP53蛋白有105个丝氨酸磷酸化位点, 63个苏氨酸磷酸化位点,7个酪氨酸磷酸化位点,见图4。通过CDD数据库分析EgTP53蛋白的结构域中存在TUDOR蛋白结构域,位于第391至441个氨基酸之间;存在2个BRCT保守蛋白结构域,一个位于第824至907个氨基酸之间,另一个位于第1 037至1 095个氨基酸之间,见图5。

图4 EgTP53蛋白磷酸化位点预测图
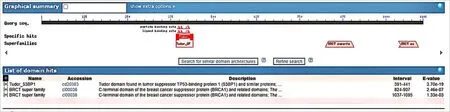
图5 EgTP53蛋白结构域图
2.5 EgTP53蛋白的二级结构及三级结构预测分析采用SOMPA平台分析 EgTP53蛋白二级结构:α螺旋占30.05%,β折叠占17.51%,β转角占4.69%,无规则卷曲占47.75%,见图6。运用SWISSMODEL在线程序构建的EgTP53蛋白三级结构见图7,与模板序列同源性为99.91%,GMQE 得分为0.50。
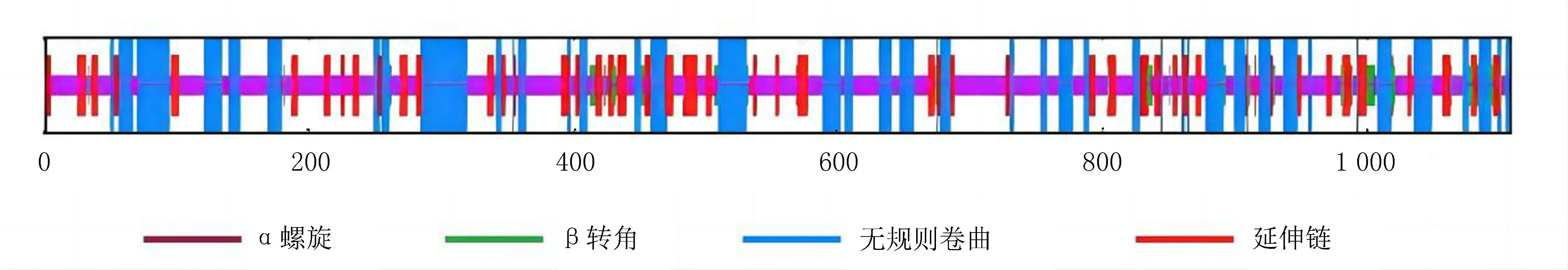
图6 EgTP53蛋白的二级结构图
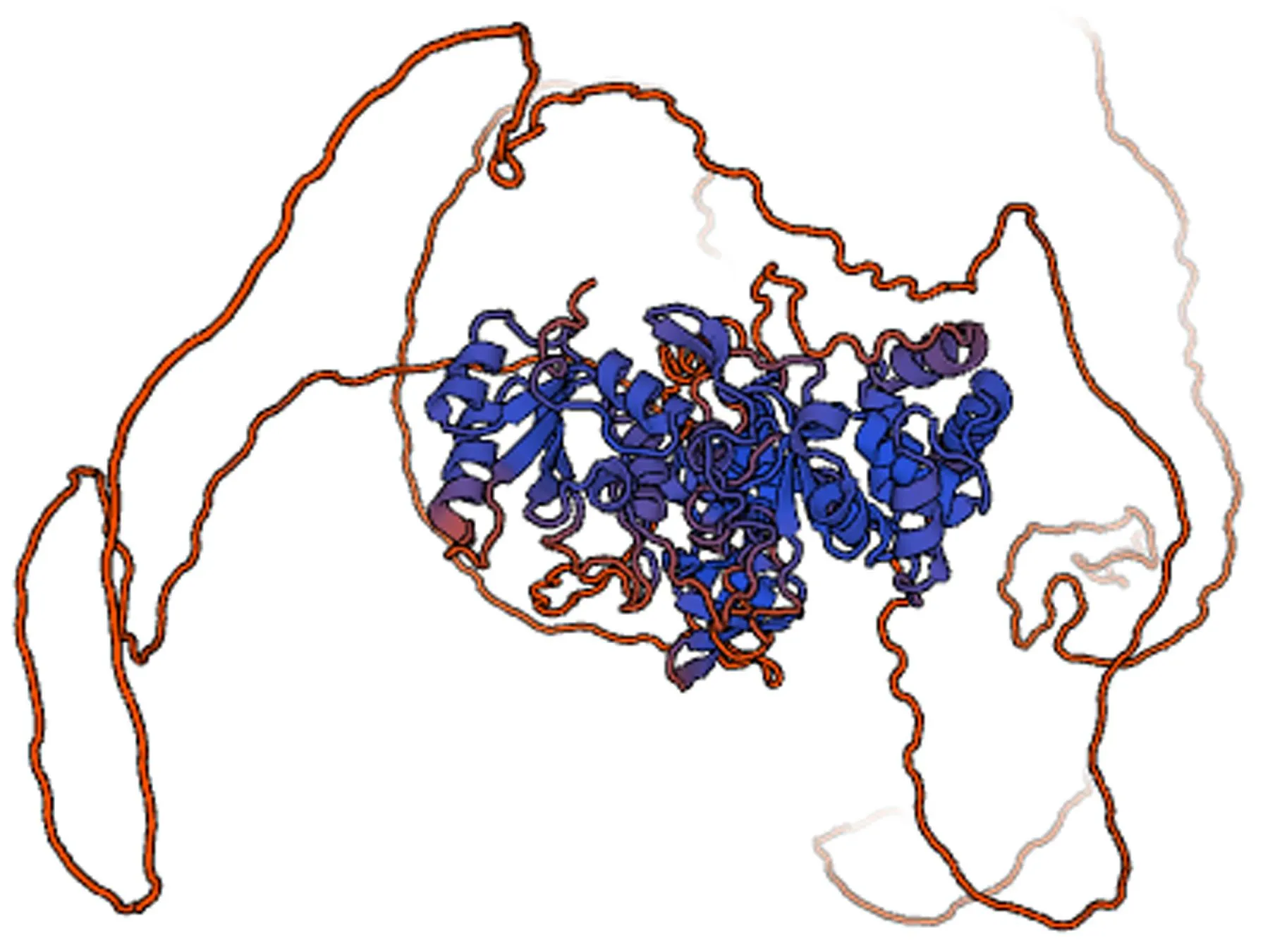
图7 EgTP53蛋白三级结构图
2.6 EgTP53蛋白的B细胞抗原表位预测IEDB在线预测软件预测EgTP53蛋白主要的细胞抗原表位在:5-36、42-61、67-99、101-124、133-146、151-224、227-227、229-251、261-295、320-387、401-417、423-432、442-484、494-499、505-667、682-787、797-823、838-868、891-896、912-921、931-936、949-969、975-981、988-991、1003-1008、1021-1055、1064-1080、1096-1105位置存在氨基酸。
2.7 EgTP53的系统进化通过MEGA6.0软件构建TP53系统进化树,分析不同种属TP53之间的系统发育关系,见图8。EgTP53蛋白具有多个分支,EgTP53蛋白与亚洲带绦虫病(VDK41028.1:28-1014)、带状泡尾绦虫(VDM33434.1:1-1099)同属一个分支,相似性接近83%,与长膜带绦虫(VUZ428752.1:95-732)、矮小齿壳绦虫(VDN96517.1:131-750)、微口膜壳绦虫(CDS26543.1:788-1424)同属绦虫纲,进化关系较近,相似性接近78%,与人亲缘性较远。
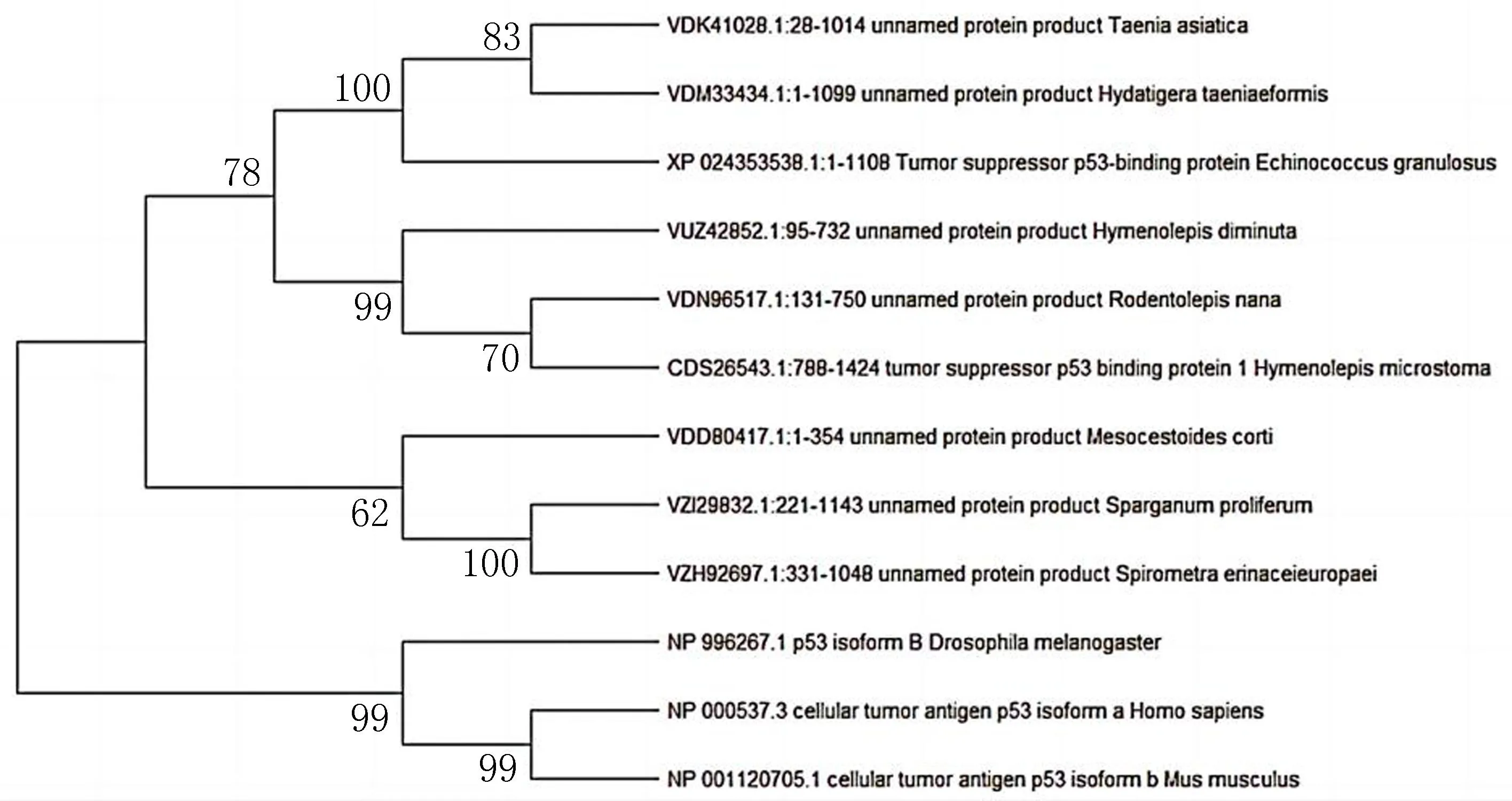
图8 EgTP53蛋白和其他物种TP53蛋白系统进化树图
2.8 去氢骆驼蓬碱对EgTP53 蛋白表达的影响用构建的qRT-PCR反应体系检测EgTP53蛋白的表达量,与空白对照组和1%DMSO组相比,HM组EgTP53蛋白表达量显著上升,见图9。
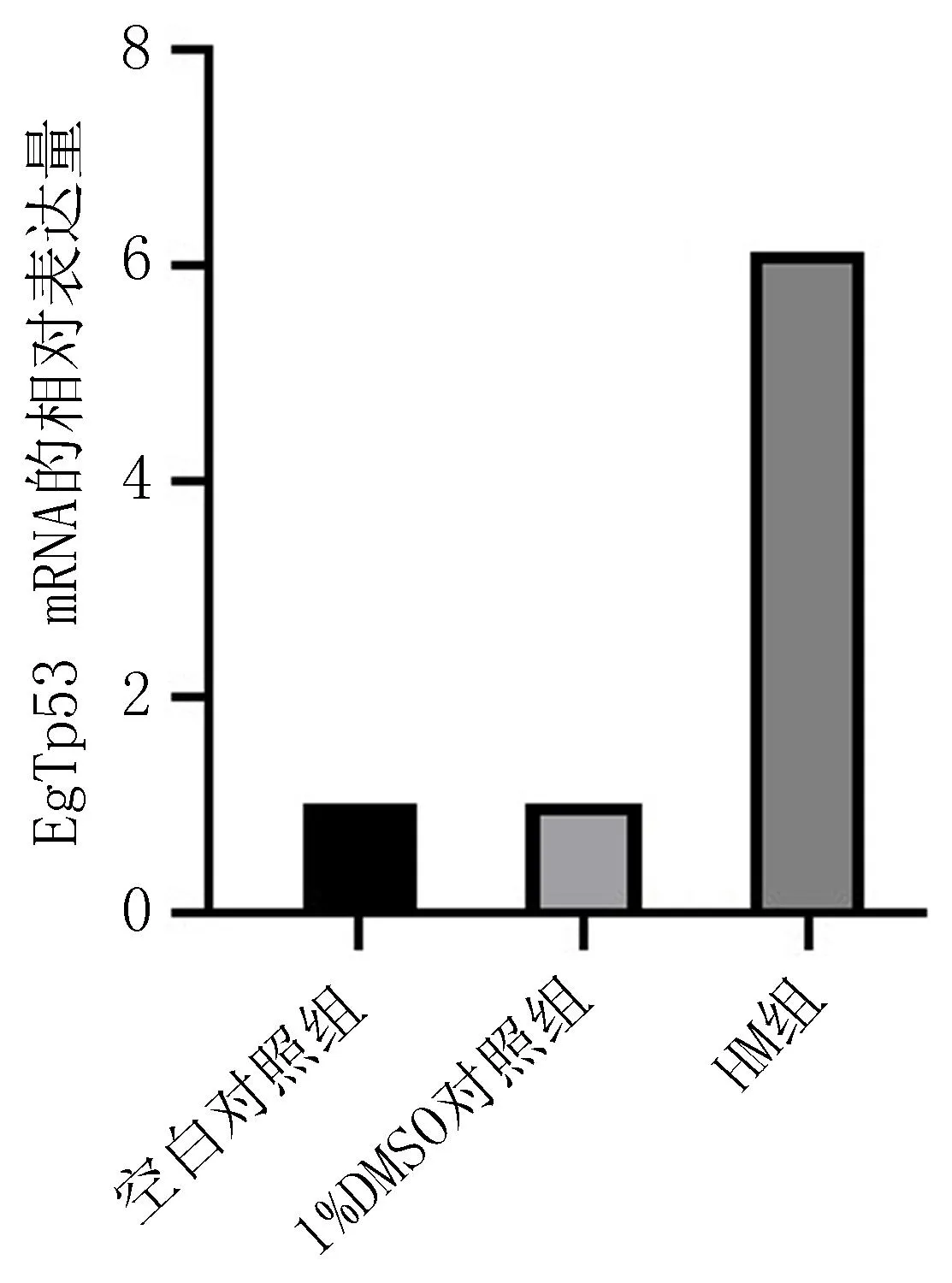
图9 EgTP53蛋白的表达结果图
3 讨论
TP53蛋白是一种核糖核酸结合蛋白,通常位于细胞核内,与DNA发生直接的相互作用[9]。它在细胞中以单体形式存在,但在响应特定信号或损伤时,可以形成二聚体或四聚体,以激活或抑制其调控作用[10]。研究表明,细粒棘球蚴感染可导致宿主肝细胞中TP53的活性增加,提示TP53 在Eg的生长发育过程中起到重要作用[11]。EgTP53的磷酸化位点比较多,多个磷酸化位点反映了蛋白质在细胞信号传导途径中的重要性,有助于EgTP53蛋白在不同的细胞状态和环境中进行适应性调整。
EgTP53蛋白的N末端区域缺少传统的转录激活域,这一区域是哺乳动物p53在调控转录和介导DNA损伤反应中非常重要的结构域[12]。EgTP53蛋白主要由β转角和无规则卷曲构成,表明它具有一定的柔性和可塑性,在多个生物过程中发挥作用,具有多功能性,容易改变细粒棘球蚴在寄生过程中的不同环境和生物学要求。EgTP53蛋白含有多个B细胞抗原表位,表明EgTP53蛋白在细粒棘球蚴的免疫系统中引起免疫应答的潜力较高。这些抗原位点通常是蛋白质上的特定区域,可以与免疫系统中的B细胞受体相互作用,引发抗体产生[13]。这对细粒棘球虫的寄生能力和繁殖产生一定的影响,同时也为开发相关的诊断和治疗方法提供一定的线索和参考。多重序列比对分析提示EgTP53蛋白与人亲缘性较远,根据其特征设计药物更容易成为治疗靶点[14-15]。
本研究通过实时荧光定量PCR技术检测EgTP53蛋白在HM处理后的表达水平升高,这表明EgTP53蛋白的活性得到了增强。通常情况下,TP53蛋白在细胞受到损伤或压力时会被激活,从而协调细胞的应激响应,包括但不限于DNA修复、细胞周期控制以及凋亡等细胞保护机制的调控[16-17]。TP53通常是对DNA损伤的响应者,本研究提示HM通过引发一系列细胞应激响应,导致EgTP53蛋白活性增强。
EgTP53蛋白结构域中存在TUDOR蛋白结合域和两个BRCT蛋白结合域。在DNA损伤修复过程中,TUDOR蛋白通常与甲基化的组蛋白或其他染色质结构相关蛋白发生相互作用并且通过与甲基化的DNA结合来调控DNA损伤信号的传递[18]。TDRD3是一种TUDOR蛋白,可以与甲基化的组蛋白H3K9me3结合,参与DNA单链断裂的修复。此外,TUDOR蛋白还可以与DNA损伤响应信号途径中的其他关键蛋白,如ATM、ATR和53BP1等发生相互作用,调节DNA损伤信号的传递和DNA损伤修复过程[19]。TUDOR蛋白还可以通过参与非同源末端连接途径来进行DNA损伤修复。Tudor-SN蛋白是一种TUDOR蛋白,在非同源末端连接途径过程中发挥作用,调节DNA损伤修复酶DNA-PKcs的磷酸化状态,促进DNA损伤修复的进行[20]。BRCT结构域是一种常见的蛋白结构域,与DNA损伤修复和细胞周期调控等生物学过程密切相关。BRCA1蛋白可以与DNA双链断裂修复途径的其他蛋白如BRCA2、RAD51和PALB2等发生相互作用,形成蛋白复合物,参与DNA损伤的修复和同源重组的过程[21-22]。BRCA1蛋白可以与核孔复合物发生相互作用,使DNA双链断裂的修复可以进行到核内,有效地维持基因组的稳定性。BRCA1蛋白可以调控细胞周期及进行DNA信号的传导。当细胞受到DNA损伤后,BRCA1蛋白可以激活ATM和ATR等激酶,进而激活CHK1和CHK2等效应蛋白,抑制细胞周期的进程,使细胞有足够的时间进行DNA损伤的修复。有研究表明,BRCA1蛋白在治疗乳腺癌等肿瘤中具有一定的作用[23-25]。因此,基于TUDOR蛋白和BRCA1蛋白在DNA损伤修复和细胞周期调控中的作用,可以考虑使用TUDOR蛋白和BRCA1蛋白作为治疗细粒棘球蚴相关疾病的新策略,开发针对EgTP53-BRCT-BRCT结构域的靶向药物或基因治疗方法,以达到更好的治疗效果。
综上所述,EgTP53在细粒棘球蚴的生长中扮演着重要的调控角色,DNA损伤通路参与了HM及其衍生物诱导细粒棘球蚴死亡的过程,为深入了解Eg的致病机制,发现新的治疗包虫病药物靶点奠定了基础。

