四川泡菜母水的微生物群落与理化特性分析
胡此海,杨 絮,郭全友*,郑 尧,李保国,范逸文
(1 上海理工大学健康科学与工程学院 上海200093 2 中国水产科学研究院东海水产研究所 上海 200090)
泡菜是以新鲜蔬菜等为主要原料,添加或不添加辅料,经食用盐或食盐水泡渍发酵等工艺加工而成的蔬菜制品。蔬菜在高渗透压的食盐溶液中,利用乳酸菌产酸,共同抑制其它有害微生物的生长[1]。四川泡菜是我国最著名的发酵蔬菜之一,有“川菜之骨”的美称[2],其加工工艺简单,原料成本低廉,成品鲜香味独特,具有开胃理气,降低胆固醇和促进肠道内菌群生态平衡等功效[3-4]。常见的泡菜发酵方式包括自然发酵、接种发酵和母水发酵。自然发酵存在周期较长和产品质量难以标准化等问题,而接种发酵的泡菜风味欠佳。母水是泡菜发酵成熟后取出泡菜剩下的液体,以母水作为发酵剂循环使用的方式称为母水发酵。母水发酵泡菜中丙二醇、甘油、甘露醇、乳酸和草酸等含量较高,且氨基酸种类更丰富,比自然发酵和接种发酵具有更好的风味和口感[5]。然而,不同来源的泡菜母水微生物群落结构和理化特性均不同,目前主要用于小作坊式自制泡菜,尚未大规模工业化标准化生产。
泡菜发酵过程中的微生物群落影响成品的理化特性,并最终影响泡菜品质。目前,高通量测序技术为解析微生物群落提供一种高效、便捷的方法,其具有测序快捷、基因信息量大以及微生物分析全面等特点,已应用在白酒[6]、醋[7]和发酵鱼[8]等食品中的微生物分析。研究发现乳酸菌(LAB)如明串珠菌、乳杆菌和魏斯氏菌被确定为泡菜发酵过程中微生物群落的主要微生物[9]。Rao 等[10]采用高通量测序揭示了不同发酵阶段萝卜泡菜的微生物群落,结果表明泡菜发酵成熟后期的微生物群落在属水平主要是乳酸杆菌属和毕赤酵母属。Yang 等[11]对泡菜微生物与理化特性相关性进行研究,发现植物乳杆菌、醋酸乳杆菌、魏氏乳杆菌和假肠系膜明串珠菌与理化特性(pH 值、总酸、质构、有机酸和游离氨基酸)具有显著相关性。An等[12]发现发酵蔬菜中醋杆菌和葡糖杆菌与总酸呈显著正相关关系,与盐浓度呈显着负相关关系(P<0.05)。
目前对母水发酵泡菜方式的研究大多针对泡菜成品,对泡菜母水的研究较少,且集中于发酵过程中微生物和风味物质的变化,忽视了不同来源泡菜母水中微生物群落的共有微生物,以及微生物群落与其理化特性间的关系。泡菜母水是发酵后期的产物,微生物群落较为稳定,是筛选母水发酵泡菜菌株的优良来源。本研究以优选传统发酵泡菜母水为对象,分析其理化特性,采用高通量测序技术解析微生物的群落结构,并用相关性分析法探究传统四川泡菜母水中微生物群落与理化特性的关系,为高效发酵菌株的选育和工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
泡菜母水:2021 年5 月从四川成都等地不同工厂采集1 年以上泡菜母水30 份,并通过感官评价泡菜。总分100 分,色泽和香气各占30 分,滋味占40 分,选择10 位专业人员进行评定,通过盲评计分,对泡菜色泽、香气、滋味进行打分,具体评分标准见表1。筛选得分超过90 分的泡菜,取其液体分别编号为A、B、C、D、E,样品信息见表2。无菌取样,贮存于无菌三角瓶中,低温运至实验室。

表1 泡菜感官评分标准Table 1 Pickles sensory scoring criteria
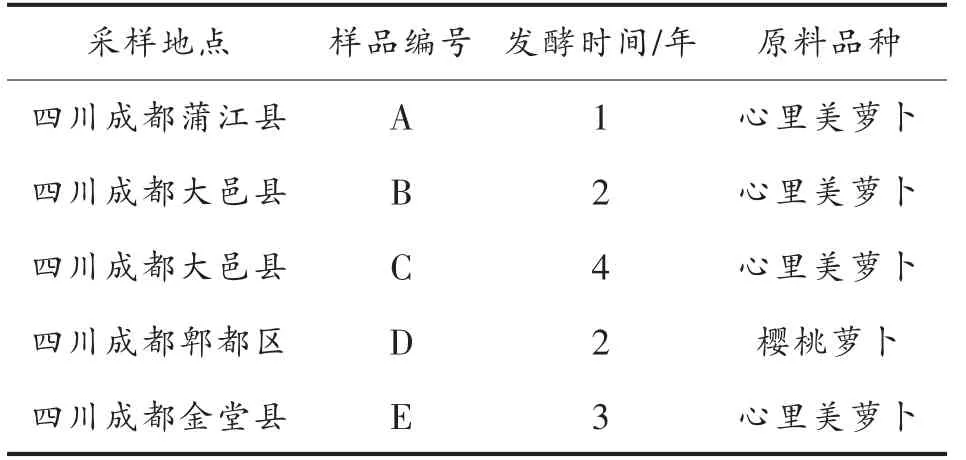
表2 样品信息Table 2 Sample information
氢氧化钠、酚酞、铬酸钾、硝酸银标准滴定溶液等化学试剂(均为分析纯级),国药集团化学试剂有限公司;乳酸、草酸、乙酸、柠檬酸、酒石酸、琥珀酸、苹果酸,德国LGC 公司;OMEGA 土壤DNA试剂盒,美国OMEGA 公司;MiSeq Reagent Kit v3 测序试剂盒,美国Illumina 公司。
1.2 仪器与设备
1260 型高效液相色谱仪,美国Agilent 公司;pHS-3C 型pH 计,上海雷磁仪器厂;ABI-2720 型聚合酶链式反应仪,美国ABI 公司;Bio-Red 电泳仪,美国Bio-Rad 公司;Illumina Miseq 测序仪,美国Illumina 公司。
1.3 方法
1.3.1 理化指标测定 取25 mL 样品混匀,用pH计测定样品pH 值[13]。参照GB/T 12456-2008《食品中总酸的测定》,采用酸碱滴定法测定样品总酸[14]。盐含量的测定参照GB 5009.44-2016《食品安全国家标准 食品中氯化物的测定》中的银量法测定[15]。
1.3.2 有机酸检测 参照Liu 等[16]的方法稍作修改,吸取5 mL 泡菜母水于离心管中,于75 ℃超声处理,在12 000 r/min 离心15 min,取1.5 mL 上清液用0.22 μm 滤膜过滤至进样瓶中待测。
色谱条件:C18 色谱柱(Zorbax SB-AQ,250 mm×4.6 mm,5 μm),紫外检测器波长为210 nm,流动相为0.02 mol/L 磷酸二氢钠-乙腈(99∶1,体积比,pH 2),流速0.8 mL/min,柱温25 ℃,进样量为10 μL。
1.3.3 DNA 提取和聚合酶链式反应(PCR)扩增吸取20 mL 泡菜水,于400 r/min 离心10 min,取上清液,于8 000 r/min 离心10 min 取菌泥,使用OMEGA 土壤DNA 试剂盒(D5625-01)按照说明书提取总基因组DNA 样品,储存在-20 ℃。采用正向引物338F(ACTCCTACGGGAGGCAGCA)和反向引物806R(GGACTACHVGGGTWTCTAAT),对细菌16S-RNA 的V3-V4 区域进行PCR 扩增。将PCR 反应所需的成分配置完后,在PCR 仪上于98℃预变性5 min,使模板DNA 充分变性,然后进入扩增循环。在每一个循环中,先于98 ℃保持30 s使模板变性,然后将温度降到53 ℃,保持30 s,使引物与模板充分退火;在72 ℃保持45 s,使引物在模板上延伸,合成DNA,完成一个循环。重复循环25 次,使扩增的DNA 片段大量累积。最后,在72 ℃保持5 min,使产物延伸完整,4 ℃保存。同样,使用正向引物ITS5F(GGAAGTAAAAGTCGTAACAAGG)和反向引物 ITS2R(GCTGCGTTCTTCATCGATGC),对真菌ITS-V1 区域进行PCR 扩增。
1.3.4 基因测序 扩增结果进行2%琼脂糖凝胶电泳,切取目的片段然后用Axygen 凝胶回收试剂盒回收目的片段。采用Illlumina MiSeq 平台和MiSeq Reagent Kit v3 进行双端2×250 bp 测序,测序由上海派森诺生物科技有限公司完成。
1.3.5 生物信息学分析 细菌16S rDNA 基因序列基于Silva 数据库[17],真菌ITS 基因序列基于U nite 数据库[18]。使用QIIME2 2019.4 进行,使用DADA2 插件对序列进行质量过滤、去噪、合并和去除嵌合体。进行扩增子序列变异体(Amplicon sequence variants,ASV)与mafft 对比,并用于构建具有fasttree2 的系统发育。采用RDP Classifier贝叶斯算法对100%相似水平的ASV 代表序列进行分类学分析、α 多样性和分类学地位注释。
1.4 统计分析
试验重复测定3 次,结果以平均值±标准差表示。通过统计软件SPSS 26 中进行方差分析及显著性分析(置信区间为95%),利用Origin 2021 b软件和派森诺基因云平台绘图。微生物群落与理化特性采用采用斯皮尔曼相关分析方法,利用R语言绘图(置信区间为99%和95%)。
2 结果与分析
2.1 泡菜母水理化特性
2.1.1 pH 值、总酸含量和盐含量的测定 总酸(Total acid,TTA)和pH 值影响泡菜发酵过程中微生物生长和代谢产物,是泡菜成熟度的评判指标[19-20]。由表3 可知,泡菜母水pH 值在3.27~4.71之间,B 样品pH 值(4.71±0.01)显著(P<0.05)高于其余4 份样品pH 值(3.27~3.65)。云琳等[21]研究发现卤水泡菜的pH 值稳定在3.7 左右,与本试验研究一致。5 份样品总酸含量在3.00~18.90 g/kg 均具有显著性差异(P<0.05)。传统发酵泡菜母水的pH 值和总酸含量存在差异性,可能与微生物群落、发酵工艺、发酵时间有关。
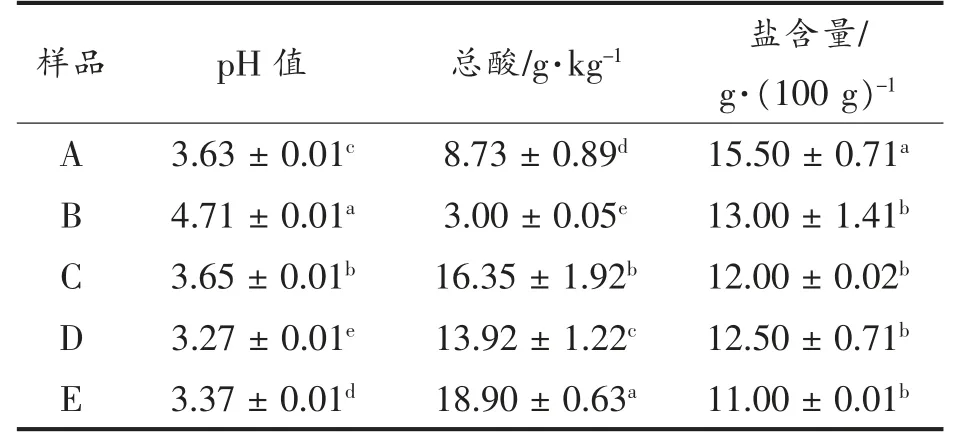
表3 泡菜母水的理化指标Table 3 Physicochemical index of pickle brine
盐含量使泡菜母水具有较高的渗透压,高渗透压会抑制腐败菌的生长,有利于泡菜的保存,因此泡菜母水发酵的泡菜具有较长的货架期。表3可见,5 份样品盐含量为11.00~15.50 g/100 g,其中A 样品的盐含量(15.50±0.71 g/100 g)显著高于其余样品(P<0.05),而B、C、D 和E 样品的盐含量无显著差异(P>0.05),总体显示泡菜母水的盐含量较为一致。邓维琴等[22]发现所有代数泡菜母水中盐度无显著性差异(P>0.05),说明泡菜母水中盐度是稳定的,与本试验研究较为一致。
2.1.2 有机酸含量测定 由表4 可见,样品中检测出草酸(Oxalic acid)、酒石酸(Tartaric acid)、苹果酸(Malic acid)、乙酸(Acetic acid)、柠檬酸(Citric acid)、琥珀酸(Succinic acid)和乳酸(Lactic acid)7 种有机酸。乳酸在不同泡菜母水中的含量差异较大,其中A 样品含量最低为(0.30±0.01)mg/mL,C 样品含量最高为(3.10±0.43)mg/mL,其它样品的含量在1.02~1.76 mg/mL 之间。乳酸主要是乳酸菌通过糖类物质代谢产生,主要有同型发酵和异型发酵,其酸味柔和爽口,赋予泡菜独特的风味。草酸含量为2.62~5.37 mg/mL,其中D 和E样品草酸含量显著高于其它样品(P<0.05)。琥珀酸含量为5.35~7.42 mg/mL,其中E 样品琥珀酸含量【(7.42±0.18)mg/mL】显著高于其它样品(P<0.05)。草酸和琥珀酸也是泡菜中重要的风味物质,主要来源是泡菜原料,因此泡菜母水中的含量普遍较高。邓维琴等[22]发现琥珀酸含量在泡菜母水中逐渐上升,后期泡菜母水含量差异较小,与本试验研究一致。酒石酸含量为0.09~1.35 mg/mL,其中C 样品中含量显著高于其余样品(P<0.05),A样品中未检出。C 样品乙酸含量【(2.89±0.04)mg/mL】和B 样品中乙酸含量【(2.50±0.05)mg/mL】显著高于其余样品(P<0.05)。柠檬酸含量为0.59~2.14 mg/mL,样品之间存在显著差异(P<0.05)。酒石酸、乙酸和柠檬酸的产生和积累主要取决糖类物质的代谢和原料提供的底物,对泡菜独特的风味形成具有重要作用。黄岩等[23]研究表明酒石酸、苹果酸、柠檬酸和琥珀酸等味道柔和、刺激性小,可显著改善泡菜风味,比例协调、多种有机酸共同作用可使泡菜风味更加醇和与丰富。研究发现样品中草酸随着发酵时间的增长而减少,而乳酸含量与发酵时间成正比。样品中有机酸含量不相同的原因,可能是原料不同和微生物组成差异导致[11,24]。
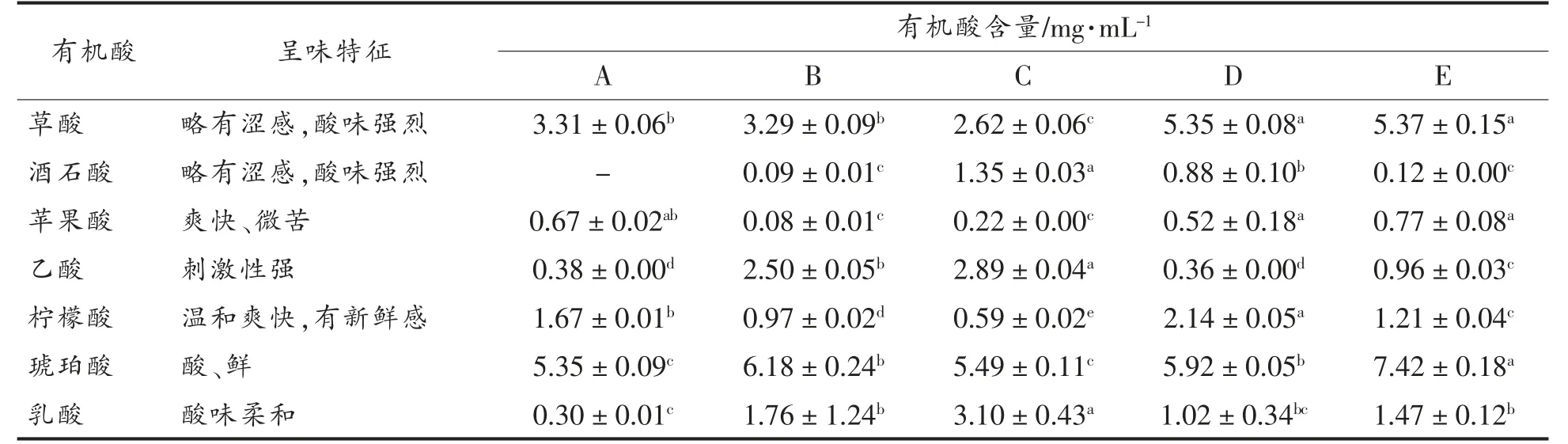
表4 泡菜母水有机酸含量Table 4 Organic acid content of pickle brine
2.2 泡菜母水微生物群落
2.2.1 Alpha 多样性分析 利用MiSeq 测序方法对5 种来源泡菜母水样品进行分析,根据样品的扩增子序列变异体(Amplicon sequence variants,ASV)数据结果作图。如图1 所示。随着样品的测序深度增加,香农指数(Shannon)逐渐增加,曲线逐渐从上升趋于平坦,提示所测序的深度可以囊括泡菜母水样品中大多数的菌落,并且能够较完整地反映样品微生物群落多样性[25]。

图1 细菌(a)和真菌(b)稀疏曲线分析Fig. 1 Rarefaction curve analysis of bacteria(a)and fungi(b)
Alpha 多样性是指局部均匀生境下的物种在丰富度(Richness)、多样性(Diversity)和均匀 度(Evenness)等方面的指标。为能较全面评估微生物群落的alpha 多样性,以Chao 1 和可观察物种指数表征丰富度,以香农指数和辛普森指数表征多样性。表5 可知,A 的细菌Chao 1 指数(3 445.56±104.77)和可观察物种指数(3 199.30±194.40)显著高于其它样品(P<0.05);A 的细菌香农指数(7.90±0.24)和辛普森指数(0.97±0.00)显著高于其它样品(P<0.05)。A 的细菌多样性最高,B 和D 的真菌Chao 1 指数和可观察物种指数显著高于其它样品(P<0.05);E 的真菌香农指数(1.51±0.08)和辛普森指数(0.50±0.02)显著高于其它样品(P<0.05)。在真菌方面,B 和D 具有较高的丰富度,而E 的真菌多样性高于其余样品。综合考虑丰富度和多样性的指标,A 样品泡菜母水中的细菌微生物丰度和Alpha 多样性较为突出,而D 样品的真菌丰度和Alpha 多样性较为突出。可能是原料和发酵工艺不同导致不同泡菜母水具有不同的丰富度和多样性。

表5 泡菜母水中微生物Alpha 丰富度指数和多样性指数Table 5 Microbial Alpha richness index and diversity index in pickle brine
为研究不同样本间共有物种,根据各处理组在100%序列相似水平下的ASV 生物信息统计,绘制泡菜母水样品的韦恩图[26]。图2a 为不同样品的细菌群落韦恩图,A 样品含有细菌ASV 7 513个,B 样品含有细菌ASV 217 个,C 样品含有细菌ASV 150 个,D 样品含有细菌ASV 150 个,E 样品214 个,其中5 种样品共有细菌ASV 4 个。A 样品含有的细菌ASV 数目最多,远大于其它组样品,与Alpha 多样性结果一致。图2b 为不同样品得真菌群落韦恩图,A 样品含有真菌ASV 9 个,B 样品含有真菌ASV 37 个,C 样品含有真菌ASV 12个,D 样品含有真菌ASV 53 个,E 样品含有真菌ASV 21 个,其中5 种样品共有真菌ASV 2 个。D样品的真菌ASV 数目最多,与Alpha 多样性结果一致。

图2 泡菜母水样品细菌群落(a)和真菌群落(b)韦恩图Fig. 2 Venn diagram of bacterial community(a)and fungal community(b)of pickle brine
2.2.2 细菌群落结构分析 5 种泡菜母水样品序列通过RDP Classifier 贝叶斯算法对100%相似水平的ASV 代表序列进行分类,并对样本中的相对丰度前10 进行分类学分析。在群落组成分析中,将相对丰度大于1%的物种归为优势菌。在门水平上,其样品群落组成如表6 所示,发现样品B、C、D、E 中主要由厚壁菌门(Firmicutes)组成,均超过99%,而A 样品与其它4 种差异较大,厚壁菌门相对丰度为为22.64%,优势门还有拟杆菌门、变形菌门、放线菌门,分别占比为71.27%,2.08%和2.17%。郭壮等[27]利用高通量技术对泡菜水进行研究,发现厚壁菌门是泡菜水的优势门,与本文研究结果相同。
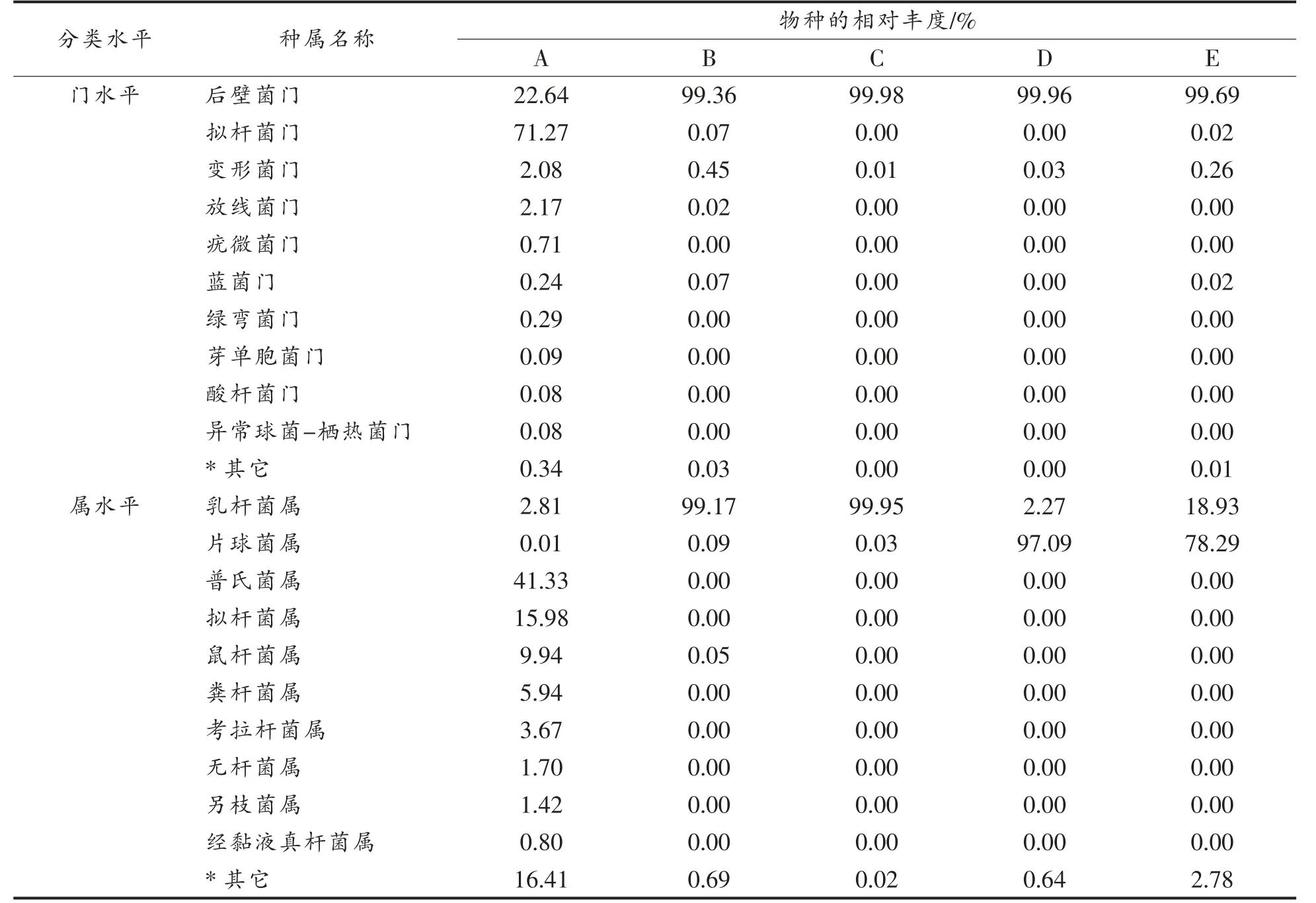
表6 不同样品中细菌在门水平和属水平的种类构成Table 6 The composition of bacteria at the level of phylum and genus in different samples
在属分类水平上,样品群落组成如表6 所示,泡菜母水中的细菌菌属主要是乳杆菌属(Lactobacillus)和片球菌属(Pediococcus)。B 和C 样品的细菌菌属组成较相似,其乳杆菌属的占比分别是99.17%和99.95%;D 和E 样品较相似,其中D 样品中片球菌属的占比为97.09%,乳杆菌属的占比为2.27%,E 样品中的片球菌属的占比为78.29%,乳杆菌属的占比为18.93%。A 样品的细菌群落较为丰富,普氏菌属(Prevotella_9)41.33%、拟杆菌属(Bacteroides)15.98%、鼠杆菌属(Muribaculaceae)9.94%、粪杆菌属(Faecalibacterium)5.94%、考拉杆菌属(Phascolarctobacterium)3.67%、乳杆菌属(Lactobacillus)2.81%、无杆菌属(Agathobacter)1.70%、另枝菌属(Alistipes)1.42%,这可能是其泡菜的原料和理化特性不同导致微生物群落不同。曹佳璐[28]对126 种老盐水进行研究,发现乳杆菌属是绝对优势菌属,耐酸乳杆菌、布氏乳杆菌、短乳杆菌 和耐乙醇片球菌4 种乳酸菌在所有样品中的检出率大于90%,是泡菜盐水样品的核心菌种。张安等[29]在解析四川泡菜发酵过程中的细菌多样性发现乳杆菌属在发酵的中期和后期都是绝对优势菌。乳杆菌属和片球菌属也常见于各种发酵乳制品传统发酵食品,在发酵过程中代谢产生大量乳酸、降低pH 值,抑制有害菌,并产生各种风味物质,最终使传统发酵食品具有其特征风味[30-31]。
2.2.3 真菌群落结构分析 5 种来源泡菜母水样品序列通过RDP Classifier 贝叶斯算法对100%相似水平的ASV 代表序列进行分类,并对样本中的相对丰度前10 进行分类学分析。在门水平上,其样品群落组成如表7 所示。发现5 种泡菜母水中的绝对优势菌群为子囊菌门(Ascomycota),相对丰度分别为99.99%,99.91%,99.99%,99.92%及99.99%,还有极少量的担子菌门(Basidiomycota)及其它的门类,而且菌群种类差别不大,表明在门水平上5 种泡菜母水样品的真菌菌群丰富度差别不显著。李恒等[32]四川地区泡菜研究结果表明,在泡菜发酵结束后真菌群落在子囊菌门占绝对优势,所占比例达到99%以上,与本文的研究结果相同;吕嘉枥等[33]传统自然发酵老坛泡菜研究结果表明子囊菌门是优势菌落,而其绝对优势菌落占比达到77%以上,与本研究结果有一定差异,可能是发酵工艺、原辅料等不同所致。

表7 不同样品中真菌在门水平和属水平的种类构成Table 7 The composition of fungi at the level of phylum and genus in different samples
在属分类水平上,其真菌群落组成如表7 所示,毕赤酵母属(Pichia)在A、B、C 和E 样品中相对丰度的占比均超过99%;而D 样品与其余4 种差别极大,毕赤酵母属的占比只有0.76%,远低于其它样品,优势真菌属为哈克斯坦酵母属(Kazachstania)和德巴利酵母属(Debaryomyces),占比为80.28%和18.44%,原因可能是原料的不同。唐丽等[34]在不同发酵时间工业萝卜泡菜中发现毕赤酵母属是其中的优势真菌属;Rao 等[10]在传统发酵萝卜泡菜中发现已鉴定的属中,毕赤酵母属表现出最高的优势,丰度为96.23%,与本文结果相似。
2.3 优势微生物和理化特性的相关性分析
泡菜母水的优势菌属与理化特性之间的相关性见图3。乳杆菌与乳酸具有显著正相关关系(P<0.05),与乙酸具有极显著正相关关系(P<0.01),与柠檬酸呈现显著负相关关系(P<0.05)。乳酸菌能将糖类代谢成风味物质,并且是乳酸产生的主要来源。Ye 等[35]研究微生物与腌制辣椒风味特性的关系,发现乳酸杆菌与有机酸(乙酸、琥珀酸、抗坏血酸和苹果酸)具有高度相关性。鼠杆菌与盐含量具有显著正相关性(P<0.05),鼠杆菌是一种有益肠道菌,在代谢过程中主要产生丙酸[36]。片球菌属与苹果酸具有极显著正相关关系(P<0.01),且与草酸、柠檬酸和琥珀酸呈正相关关系。毕赤酵母作为大多数样品中的主要真菌属,可能样品毕赤酵母相对丰度差异性不显著,导致与理化特性的相关性难以体现。结果表明,乳酸杆菌和片球菌与有机酸含量的相关性较高。
3 结论
对不同来源的泡菜母水中微生物群落和理化特性的分析,发现不同样品中的微生物群落较为相似,而理化特性存在一定差异。选取的优良泡菜母水样品pH 值和盐含量较为稳定,总酸和有机酸含量不同,可能是由原料和微生物组成的不同以及循环使用代数不同所致。泡菜母水中主要存在的微生物在门水平为厚壁菌门和子囊菌门,在属水平是乳杆菌属、片球菌和毕赤酵母。通过对优势微生物和理化特性进行相关性分析得出,乳酸杆菌与乳酸和乙酸具有显著正相关关系,片球菌与苹果酸具极显著正相关关系,因此可以认为乳酸杆菌和片球菌是与有机酸相关的主要优势菌株。本研究通过对不同来源的泡菜母水的研究,期望得到有利于泡菜产品的发酵菌株,为筛选优势发酵菌株提供参考。

