氮掺杂碳量子点荧光法检测猪肉中的四环素
周 彤,毋 晨,赵 文,李 明,彭汝艳,周 茜*
(1 河北农业大学食品科技学院 河北保定071001 2 河北农业大学理学院 河北保定 071001)
四环素(Tetracycline,TC)一种由链霉菌产生的广谱抗生素,对革兰氏阳性细菌、革兰氏阴性细菌、支原体、衣原体、立克次体和螺旋体等有抵抗作用[1]。TC 为一种常见的抗生素,因具有抗菌活性、口服吸收特性、毒性低和成本低等优势而被应用于动物细菌性疾病的预防和治疗[2-3]。此外,TC还可作为促进生长剂添加到饲料中,以促进动物的生长[4]。然而,一些畜牧业养殖者为了追求利益,在动物饲养过程中过度使用TC,使其在动物源性食品中积累,对人类健康造成重大威胁[5]。长期摄入含TC 残留的食物会导致牙齿发黄、胃肠道紊乱、过敏反应、肝损伤等不良反应,增加细菌对抗生素的耐药性[6-9]。监测动物产品中TC 的残留对于确保食品安全至关重要。
到目前为止,毛细管电泳法[10]、液相色谱-质谱法[11]和高效液相色谱法[12]都是检测TC 的传统方法。以上方法虽然灵敏度高,结果更为精确,但是对于仪器精密度、样品预处理过程和操作人员的专业水平要求较高。近年来,基于酶联免疫[13]、电化学[14]、比色[15]和荧光[16]法的TC 检测策略被开发出来。例如:荧光法是一种操作简便、反应迅速、灵敏度高、成本低的分析方法,它以有机荧光染料或荧光纳米材料为信号平台。由于碳量子点、量子点、金属纳米团簇、核苷酸/镧系配位聚合物和金属有机框架等荧光纳米材料可以被TC 有效猝灭,因此基于荧光猝灭的方法得到广泛的探索。
碳量子点(Carbon quantum dots,CQDs),也称为碳点,是Xu 等[17]在电泳法纯化单壁碳纳米管过程中意外发现的。CQDs 是一种新型荧光纳米材料,尺寸小于10 nm,具有优异的光稳定性、良好的水溶性、毒性低和生物相容性好的特性。此外,其前驱体材料来源广泛,成本低廉,制备方法简便且环保,在不同的领域得到广泛的应用。
本文以菠萝皮为碳源,二乙烯三胺为氮原子供体,采用水热法制备氮掺杂碳量子点(Nitrogendoped carbon quantum dots,N-CQDs)。通过对pH 值、BR 缓冲溶液用量、N-CQDs 用量、反应温度以及反应时间的优化,旨在建立一种基于内滤效应和静态猝灭原理的TC 荧光检测方法,并将该方法用于猪肉样品中TC 的检测。
1 材料与方法
1.1 材料与试剂
菠萝皮、新鲜猪肉,保定农贸市场;四环素标准品(≥95%),上海源叶生物科技有限公司;葡萄糖(Glucose,Glu)、果糖(Fructose,Fru,99%)、乳糖(Lactose,Lac,99%)、蔗糖(Sucrose,Suc)、赖氨酸(Lysine,Lys,≥99%)、精氨酸(Arginine,Arg,98%)、丙氨酸(Alanine,Ala,99%)、酪氨酸(Tyrosine,Tyr,≥99%)、半胱氨 酸(Cysteine,Cys,99%)、谷胱甘肽(Glutathione,GSH,99%)、抗坏血酸(Ascorbic acid,AA,99.7%)、金霉素(Chlortetracycline,CTC,>95%)、土霉素(Oxytetracycline,OTC,≥95%)、强力霉 素(Doxycycline,DOX,95%)、氟苯尼考(Florfenicol,FF,≥98%)、青霉素(penicillin,PEN)、链霉素(Streptomycin,SM)、磺胺嘧啶(Sulfadiazine,SDI,≥98%)、氨苄西林(Ampicillin,AMP,96%)、阿奇霉素(Azithromycin,AZI,98%)、恩诺沙星(Enrofloxacin,ENR,98%)、头孢氨苄(Cephalexin,CEF,98%),上海源叶生物科技有限公司;二乙烯三胺(99%),上海吉至生化科技有限公司;硫酸奎宁(ST,98%),上海麦克林生化科技有限公司;甲醇、氯化钠、氯化钾、氯化钙、氯化锰、五水合硫酸铜、氯化锰、硫酸锌、三氯化铁、碳酸钠均为分析纯级,天津市科密欧化学试剂有限公司。
1.2 仪器与设备
F-320 荧光分光光度计,天津港东科技公司;高压反应釜,西安常仪实验室仪器商行;GZX-9240MBE 电热鼓风干燥箱,上海博迅实业有限公司医疗设备厂;TGL-16G 台式离心机,上海安亭科学仪器厂;SB-5200DT 超声清洗机,宁波新芝生物科技股份有限公司;UV-2802H 紫外-可见分光光度计,尤尼柯仪器有限公司;Tecnai G2 F30 STWIN 透射电子显微镜,美国FEI 公司;IRAFFinity-IS 光谱仪,日本岛津公司;Thermo escalab 250Xi 射线光电子能谱仪,美国赛默飞公司;FLS1000 稳态瞬态荧光光谱仪,英国爱丁堡公司;PiloFD8-4.3V 真空冷冻干燥机,美国Siemon 公司;0.22 μm 水相针式过滤器,上海安谱实验科技有限公司;Oasis HLB 固相萃取柱,美国Waters 公司。
1.3 试验方法
1.3.1 N-CQDs 的制备 以菠萝皮为碳源,二乙烯三胺为氮源,通过水热法制备N-CQDs[18]。在聚四氟乙烯内衬中加入0.25 g 冻干菠萝皮粉、300 μL 二乙烯三胺和20 mL 超纯水,混合均匀后超声波处理10 min。将内衬密封在高压反应釜中,移入电热鼓风干燥箱中在180 ℃下加热10 h。加热完成后自然冷却至室温。在10 000 r/min 下将所得溶液离心10 min,用0.22 μm 滤膜过滤上清液,得到棕色N-CQDs 溶液,并在4 ℃下保存。
1.3.2 N-CQDs 的结构表征
1.3.2.1 紫外-可见吸收光谱 采用紫外可见分光光度计对N-CQDs 溶液进行光谱扫描,设置扫描波长为200~500 nm,扫描间隔为1 nm,扫描速度为中速。
1.3.2.2 荧光光谱 采用荧光分光光度计测定N-CQDs 溶液的荧光光谱,设置扫描速度为1 200 nm/min,电压为300 V,狭缝宽度为10 nm,增益为2。
1.3.2.3 透射电子显微镜(Transmission electron microscope,TEM)首先,将N-CQDs 溶液进行稀释并超声处理15 min。其次,将铜网放置在盖有封口膜的载玻片上,并把样品滴在铜网上,10 min后把多余的液体吸走,约1 h 后铜网自然晾干。最后采用TEM 对N-CQDs 的形貌、粒径分布进行分析。
1.3.2.4 傅里叶红外光谱(Fourier infrared spectroscopy,FTIR)取10~20 μL N-CQDs 滴在0.2 g 溴化钾上,120 ℃干燥4 h 以上。将干燥后的样品研磨均匀压片后,采用IRAFFinity-IS 光谱仪记录4 000~500 cm-1范围内的FTIR 并对N-CQDs 所含官能团进行分析。
1.3.2.5 X 射线光电子能谱(X-ray photoelectron spectroscopy,XPS)采用Thermo escalab 250Xi射线光电子能谱仪对N-CQDs 所含的各种元素含量及表面基团进行分析。将样品滴在硅片上,把硅片固定在样品台后送入快速进样室。选用铝单色器,10 mA 的发射电流,15 kV 的阳极电压。开启X-射线源扫描,进行数据采集。
1.3.2.6 荧光量子产率(Quantum yield,QY)的测定 选用硫酸奎宁(360 nm 激发波长下的QY 为54%)作为计算N-CQDs 荧光量子产率的参照物[19]。将硫酸奎宁溶于0.1 mol/L 的H2SO4溶液中,通过紫外-可见吸收光谱得到硫酸奎宁和NCQDs 的吸光度(两种溶液的吸光度都小于0.1)。然后,通过荧光光谱得到两种溶液的荧光积分面积。按照下列公式计算N-CQDs 的QY。
QYN-CQDs(%)=QYST(IN-CQDs/IST)(AST/AN-CQDs)(ηN-CQDs/ηST)2
式中,QY——荧光量子产率,%;I——荧光积分面积;A——360 nm 激发波长处的吸光度;η——溶液的折射率,其中水的折射率为1.33,0.1 mol/L H2SO4的折射率为1.33。
1.3.3 检测条件的优化
1.3.3.1 pH 值的优化 取75 μL N-CQDs 置于离心管中,分别加入300 μL 不同pH 值(2,3,4,5,6,7,8,9,10,11,12)的BR 缓冲溶液和适量的TC溶液,超纯水定容至3 mL。记录不同pH 值下的(F0-F)/F0,其中F 为不含TC 时检测体系的荧光强度,F0为含有TC 时检测体系的荧光强度。以此来确定该检测体系的最佳pH 值。
1.3.3.2 BR 缓冲溶液用量的优化 取75 μL NCQDs 置于离心管中,分别加入不同体积(100,300,600,900,1 200,1 500 μL)最佳pH 值的BR缓冲溶液和适量的TC 溶液,超纯水定容3 mL。记录不同BR 缓冲溶液用量下的(F0-F)/F0以此来确定该检测体系BR 缓冲溶液的最佳用量。
1.3.3.3 N-CQDs 用量的优化 取不同体积的NCQDs 置于离心管中,分别加入最优的BR 缓冲溶液和适量的TC 溶液,超纯水定容至3 mL。记录不同N-CQDs 用量下的(F0-F)/F0以此来确定该检测体系N-CQDs 的最佳用量。
1.3.3.4 反应温度的优化 在最优pH 值、BR 缓冲溶液用量和N-CQDs 用量下,将反应体系分别置于不同温度下(20,25,30,35,40,45,50 ℃)反应10 min。记录不同反应温度下的(F0-F)/F0以此来确定该检测体系的最佳反应温度。
1.3.3.5 反应时间的优化 在最优pH 值、BR 缓冲溶液用量、N-CQDs 用量和反应温度下,将反应体系摇匀后分别反应不同时间(0,10,20,30,40,50,60 min)。记录不同反应时间下的(F0-F)/F0以此来确定该检测体系的最佳反应时间。
1.3.4 TC 标准曲线的建立 取75 μL N-CQDs和300 μL pH=7 BR 缓冲溶液置于离心管中,再加入不同质量浓度的TC 标准溶液,并用超纯水定容至3 mL。将溶液完全混合后,测定375 nm 激发波长下的荧光强度F。同时,设置不加TC 的对照组,用来对比TC 加入前、后检测体系的变化情况。最后,以TC 质量浓度为横坐标,猝灭率(F0-F)/F0为纵坐标绘制标准曲线。
1.3.5 选择性和干扰性试验 选择实际样品中可能存在的共存物质,对N-CQDs 的选择性进行考察,如离子(K+、Na+、Ca2+、Mg2+、Zn2+、Mn2+、Fe3+、CO32-)、糖类(Glu、Fru、Lac、Suc)、小生物分子(Lys、Arg、Ala、Tyr、Cys、GSH、AA)以及其它种类抗生素(CTC、OTC、DOX、FF、PEN、SM、SDI、AMP、AZI、ENR、CEF)。将上述干扰物质与N-CQDs 混合后测定其荧光强度。此外,分别将上述干扰物质加入到NCQDs 和TC 的混合体系中测定其荧光强度,进一步评价该检测方法的抗干扰能力。
1.3.6 检测机理的探究 为了揭示TC 对NCQDs 荧光猝灭的机理,首先,采用稳态瞬态荧光光谱仪测定TC 加入前、后N-CQDs 的荧光寿命。其次,采用紫外荧光分光光度计测定N-CQDs、TC以及N-CQDs+TC 的紫外-可见吸收光谱。最后,采用荧光分光光度计对N-CQDs 的荧光光谱进行测定。
1.3.7 实际样品的分析 选择当地市场的新鲜猪肉为实际样品进行添加回收试验。将TC 标准溶液添加到均质后的猪肉样品中,静置10 min 后,对猪肉样品进行预处理。猪肉的预处理方式参照GB/T 21317-2007《动物源性食品中四环素类兽药残留量检测方法 液相色谱-质谱/质谱法与高效液相色谱法》,将5 g(精确至0.01 g)均质后的猪肉样品置于含有20 mL Na2EDTA-Mcllvaine 缓冲溶液的离心管中,涡旋1 min 后,冰水浴超声10 min,使用低温离心机在8 000 r/min 下离心10 min。重复3 次,Na2EDTA-Mcllvaine 缓冲溶液用量分别为20,20,10 mL,合并上清液,用滤纸过滤。最后,采用Oasis HLB 固相萃取柱对滤液进行纯化后,进行检测。
1.4 数据统计与分析
本试验所有数据均采用SPSS 19.0 统计软件进行分析,试验数据均为3 次平行试验的平均值,以平均值±标准差表示,并采用Origin 2018 进行绘图。
2 结果与分析
2.1 N-CQDs 的结构表征
2.1.1 紫外-可见吸收光谱和荧光光谱分析 NCQDs 的光学性质如图1 所示。N-CQDs 在波长365 nm 紫外光照射下呈现亮蓝色荧光,而在自然光下呈淡黄色。N-CQDs 紫外-可见吸收光谱的最大吸收峰为340 nm,这归因于结构中C=O 的nπ*跃迁[20]。通过荧光光谱发现N-CQDs 的最大激发波长为375 nm,在375 nm 激发波长下最大发射峰在448 nm 处呈现。
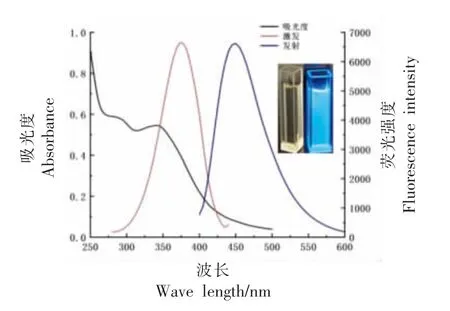
图1 N-CQDs 紫外-可见吸收光谱、荧光激发和发射光谱Fig. 1 UV-Vis spectrum,fluorescence excitation and emission spectra of N-CQDs
2.1.2 TEM 形貌分析和荧光量子产率 通过TEM 可以直观地表征N-CQD 的形态和尺寸分布。如图2a 所示,N-CQD 整体呈现球形,尺寸均匀,分散性良好,具有明显的晶格结构,晶格间距为0.25 nm,对应于石墨碳的(020)衍射面[21]。随机选取300 个N-CQDs,对粒径分布进行统计,结果表明该N-CQDs 直径分布范围为1~6 nm,平均直径为3.53 nm(图2b)。以上结果与先前文献报道的相一致,通过水热法制得的CQDs 分散性好,平均直径在4 nm 左右。

图2 N-CQDs 的TEM 形貌分析(a)和粒径分布直方图(b)Fig. 2 TEM morphology analysis(a)and size distribution(b)of N-CQDs
荧光量子产率是评价CQDs 发光性能的重要参数。相关文献表明,荧光量子产率在10%~100%之间才有应用价值,而目前合成CQDs 的荧光量子产率超过15%的还比较少[22]。根据1.3.2.6 节中的公式计算N-CQDs 的荧光量子产率为41.54%,表明以菠萝皮为反应前体制得的N-CQDs 荧光量子产率较高。
2.1.3 FTIR 结构分析 采用FTIR 对N-CQDs 表面的官能团进行了评价。如图3 所示,N-CQDs 表面存在多个官能团,3 444 cm-1处的吸收带是因为N-H 和O-H 发生了伸缩振动[23];COOH 和C=C 的存在表现为在1 640 cm-1附近出现吸收峰[24];1 435 cm-1处的吸收峰对应C-N 的伸缩振动;CO-C 和C-O 的伸缩振动表现为在1 126 cm-1和1 103 cm-1处出现吸收峰[25];621 cm-1的宽振动表明CH2的存在[26]。FTIR 分析结果表明,N-CQDs 表面具有不饱和碳结构、含氧基团和含氮基团,这可以增强N-CQDs 的亲水性。因此,N-CQDs 具有优异的水溶性。

图3 N-CQDs 的红外光谱图Fig.3 FTIR spectrum of N-CQDs
2.1.4 XPS 成分分析 通过XPS 表征了N-CQDs的元素类型和化学环境,结果如图4 所示。图4a显示了N-CQD 全范围XPS 分析结果,XPS 全扫描谱中在284.84,398.93 eV 和530.91 eV 处有3个主要峰,分别对应于C1s、N1s 和O1s 3 种元素,元素组成分别为68.44%,15.85%和15.70%。如图4b所示,C1s 的高分 辨XPS 谱图在284.2,285.3 eV 和287.1 eV 处出现3 个峰,分别是C-C、C-O/C-N 和C=O 键的特征峰。如图4c 所示,在高分辨N1 中398.5,399.6 eV 和400.8 eV 处的3 个特征峰,表明C=N-C、N-(C)3和N-H 的存在[27-28]。如图4d 所示,O1s 高分辨XPS 光谱中530.3 eV 和531.5 eV 的2 个特征峰,分别代表O-C 和O=C键[29-30]。

图4 N-CQDs 的XPS 光谱图Fig. 4 XPS spectra of N-CQDs
2.2 检测条件的优化
为了获得更宽的线性范围和灵敏度,本试验对pH 值、BR 缓冲液用量、N-CQDs 用量、反应温度和反应时间进行了优化,并以(F0-F)/F0为指标确定最佳检测条件。
2.2.1 pH 值对检测体系的影响 pH 值对TC 检测的影响如图5 所示。在2~12 的pH 值条件下,(F0-F)/F0随pH 值的变化而变化。当pH 值为7时,(F0-F)/F0值达到最大值。因此,选择pH 值为7 的BR 缓冲溶液作为检测TC 的最佳pH 值。
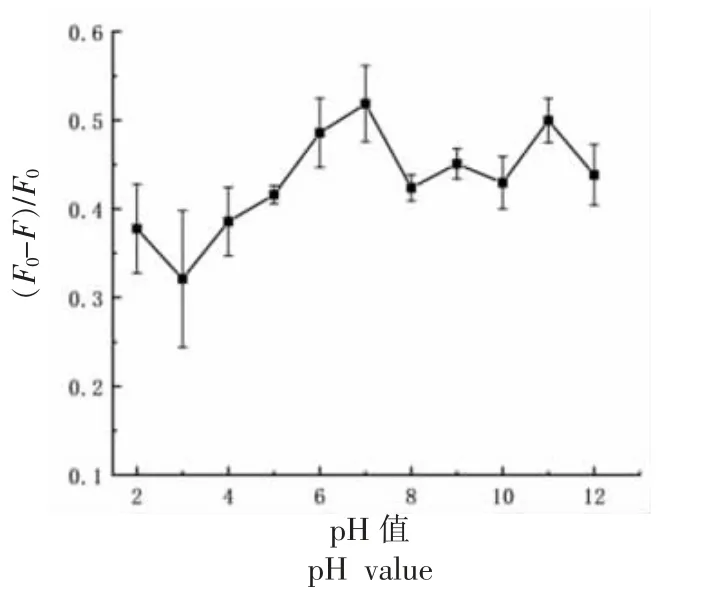
图5 pH 值对检测体系的影响Fig. 5 Effects of pH value on the detection system
2.2.2 BR 缓冲溶液用量对检测体系的影响 BR缓冲溶液用量对TC 检测的影响如图6 所示。当检测体系中加入不同体积的BR 缓冲溶液,(F0-F)/F0值发生改变。当BR 加入体积为0.3 mL 时,(F0-F)/F0为最大值。因此,选择0.3 mL 作为检测TC的最佳BR 缓冲溶液用量。

图6 BR 缓冲溶液用量对检测体系的影响Fig. 6 Effects of dosage of BR buffer solution on the detection system
2.2.3 N-CQDs 用量对检测体系的影响 NCQDs 用量对TC 检测的影响如图7 所示。当检测体系中加入不同体积的N-CQDs,(F0-F)/F0值发生变化。当(F0-F)/F0到达最大值时N-CQDs 的用量为75 μL。因此,选择75 μL 作为检测TC 的最佳N-CQDs 用量。

图7 N-CQDs 用量对检测体系的影响Fig. 7 The effect of dosage of N-CQDs on detection system
2.2.4 反应温度对检测体系的影响 反应温度对TC 检测的影响如图8 所示。当反应温度在20~50℃范围内,温度越高,反应越剧烈,(F0-F)/F0在40℃时最大。因此,选择40 ℃作为检测TC 的最佳反应温度。
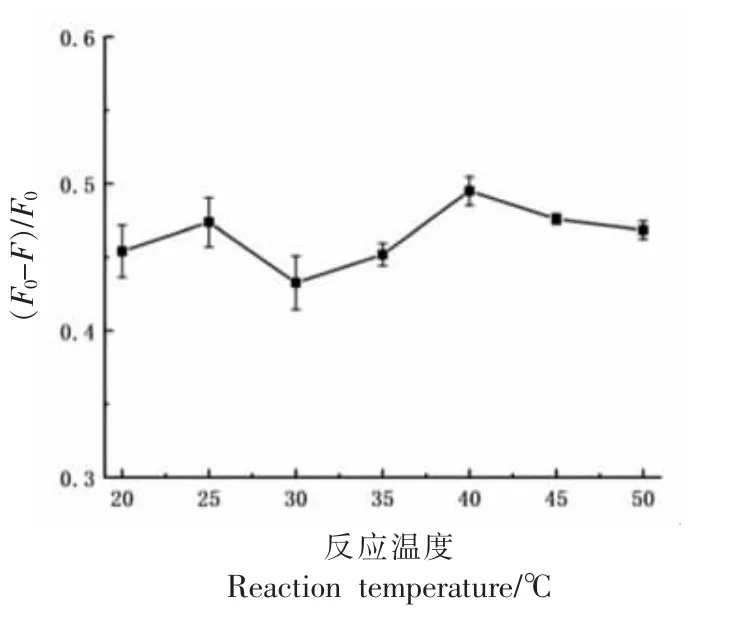
图8 反应温度对检测体系的影响Fig. 8 Effects of reaction temperature on the detection system
2.2.5 反应时间对检测体系的影响 反应时间对TC 检测的影响如图9 所示。(F0-F)/F0在60 min内无明显变化。因此,为了节省时间最佳反应时间定为1 min。

图9 反应时间对检测体系的影响Fig. 9 Effects of reaction time on the detection system
2.3 TC 标准曲线的建立
为了验证该检测方法的灵敏度,在最佳试验条件下建立了TC 的标准曲线。如图10a 所示,随着TC 质量浓度的增加,N-CQDs 的荧光强度不断降低。如图10b 所示,当TC 质量浓度在0.3~40 g/mL 范围内时,(F0-F)/F0与TC 质量浓度呈良好的线性关系,线性方程为y=0.0121x+0.0224,R2=0.9982,检出限为89.26 μg/L。

图10 TC 质量浓度对N-CQDs 荧光强度的影响及该方法的线性关系Fig. 10 The effect of TC mass concentration on the fluorescence intensity of N-CQDs and the linear relationship of this method
2.4 选择性和干扰性试验
如图11 所示,只有TCs(TC、CTC、OTC、DOX)可以猝灭N-CQDs 的荧光,而一些离子、糖类和氨基酸等干扰物质对N-CQDs 的荧光强度影响很小,并且磺胺类、喹诺酮类、大环内酯类和β-内酰胺类抗生素对N-CQDs 的荧光强度影响也很小,与TC 相比可以忽略不计,甚至表现出荧光增强。结果表明,N-CQDs 对TCs 具有高选择性。此外,将上述干扰物质分别添加到检测体系中比较荧光响应,进一步评估该荧光检测方法对TC 检测的抗干扰能力。如图12 所示,当干扰物质与TC 共存时,没有观察到猝灭率的明显变化,只有CTC、OTC 和DOX 加入到检测体系中时会引起猝灭率增加。

图11 N-CQDs 对离子、糖类、小生物分子和抗生素的选择性Fig. 11 The selectivity of N-CQDs for cations and anions,carbohydrate,small molecules and other antibiotics

图12 离子、糖类、小生物分子和抗生素对检测体系的影响Fig. 12 The influence of ions,sugars,small biomolecules,and antibiotics on the detection system
2.5 检测机理
本试验探讨了TC 对N-CQDs 的荧光猝灭机理。首先,测定了TC 加入前、后N-CQDs 的荧光寿命,N-CQDs 的荧光寿命为13.20 ns,TC 加入后的荧光寿命为13.43 ns(表1),提示TC 存在与否对N-CQDs 的荧光寿命无明显影响,说明该猝灭过程为静态猝灭,不存在动态猝灭和荧光共振能量转移[31]。N-CQDs、TC 以及N-CQDs+TC 的紫外-可见吸收光谱如图13a 所示,N-CQDs+TC 的紫外-可见吸收光谱较N-CQDs 和TC 而言出现了新的吸收峰,这验证了该猝灭过程为静态猝灭[32]。如图13b 所示,TC 的紫外-可见吸收光谱出现了2 个特征吸收峰,分别在波长276 nm 和358 nm处,与N-CQDs 的激发光谱有较好的重叠。一般来说,吸光体的吸收光谱与碳量子点的激发或发射光谱重叠时会发生内滤效应使CQDs 的荧光猝灭[33]。以上结果表明,TC 对N-CQDs 的荧光猝灭是静态猝灭和内滤效应的共同作用。
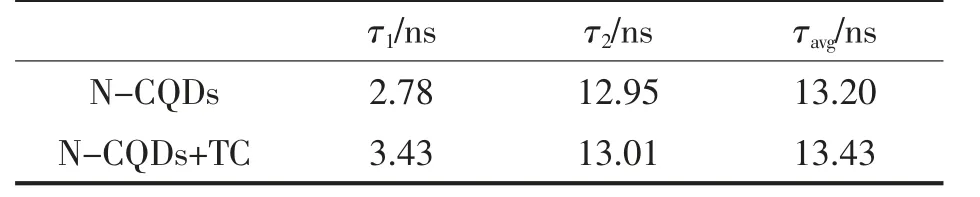
表1 TC 加入前、后N-CQDs 的荧光寿命Table 1 Fluorescence lifetime of N-CQDs in the absence and presence of TC

图13 N-CQDs 针对TC 的检测机理Fig. 13 The detection mechanism of N-CQDs for TC
2.6 实际样品检测
为了评价该检测方法在实际样品中的适用性,本试验将该方法用于猪肉样品中TC 的检测。将5,15,30 μg/mL TC 标准液添加到猪肉提取液中,在最优试验条件下对TC 进行检测。如表2 所示,猪肉中TC 的回收率在98.40%~106.02%内,相对标准偏差(Relative standard deviation,RSD)为1.29%~3.88%,均小于5%,说明该检测方法对猪肉样品中TC 的检测,具有良好的准确性和精密度。

表2 猪肉样品中TC 检测Table 2 Determination of TC in pork
3 讨论
CQDs 作为一种新型纳米材料,由于其优异的水溶性、光学特性、化学稳定性和低毒性,越来越受到研究人员的关注。CQDs 的合成方法众多,可将其分为“自上而下”和“自下而上”两类方法[34],其中“自下而上”法中的水热法因资源易得、制备简单、过程绿色环保等优点而备受研究者关注[35]。通过水热法制备CQDs 的原料来源广泛,一般源自化学前体。近年来,由于经济和环境的迫切需要,人们开始关注利用废弃农产品合成CQDs 的相关研究[36]。Atchudan 等[37]以香蕉皮为原料,通过水热法合成了N-CQDs。制得的N-CQDs 呈球形,单分散,无明显聚集,表明存在含氧和含氮基团,其量子产率为23%。此外,还有人用稻壳、麦秸、西瓜皮等废弃农产品制备N-CQDs。本试验以菠萝皮为原料,通过水热法制备N-CQDs 并通过TEM、FTIR 和XPS 对N-CQDs 进行结构表征。结果与以上报道具有一致性,制得的N-CQDs 呈球形,分散性良好,尺寸分布均匀,其表面具有不饱和的碳结构、含氧和含氮基团,亲水性良好。与以上报道相比,本研究中N-CQDs 具有较高的量子产率41.54%,令其使用范围更加广泛,打破了量子产率低限制使用的局面。
初步探究其猝灭机理发现,TC 存在与否对N-CQDs 的荧光寿命无明显影响,并且TC 的紫外-可见吸收光谱与N-CQDs 的激发光谱有部分重叠。以上两点表明,N-CQDs 的荧光猝灭主要是由静态猝灭和内滤效应共同作用的结果。这与刘影[38]的研究结果具有相似性,即通过荧光CQDs 猝灭的方式来检测四环素,其检测机理为内滤效应和静态猝灭。
近年来,基于N-CQDs 的快速检测方法得到了科学家越来越多的关注。Cao 等[6]以红甜菜色素为原料,采用水热法合成了红甜菜色素荧光碳点(Red beet pigment carbon dots,RBP-CDs)并应用于四环素的检测。TC 的线性范围为0.5~30 mol/L 和30~90 μmol/L,检测限为0.36 μmol/L。当李义梅等[39]等通过水热法制备了一种N-CQDs。在TC 存在下,N-CQDs 荧光强度明显降低,当TC 浓度在1.6~16 μmol/L 和16~100 μmol/L 范围内与荧光猝灭强度呈现良好的线性关系,检出限为0.45 μmol/L。本研究建立一种基于N-CQDs 荧光猝灭法测定TC 的方法,在0.3~40 μg/mL 范围内,(F0-F)/F0与TC 质量浓度呈良好的线性关系,检出限为89.26 μg/L,两种方法相比检测范围与检测限在同一水平。对本方法进行了成本估算,0.25 g菠萝皮粉制得的N-CQDs 约可完成300 余样品中TC 的快速检测,其检测时间可控制在2 min 内,表明该检测方法成本低、性能高、时间短,不仅可以避免农产品废弃物的大量浪费,也为开发新型食品安全快速检测技术提供了一种新思路。
4 结论
本研究以菠萝皮为碳源,二乙烯三胺为氮源,通过水热法制备了具有蓝色荧光的N-CQDs。基于静态猝灭和内滤效应引起的荧光猝灭机理,建立了N-CQDs 荧光猝灭法测定TC 的方法。该方法的线性范围为0.3~40 μg/mL,检出限为89.26 g/L。将该检测方法应用到猪肉样品中TC 的检测,加标回收率为98.40%~106.02%,相对标准偏差为1.29%~3.88%,结果较理想。本研究建立的基于菠萝皮来源的N-CQDs 荧光猝灭TC 快速检测方法,具有绿色环保、成本低、操作简便、灵敏度高、选择性好以及响应速度快等优点,为拓宽TC 的食品快速检测方法的研究提供了新思路。

