活性多糖调控食物过敏的反应机制
薛 枫,饶 欢,尚一平,赵丹丹,郝建雄*,王成祥
(1 河北科技大学食品与生物学院 石家庄050000 2 河北省功能食品技术创新中心 石家庄 050000)
食物过敏又称超敏反应、食物变态反应或消化系统变态反应等,是一种由于反复暴露于特定食物而引起的对健康造成威胁的特异性免疫反应[1]。引起机体过敏的食物常见的有牛奶、鸡蛋、花生、坚果、鱼和贝类,这些食物占所有过敏食物的50%以上[2],过敏症状常出现在皮肤、胃肠道、呼吸道、眼睛等部位。美 国(1999 年:0.6‰;2009年:1.26‰)、英国(1998 年:1.2/10 万;2012 年:2.4/10 万)、新西兰(2002 年:5.7/10 万;2011 年:13.9/10 万)等对食物过敏住院率的调查指出:食物过敏引起的住院率在逐年攀升[3-5]。我国重庆0~24 月龄婴幼儿在1999 年食物过敏患病率为3.5%,2009 年增至7.7%,截至2019 年食物过敏的患病率达到11.1%[6]。由此可见,食物过敏对人们的影响日益严重。目前,食物过敏的治疗方法为药物(抗组胺、肾上腺、糖皮质激素、奥马珠单抗等)治疗、规避治疗、食物免疫耐受治疗、免疫治疗、益生菌治疗等[7]。在这些治疗方法中规避治疗是为最有效的治疗方法,然而这些治疗方法易造成营养不良,影响人们生活质量。近年的研究发现,从中草药中提取的活性多糖,如:灵芝多糖、枸杞多糖、香菇多糖具有缓解机体过敏的作用。本文对活性多糖与食物过敏关系进行梳理和总结,旨在为低过敏食品、药品的开发提供参考。
1 食物过敏机制
目前的研究表明食物过敏的反应机制有以下3 种:免疫球蛋白E(Immune globulin E,IgE)介导的食物过敏、非IgE 介导的食物过敏、二者混合介导的食物过敏。
1.1 IgE 介导的食物过敏
IgE 介导的Ⅰ型过敏反应包括致敏、激发和效应3 个阶段,一般会在摄入或接触触发食物后2 h 内发生,涉及的细胞有上皮细胞、固有免疫细胞、T 细胞、B 细胞、效应细胞(肥大细胞、嗜酸性粒细胞和嗜碱性粒细胞)[8-9],具体过程如图1 所示。
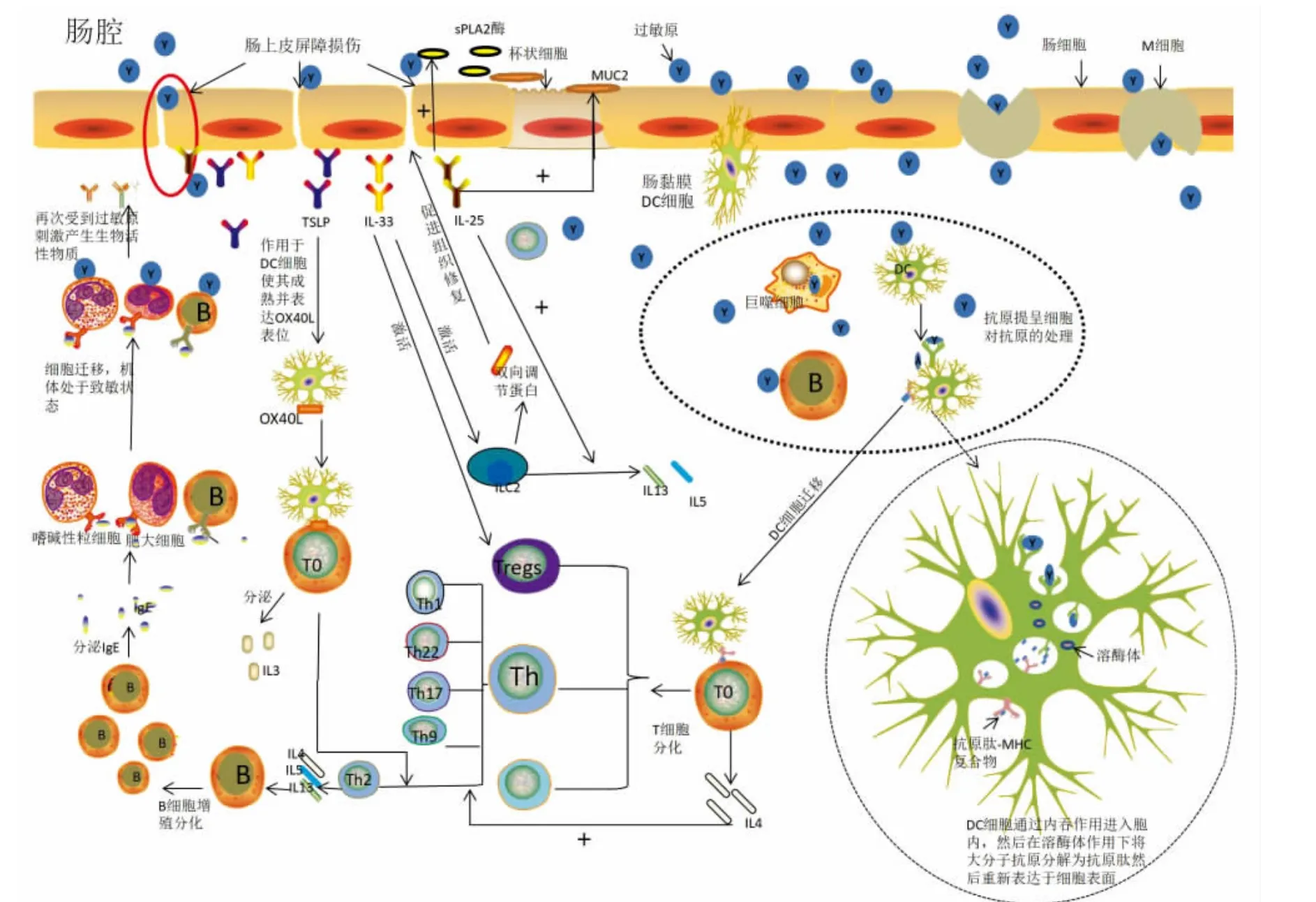
图1 食物过敏作用机制Fig. 1 Mechanism of food allergy
过敏原位于完整上皮屏障处可通过细胞旁路扩散,肠细胞、微折叠细胞或杯状细胞的主动转运,以及黏膜树突细胞(Dendritic cell,DC)的树突进入机体传递信号[9]。进入机体的过敏原通过各种内吞过程被抗原提呈细胞(Antigen-presenting Cell,APC)内化,将抗原降解成抗原多肽片段,此时APCs 活化。活化的APCs 通过主要组织相容性(Major histocompatibility complex,MHC)分子显示过敏原表位,然后与抗原肽结合并以抗原肽-MHC 复合物的形式表达于细胞表面[10]。抗原肽-MHC 复合物通过输出淋巴管进入肠系淋巴结并将抗原提呈给其中的初始T 细胞(Th0)[11]。随后T细胞增殖并分泌少量白介素4(Interleukin,IL-4),进而诱导Th0 细胞分化为辅助型T 细胞2(T helper cells,Th2)。Th2 分泌的IL-4、IL-5、IL-10和IL-13 等细胞因子通过CD40L/CD40 复合物提供刺激,诱导B 细胞进行类别转换并产生对抗原特异的IgE 抗体。分泌的IgE 通过血循环分布全身并与两种主要受体结合,即肥大细胞、嗜碱性细胞和树突状细胞上的高亲和力FcεRI 受体和B 细胞、多种先天细胞类型和上皮细胞上的低亲和力FcεRII 或CD23 受体,然后分布于皮肤、黏膜下,从而使机体处于致敏状态[12]。当致敏机体再次摄入相同过敏原后,会导致IgE 结合和嗜酸性粒细胞、嗜碱性粒细胞、肥大细胞等的激活,分泌一系列生物活性物质,如:组胺、白三烯、5-羟色胺等。这些生物活性介质作用于效应组织和器官,从而引发局部或者全身过敏反应[13]。
机体长期接触或摄入过敏原如:花生蛋白、肌球蛋白、牛奶蛋白等可使上皮屏障发生损伤,增加机体对过敏原的摄入,同时刺激上皮细胞产生细胞因子将危险信号传递给机体,这些细胞因子包括胸腺基质淋巴生成素(Thymic stromal lymphopoietin,TSLP)、IL-25 和IL-33。上皮细胞分泌的TSLP 可通过调节DC 成熟为APC 并表达OX40L 将信号传递,诱导幼稚T 细胞分泌IL-3 并分化为Th2 促进相关细胞因子的分泌,如:IL-3、IL-4、IL-5、IL-13、瘤坏死因子-α(Tumor necrosis factor α,TNF-α),而不分泌IL-10[14]。IL-25 可以显著提高肠腔内分泌型磷脂酶A2(Secretory Phospholipase,sPLA2)和杯状细胞糖蛋白黏蛋白2(Mucin2,MUC2)的水平,增强肠道屏障的防御机制,还可与CD4+Th2 细胞通过协同作用刺激2组先天淋巴细胞(Innate lymphoid cells,ILC2s)产生IL-5、IL-13,放大食物过敏反应[15-16]。IL-33可通过激活ILC2 或调节性T 细胞(Regulatory cells,Treg)产生双向调节蛋白来诱导上皮组织修复,还可直接作用于肥大细胞,增强IgE 介导的激活,诱导ILC2 细胞和DCs 的激活,从而驱动Th2细胞的反应[17-18]。
1.2 非IgE 介导的食物过敏
非IgE 介导的食物过敏反应相对温和,常于进食后24~72 h,甚至1~2 周内出现症状,其主要是通过释放Th2 细胞因子以及缺乏可以调节T 细胞的细胞因子从而导致食物过敏。非IgE 介导的食物过敏的发病机制较少描述,推测是T 细胞介导的过程。有研究表明非IgE 介导的胃肠食物过敏患者的抗原特异性T 细胞反应主要偏向Th2[19]。
1.3 二者混合介导的食物过敏
混合型反应是由IgE 与免疫细胞共同参与引起,在此种类型食物过敏的食管、胃或小肠壁常伴有嗜酸性粒细胞的浸润,外周血中的嗜酸性粒细胞增多。
2 活性多糖与食物过敏的关联研究现状
活性多糖是指具有某种特殊生理活性的多糖化合物,广泛存在于动物、植物、微生物中,常见的活性多糖有灵芝多糖、茯苓多糖、枸杞多糖、海藻多糖等。近年来,对活性多糖的研究主要集中在生物活性、药理活性、结构分析、化学修饰、分离纯化、工艺优化等方面,目前已知的活性多糖的功能性质有抗癌、抗肿瘤、抗炎、抗氧化、抗衰老、抗凝血、抗辐射、保肝、保护神经、促进组织再生等[20-21]。随着食物过敏患病率的增加,越来越多的人们将活性多糖应用于缓解食物过敏的研究。从表1 中可以看出较多的活性多糖具有效缓解机体食物过敏的功效,而对其具体作用机制的研究比较缺乏,因此对活性多糖干预食物过敏机制的研究较为重要。
3 活性多糖对食物过敏的作用途径
活性多糖对机体食物过敏的调节作用如图2所示,主要是通过降低肠道通透性、调节机制中细胞因子的分泌、维持肠道微生物的稳态等方式进行。
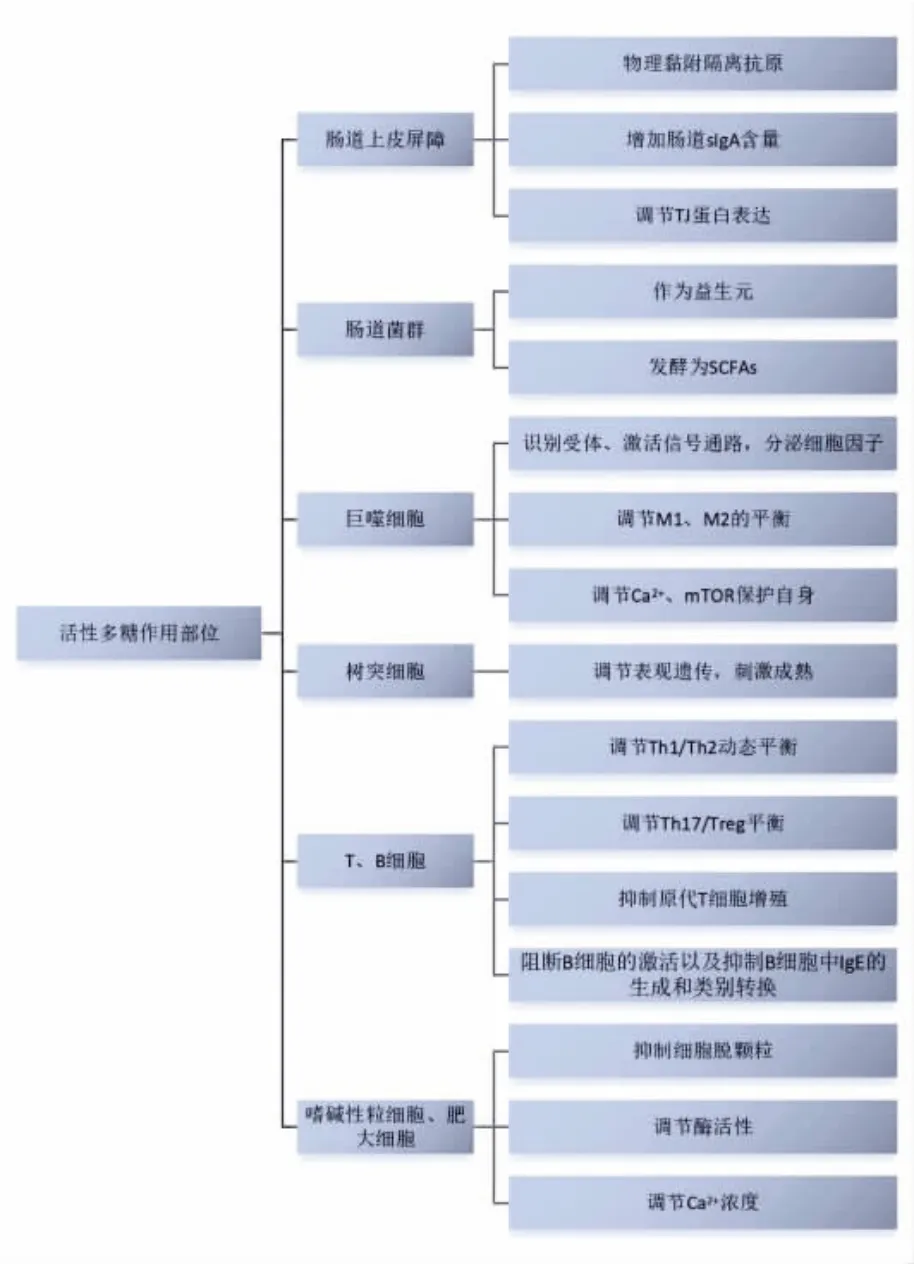
图2 活性多糖干预食物过敏途径分析Fig. 2 Analysis of the intervention pathway of active polysaccharides in food allergy
3.1 增强肠道上皮屏障的完整性
肠屏障是预防感染和炎症所需防御机制库中的关键组成部分,主要由肠道上皮细胞和细胞间连接构成,涉及的细胞包括微褶皱细胞、杯状细胞、潘氏细胞等。肠结构和功能的完整性在维持肠道黏膜免疫中发挥重要的作用,一旦上皮屏障功能被破坏,机体则会产生一系列的疾病,如食物过敏、炎症性肠病、溃疡性结肠炎等[35]。肠道上皮屏障的损伤主要有以下几方面的原因[36]:1)肠固有层淋巴细胞数量降低,损害肠黏膜功能完整性;2)小鼠肠黏膜分泌的免疫球蛋白A(Immunoglobulin A,sIgA)、IL-2、IL-6 等免疫细胞因子的分泌,导致免疫功能障碍引起肠道损伤;3)紧密连接蛋白(如Occludin 等)的表达降低,肠道黏膜完整性受损。活性多糖如短双歧杆菌的胞外多糖、海藻酸盐可通过其自身的黏附性附着在肠道表面,有效阻止过敏原进一步入侵[37-38]。Ying 等[38]研究表明,冬虫夏草多糖通过上调紧密连接蛋白并使JNK/p38 MAPK 通路失活性,保护肠道物理屏障损伤。灵芝多糖具有潜在的抗敏作用,可以通过逆转杯状细胞数量,上调紧密连接蛋白如ZO-1、Occludin 和Claudin-1 来增强免疫[39]。阿哈奇蜂蜜多糖AH 可以通过直接诱导肠上皮细胞表达pIgR 蛋白或刺激DCs 产生更多的CCL20 招募DCs 并分泌细胞因子增加sIgA 分泌来恢复肠道免疫[40]。
3.2 调节肠道菌群结构
研究表明肠道菌群的变化可能先于机体过敏症状的发生,因此调节肠道菌群可能是预防机体过敏的源头[41]。目前活性多糖调节肠道菌群来缓解机体过敏主要通过2 种方式进行。
3.2.1 作为益生元,调节肠道菌群的结构来缓解过敏 肠道菌群的变化会使机体发生食物过敏的潜在可能性增加,而活性多糖具有调节体内益生菌的功效,这种调节作用在一定程度上可延缓机体过敏的发生[42]。有研究表明2.5%的黄芪多糖可提高鼠李糖乳杆菌在胃肠道中的耐受性,使其得到最大程度的增殖,该微生物的增殖可使小鼠肠道大肠杆菌和类杆菌明显降低,双歧杆菌和乳酸杆菌明显增高,使卵清蛋白引起的食物过敏症状得到有效改善[43-44]。崔芳等[45]的研究指出过敏性哮喘小鼠经枸杞多糖干预后肠道乳酸杆菌和双歧杆菌比例的增加,放线菌门、疣微菌门、拟杆菌门和厚壁菌门比例的提高,其哮喘症状得到了改善。Liu 等[46]的研究指出解聚硫酸多糖可增加益生菌(如乳酸菌科、双歧杆菌科和普雷沃氏杆菌科等)的丰富,降低了致病菌(如螺杆菌科和脱硫弧菌科等)的丰度以维持肠道稳态,使空肠绒毛修复,过敏症状减轻。
3.2.2 通过被体内肠道菌群降解产生短链脂肪酸发挥其调节菌群结构的作用来缓解过敏 枸杞多糖、黄芪多糖、香菇多糖等活性多糖均能被肠道菌群降解为短链脂肪酸,主要成分为乙酸、丙酸、正丁酸,它们可使肠道形成一个微酸环境,抑制有害菌的繁殖,促进有益菌的生长[47]。此外,生成的短链脂肪酸积累到一定程度还可通过干预肠上皮的氧耗稳定HIF 的表达、抗菌肽和特异性黏蛋白MUC2 的分泌调节肠道细菌定植的方式来保护肠道屏障,维持机体健康[48-50]。抗菌肽如:α-防御素、β-防御素和HNP-1 等与某些细菌的膜结合时还具有杀菌作用[51]。真菌多糖还可通过上调CAZymes基因的表达,增加短链脂肪酸的产量,从而在机体内形成一个循环[52]。
3.3 调节免疫细胞
机体免疫力的调节主要通过分泌的细胞因子进行,与食物过敏相关的细胞因子主要由以下几种细胞分泌:巨噬细胞、DC 细胞、T 细胞、B 细胞、肥大细胞、嗜碱性粒细胞[53]。活性多糖可通过直接或间接作用来调节细胞因子的分泌,进而影响机体的免疫。
3.3.1 活性多糖与巨噬细胞 巨噬细胞与中性粒细胞一起,是继上皮屏障之后的宿主防御的第一道防线。大量研究表明巨噬细胞是多糖的重要靶细胞,具有抗敏或潜在抗敏功效的活性多糖如白花前胡多糖、茯苓多糖可通过与巨噬细胞表面Toll 样受体(TLR2、TLR3、TLR4)、3 型补体受体(CR3)、甘露糖受体(MR)等结合触发多种不同的细胞内信号通路(MAPK、NF-κB、PI3K/AK、JAk-STAT、Ca2+/PKC/p38/NF-κB 等),促进细胞因子(TNF-α、IL-6、IL-1β 等)和趋化因子(CCL2、CXCL10 等)的分泌来进行免疫调节[54-55]。因此,活性多糖可通过激活巨噬细胞并刺激其分泌细胞因子来缓解或预防机体过敏。巨噬细胞释放的这些炎症因子又可作用于自身,调节巨噬细胞的极化方向。巨噬细胞可极化为M1、M2 两种,鲍辉[56]的研究表明邻苯二甲酸二(2-乙基己基)酯可促进巨噬细胞M2 极化加重过敏性性哮喘。具有抗敏功效的黄芪多糖可通过Notch 信号通路诱导巨噬细胞向M1 表型极化,而白花前胡多糖既能显著诱导RAW264.7 细胞中M1 炎症介质(诱导型一氧化氮合酶iNOS 和PTGS2),又能显著诱导M2 细胞因子(IL-10)和趋化因子(CXCL2)的表达,因此其可使巨噬细胞向M1 和M2 表型极化平衡。山葵果多糖2 促进了M2 型巨噬细胞的极化,苹果多糖可以在结肠炎发生发展阶段将M2 巨噬细胞转变为M1 表型[55,57-59]。因此,活性多糖对过敏机体巨噬细胞极化方向的调节与多糖组成、结构有关,且机体所处的病理状态也影响了巨噬细胞的极化方向。根据其极化状态与抗炎、促炎的关联性推测处于致敏阶段的巨噬细胞以M1 形式存在,处于激发阶段的巨噬细胞以M2 极化形式存在。此外,活性多糖还可通过抑制细胞内Ca2+的过度释放,调节雷帕霉素靶蛋白(Mammalian target of rapamycin,mTOR)对巨噬细胞进行保护[60-61]。
3.3.2 活性多糖与DC 细胞 DC 是先天免疫和获得性免疫之间的桥梁,是免疫反应的发起者和调节剂。未成熟的DC 具有捕获抗原的能力,一旦被炎症刺激或感染因子激活,树突状细胞就会经历成熟对抗原进行加工处理和提呈。树突细胞成熟的表型有CD80、CD86、CD83、CD40、MHC II等,产生的细胞因子有IL-1、IL-10、IL-12、IL-23、IL-27 和TNF-α 等[62]。有学者指出过敏体质免疫“亚稳态” 可能与DC 成熟机制及其功能失常有关,对表观遗传的调节决定了DC 成熟过程和成熟机制[63]。因此,活性多糖可通过对树突细胞的表观遗传进行调节,从而刺激树突细胞的成熟并分泌相关因子以缓解或预防机体过敏。目前研究表明具有抗敏功效的活性多糖如:枸杞多糖、黄芪多糖、灵芝多糖等可使DC 细胞MHC II、CD80 和CD86 这3 种膜分子的表达显著上调,提高DC 中IL-12p40 和TNF-α 的分泌,激活其吞噬抗原的能力,活性多糖对DCs 细胞的激活可能是通过调节TLR4-MyD88-NF-κB 信号通路、Toll 样受体的表达、NF-κB、PI3K/Akt 通路等实现的[64-66]。有些活性多糖如:长链芽孢杆菌EPS 在对人类MDDC 免疫反应的调节中,虽不会诱导促炎细胞因子分泌,但可刺激人MDDCs 分泌嗜酸性粒细胞和Th2 细胞因子减少所必需的IL-10[67]。
3.3.3 活性多糖与T 细胞和B 细胞 成熟的DC细胞将抗原传递给T 细胞后可诱导初始T 细胞分化为不同功能的细胞,它们在细胞因子的诱导下调节机体的免疫。Th1 细胞分泌的主要有INF-γ、INF-α、TNF-β、IL-2 等,其产生的分泌物对Th2的分泌具有抑制作用;Th2 主要分泌IL-4、IL-5、IL-6、IL-10、IL-13,它们可刺激B 淋巴细胞增殖并产生大量的IgE 和IgG 抗体。活性多糖对T 细胞的调节作用主要有以下3 种:1)调节Th1/Th2的动态平衡。海带多糖可通过降低Th2 细胞因子和增加Th1 细胞因子的表达,而被用于小鼠模型的过敏性哮喘的治疗[68]。紫菜多糖能够有效调节辅助性T 细胞的免疫功能向Th1 细胞转换,使Th1、Th2 细胞重新处于相对平衡状态,从而抑制Th2 细胞主导的食物过敏反应[22]。芦荟凝胶多糖可通过增加食物过敏小鼠IL-10 的产生和1 型调节性T 细胞(Type 1 regulatory T cells,Tr1)的数量来抑制脾脏和肠系膜淋巴结中Th2 细胞的数量[23]。牡蛎来源的多糖(OPS)显著增强了抗原刺激的脾细胞中T-bet 的表达,降低GATA-3 的表达,调节T 辅助细胞(Th1/Th2)免疫平衡,使其向Th1主导方向发展,从而显著减轻了过敏原引起的腹泻的发生[34]。2)调节Th17 和Treg 的平衡。正常机体Th17/Treg 处于平衡状态,当机体发生过敏时,Treg 相关转录因子Foxp3 表达量会降低,而Th17相关细胞因子会显著增加,其平衡被打破[69]。研究表明活性多糖,如:灵芝多糖、芦荟多糖、金银花多糖等可通过提高Th17 相关细胞因子IL-17A 和IL-6 的表达、RORγt 和STAT3 的转录水平以及STAT3 的磷酸化水平,增加Treg 相关细胞因子TGF-β1、IL-10 和转录因子Foxp3 的表达,使Th17/Treg 恢复平衡来发挥其缓解机体与过敏相关疾病的作用[70-72]。3)抑制原代T 细胞的增值。沙棘多糖可通过抑制PMA/离子霉素作用于T 细胞来降低T 细胞的增值,显著抑制IL-2、TNF-ɑ 和TNF-γ mRNA 的表达,进而缓解皮肤过敏症状[73]。
活性多糖对B 细胞的调节作用可通过阻断B细胞的激活以及抑制B 细胞中IgE 的生成和类别转换来起作用。过敏机体腹腔注射岩藻依聚糖可抑制机体IgE 产生,防止了Cε 生殖细胞的转录和NF-κB p52 在B 细胞的迁转[74]。Lee 等[23]的研究表明芦荟多糖可通过增加IL-10 的分泌抑制Th2 细胞,从而阻断B 细胞的激活。岩藻多糖可能通过抑制NF-κB p52 通路对被IL-4 和CD40 激活诱导的B 细胞IgE 的生成和类别转换来起抑制作用,并进一步指出其可能对IgE 引起和/或加重的疾病具有保护作用[75]。
3.3.4 活性多糖与肥大细胞和嗜碱性粒细胞 活性多糖对肥大细胞和嗜碱性粒细胞的作用主要是通过抑制细胞的脱颗粒、相关酶的活性、调节钙离子的浓度等途径进行作用。紫菜多糖在过敏机体内可抑制大鼠嗜碱性粒细胞、骨髓来源肥大细胞的脱颗粒及组胺释放来发挥抗敏作用,而对肥大细胞的凋亡无明显的影响[76]。白鲜皮多糖可通过抑制β-氨基己糖甘氨酶的方式发挥其抗过敏作用[77]。Mao 等[78]的研究表明当归多糖可显著降低组胺、β-己糖胺酶、白细胞三烯C4(LTC4)、IL-1、IL-4、TNF-α、IL-6、人单核细胞趋化蛋白-1(MCP-1/CCL2)的释放,并指出当归多糖通过下调炎症通路中的相关细胞因子和蛋白,以及Gab2/PI3-K/Akt 和Fyn/Syk 通路中的必需蛋白来对肥大细胞的激活进行抑制,而肥大细胞脱颗粒是食物过敏以及其它过敏反应中一个基本的病理生理反应,是评价食物过敏的标志之一。此外,活性多糖还可通过物理、化学、生物等手段提高或赋予活性多糖抗敏性。龙须菜硫酸多糖是一种潜在的预防食物过敏的功能性成分,在过敏机体中它可抑制肥大细胞的脱颗粒,降低组胺和β-己糖胺酶的释放,还可通过抑制p38 丝裂原活化蛋白激酶(MAPK)来抑制KU812 的激活,而当它经脱硫后这种能力将会丧失[33]。
4 结语
目前对活性多糖抗过敏功效的研究大多基于一些已知的途径,如,调节肠道屏障的通透性和肠道菌群的紊乱,刺激免疫细胞的活化,调节促炎因子、抗炎因子、趋化因子的分泌水平等。这些研究多是基于小型动物或体外细胞进行的,缺乏对提取的多糖进行体外细胞毒性评估,且由于所建立的动物/细胞模型不能再现体内的生理状态,因此实验结果外推到人比较难于实现。近年来,虽然有大量的研究表明活性多糖具有抗敏功效或抗敏的潜力,但对活性多糖干预过敏机制的具体调节的认识仍具有一定的不足。在肠道黏膜屏障方面,TNF-α 虽可通过下调紧密连接蛋白的表达来影响上皮通透性,但其对肠道胃黏液和黏液分泌的影响尚未被广泛研究;有研究指出花生过敏小鼠肠道中存在部IgE 同种型转换的可能性,但目前尚不清楚是什么诱使宿主在肠道内经历从IgA 或IgG 到IgE 的类开关DNA 重组(CSR);大多数多糖虽可以代谢成短链脂肪酸,但由于肠道菌群产生的其它分子也可能参与了过敏的治疗,因此,其抗敏功效与短链脂肪酸是否相关仍待进一步研究。在细胞免疫调节方面,具有抗敏潜力的各种活性多糖对巨噬细胞极化方向的调节存在差异,产生差异的原因及炎症因子对其极化方向的调节机制目前尚不明确。最新研究发现肥大细胞和感觉神经元存在相互作用,机体在发生过敏前期过敏原可能通过对TRPV1+Tac1+伤害感受器-MrgprB2+肥大细胞感觉簇的激活调控2 型免疫进行免疫调节,目前尚未发现存在关于活性多糖对其调节作用的研究。因此,将来可通过多组学联合使用的途径去探究活性多糖对共生微生物-黏蛋白、肥大细胞-神经元等的调节,为过敏性疾病或与过敏性相关的疾病的治疗寻找新的靶点。

