血栓通注射液对急性脑梗死患者脑血流动力学及血清学指标的影响
王广军,纵 锋,王忠全,刘 娜,程 建,祁昌翠,秦文敏
(1.徐州市第三人民医院神经内科,江苏 徐州 221005;2.新疆自治区伊犁州奎屯医院神经内科,新疆 伊犁 833200;3.新疆自治区伊犁州奎屯医院中医科,新疆 伊犁 833200)
急性脑梗死主要由局部脑组织血液循环障碍所致,易引起脑组织缺血性坏死而损伤患者神经功能,严重影响患者健康及生活质量[1-2]。目前,临床治疗急性脑梗死多采用常规西医治疗,其中阿司匹林肠溶片、硫酸氢氯吡格雷片、阿托伐他汀钙片、丁苯酞氯化钠注射液可起到抗血小板聚集、调脂、稳定斑块、改善脑微循环等作用,可在一定程度上促进患者症状改善,但远期疗效仍不够理想[3]。中医将急性脑梗死归于“中风”范畴,认为气血阻滞、经络不通为该疾病主要发病病机,故中医治疗应以化瘀活血、通经活络为主[4]。血栓通注射液是一种中药制剂,三七总皂苷为其主要活性成分,主要提取自中药三七,具有是祛瘀活血、通脉活络的良好功效[5]。但目前关于血栓通注射液对急性脑梗死患者脑血流动力学及血清学指标的影响仍需探究。基于此,本研究以急性脑梗死患者为对象进行研究,旨在进一步探索血栓通注射液在急性脑梗死患者治疗中的效果。
1 资料与方法
1.1 一般资料
将160例2022年1月—12月伊犁州奎屯医院神经内科收治的急性脑梗死患者随机纳入对照组和试验组,各80例。经脱落或剔除后纳入120例患者进行研究,其中对照组50例、试验组70例。对照组中男28例,女22例;年龄54~75岁,平均(65.12±3.21)岁;体质量指数(BMI)19~25 kg·m-2,平均(22.49±0.67) kg·m-2;病程3~10 d,平均(6.48±1.25)年;梗死部位:额叶10例,顶叶16例,基底节24例。试验组中男37例,女33例;年龄56~78岁,平均(65.17±3.25)岁;BMI 19~25 kg·m-2,平均(22.52±0.70) kg·m-2;病程3~12 d,平均(6.51±1.28)年;梗死部位:额叶16例,顶叶25例,基底节29例。2组的性别、年龄、BMI、病程、梗死部位等一般资料比较,差异无统计学意义(P>0.05)。具有可比性。本研究经伊犁州奎屯医院伦理委员会批准(伦理批号:202306)
1.2 纳入、排除、脱落与剔除标准
1.2.1 纳入标准 1)西医诊断参考《中国急性缺血性脑卒中诊治指南2018》[6],包括起病急,病程在2周内,经颅脑电子计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)诊断显示有缺血性低密度影,伴有局灶性神经缺损症状等;2)中医诊断标准参考《中风病诊断与疗效评定标准(试行)》[7]中的风痰瘀阻证,包括:①主症:口舌歪斜,半身不遂,感觉减退或消失,言语謇涩或不语;②次症:痰多而黏,头晕目眩;③舌脉象:舌暗淡、苔薄白或白腻,脉弦滑;3)首次发病者;4)发病至就诊时间<72 h者;5)治疗依从性良好者;6)对本研究知情同意者等。
1.2.2 排除标准 1)对本研究药物存在相关禁忌者;2)并发脑出血或短暂性脑缺血发作者;3)既往伴有头颅创伤史及手术史者;4)伴有严重恶性肿瘤者;5)合并智力障碍及感觉性失认症者;6)伴有重要脏器功能不全者等。
1.2.3 脱落与剔除标准 1)未按规定用药或违反治疗方案者;2)急性发病4.5 h内,在溶栓治疗时间窗内给予注射用阿替普酶静脉溶栓治疗者;3)治疗期间发生严重不良反应者;4)中途退出研究者等。
1.3 治疗方法
1.3.1 对照组 给予西医常规治疗,包括抗血小板聚集、稳定斑块、调节血脂、改善侧支循环、清除氧自由基等。口服阿司匹林肠溶片(100 mg,国药准字HJ20160684,Bayer HealthCare Manufacturing S.r.l.),每次200 mg,每日1次,治疗1周后将剂量调整为每次100 mg;口服硫酸氢氯吡格雷片(75 mg,国药准字H20193160,石药集团欧意药业有限公司),每次75 mg,每日1次;口服阿托伐他汀钙片(20 mg,国药准字HJ20170216,Pfizer Pharmaceuticals LLC),每次20 mg,每日1次;静脉滴注丁苯酞氯化钠注射液[100 mL(丁苯酞25 mg与氯化钠0.9 g),石药集团恩必普药业有限公司,国药准字H20100041],每次100 mL,每日2次,共治疗2周。
1.3.2 试验组 在对照组基础上给予血栓通注射液[注射用血栓通(冻干)每支150 mg,国药准字Z45021769,广西梧州制药(集团)股份有限公司]进行治疗,取450 mg血栓通注射液加至250 mL生理盐水中静脉滴注,每日1次,共治疗2周。
1.4 观察指标
1.4.1 临床疗效 治疗2周后参考《脑卒中患者临床神经功能缺损程度评分标准(1995)》[8],根据美国国立卫生院神经功能缺损评分(National Institutes of Health Stroke Scale,NIHSS)评估2组临床疗效,NIHSS总分范围0~42分,得分高低与患者神经功能缺损程度呈正比。其中患者症状消失,NIHSS评分降低>90%以上评估为基本治愈;患者症状显著缓解,NIHSS评分降低46%~90%评估为显著进步;患者症状有所缓解,NIHSS评分降低18%~45%评估为进步;患者症状无缓解,NIHSS评分降低<18%评估为无效。总有效率(%)= 1-无效率(%)。
1.4.2 神经功能及自理能力 治疗前和治疗2周后用NIHSS评分评估2组神经功能缺损程度,NIHSS总分范围0~42分,得分高低与患者神经功能缺损程度呈正比;用改良Rankin量表(Modified Rankin Scale,mRS)[9]评估2组神经功能恢复情况,mRS总分范围0~5分,得分高低与患者神经功能恢复情况呈反比;用日常生活活动能力(activities of daily living,ADL)[10]评分评估2组自理能力,ADL总分范围0~100分,得分高低与患者自理能力呈正比。
1.4.3 脑血流动力学 治疗前和治疗2周后用脑血管血液动力学监测仪(型号:CVHD-3000型,上海聚慕医疗器械有限公司)检测2组左侧颈总动脉平均血流速率(velocity mean,Vm)、平均血流量(qmean,Qm)、动态阻力(dynamic resistance,DR)、外周阻力(peripheral resistance,Rv)。
1.4.4 血清学指标 治疗前和治疗2周后采集2组空腹静脉血3 mL,按照离心半径8 cm、时间10 min、速率3 000 r·min-1的条件进行离心处理后取血清用酶联免疫吸附试验测定血清钙结合蛋白β(calcium binding protein β,S-100β)、神经元特异性烯醇化酶(neuron specific enolase,NSE)、单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)、同型半胱氨酸(homocysteine,Hcy)水平,试剂盒均购自美国贝克曼库尔特有限公司。
1.4.5 不良反应 记录2组治疗期间出现的头晕、腹部不适、恶心等情况。
1.5 统计学方法
使用SPSS 26.0软件分析数据,计数资料采用χ2检验进行组间比较,以例(%)表示;计量资料采用t检验,以均数±标准差(±s)表示。以P<0.05为差异有统计学意义。
2 结果
2.1 2组临床疗效比较
见表1。

表1 2组临床疗效比较 例
2.2 2组治疗前与治疗2周后神经功能及自理能力比较
见表2。
表2 2组治疗前与治疗2周后神经功能及自理能力比较(±s ) 分

表2 2组治疗前与治疗2周后神经功能及自理能力比较(±s ) 分
注:与对照组比较,# P<0.05;与治疗前比较,△P<0.05
组别例数时间NIHSSmRSADL试验组70治疗前16.98±2.543.35±0.3952.41±6.18治疗2周后 6.12±0.73#△0.76±0.12#△84.45±8.54#△对照组50治疗前17.03±2.453.39±0.4252.34±6.21治疗2周后10.45±1.16△1.24±0.25△70.09±6.39△
2.3 2组治疗前与治疗2周后脑血流动力学比较
见表3。
表3 2组治疗前与治疗2周后脑血流动力学比较(±s )

表3 2组治疗前与治疗2周后脑血流动力学比较(±s )
注:与对照组比较,# P<0.05;与治疗前比较,△P<0.05
组别例数时间Vm/(cm·s-1)Qm/(cm3·s-1)DR/kPaRv/(kPa·s-1·m-1)试验组70治疗前13.98±2.61 5.09±1.4254.03±5.62114.92±27.54治疗2周后25.43±5.29#△11.21±2.56#△31.56±2.59#△ 82.13±15.36#△对照组50治疗前14.03±2.56 5.12±1.3453.98±5.79115.07±26.85治疗2周后19.12±3.37△ 8.54±1.62△45.23±4.48△ 99.12±18.75△
2.4 2组治疗前与治疗2周后血清学指标比较
见表4。
表4 2组治疗前与治疗2周后血清学指标比较(±s)
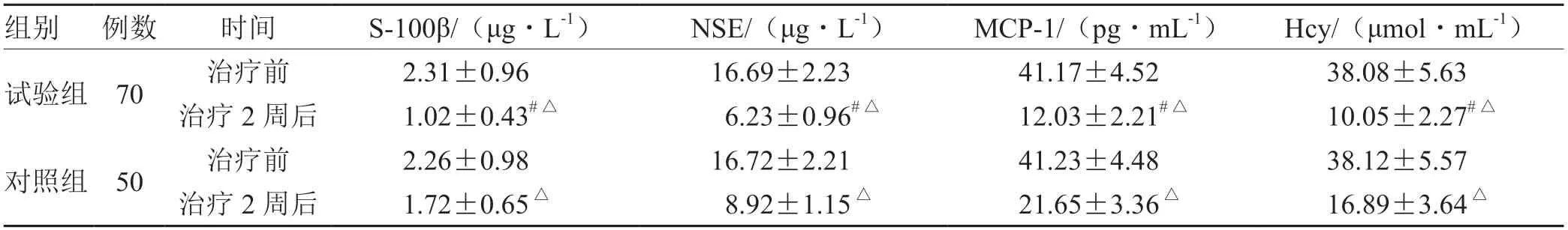
表4 2组治疗前与治疗2周后血清学指标比较(±s)
注:与对照组比较,# P<0.05;与治疗前比较,△P<0.05
组别例数时间S-100β/(μg·L-1)NSE/(μg·L-1)MCP-1/(pg·mL-1)Hcy/(μmol·mL-1)试验组70治疗前2.31±0.9616.69±2.2341.17±4.5238.08±5.63治疗2周后1.02±0.43#△ 6.23±0.96#△12.03±2.21#△10.05±2.27#△对照组50治疗前2.26±0.9816.72±2.2141.23±4.4838.12±5.57治疗2周后1.72±0.65△ 8.92±1.15△21.65±3.36△16.89±3.64△
2.5 2组不良反应发生率比较
试验组治疗期间的不良反应总发生率与对照组比较,差异无统计学意义(P>0.05)。见表5。
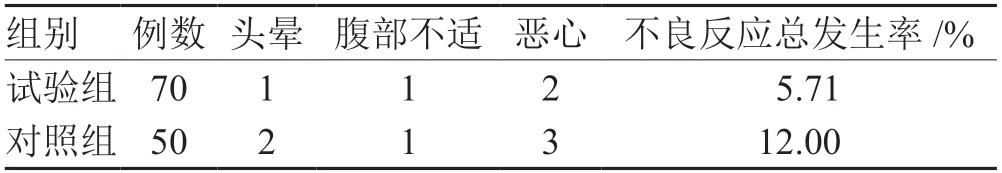
表5 2组不良反应发生率比较 例
3 讨论
近年来,据临床相关调查数据显示,急性脑梗死的发病率、致残率和病死率呈一定的上升趋势[11-12]。现阶段,临床予以阿司匹林肠溶片、硫酸氢氯吡格雷片、阿托伐他汀钙片、丁苯酞氯化钠注射液等常规西医治疗虽可改善急性脑梗死患者脑微循环,但长期使用可能产生耐药性[13]。因此,探索一种更为有效的治疗方案,以进一步提高急性脑梗死患者的疗效和促进患者预后的改善尤为关键。本研究探索血栓通注射液对急性脑梗死患者脑血流动力学及血清学指标的影响,取得了较好的结果。
急性脑梗死属中医“中风”“偏枯”“中经络”等范畴,《医学纲目》中指出:“脉道不利,气血闭塞也”,《黄帝内经》中记载:“中风”与风、痰、火、气、血等有关[14]。瘀血阻络,筋脉受损,气血逆乱而致脏腑功能失调,加之患者气血亏虚,若忧思恼怒、劳倦内伤,则易发生脑脉痹阻,因此中医治疗急性脑梗死应以化瘀活血、通经活络为主[15]。血栓通注射液的主要成分为三七总皂苷,而三七总皂苷主要提取自中药三七,三七具有活血祛瘀、通脉活络的良好功效,可促进机体瘀血消散,改善临床症状[16]。本研究中与对照组比较,试验组治疗2周后的NIHSS、mRS评分更低,ADL评分及总有效率更高,提示血栓通注射液可改善急性脑梗死患者神经功能和自理能力,提高临床疗效,与既往研究[17]报道基本相符。
急性脑梗死患者的病情进展过程中多伴有不同程度的脑血流动力学紊乱、神经损伤及炎症反应。S-100β是一种主要存在于神经胶质细胞中的指标,可反映机体神经功能情况;NSE是一种存在于神经组织中的烯醇化酶,其水平变化与机体神经功能有关。MCP-1是一种由星形胶质细胞分泌的促进炎症的蛋白质,其可反映机体炎症状态;Hcy是一种含硫氨基酸,其水平变化与机体炎症病变程度有关[18-20]。本研究结果显示,试验组治疗2周后的左侧颈总动脉DR、Rv及血清S-100β、NSE、MCP-1、Hcy水平低于对照组,而左侧颈总动脉Vm、Qm高于对照组,进一步说明血栓通注射液可明显改善急性脑梗死患者脑血流动力学,调节血清学指标水平变化,进而有助于促进患者神经功能及炎症反应的改善。现代药理研究[21-22]证明,血栓通注射液中的主要成分三七总皂苷具有抑制血小板聚集、预防血栓形成的作用,可有效减少神经细胞的坏死,发挥脑保护作用,进而有利于改善机体脑血流动力学及神经功能;且三七总皂苷能够有效抑制缺血半暗带氧自由基的形成,改善缺血再灌注损伤,进而有利于减轻机体炎症。另本研究结果显示,试验组治疗期间的不良反应总发生率与对照组比较,差异无统计学意义,表明血栓通注射液治疗急性脑梗死并未明显增加患者的不良反应,考虑其原因可能与该药为中药制剂,在有效发挥改善患者机体神经功能的同时对患者的刺激性较小有关。

