CTA结合临床特征预测中高海拔地区伴头颈部动脉粥样硬化的TIA患者脑梗死风险研究
杨林,张永海,谢录玲,谢春,郎小梅,王润强
目的 基于头颈部CTA结合临床特征,探讨中高海拔地区伴头颈部动脉粥样硬化的TIA患者1年内发生脑梗死的危险因素,并构建风险预测模型,评价其预测效能。
方法 采用回顾性分析,连续纳入2018年1月—2021年9月青海省第五人民医院收治的TIA患者(居住海拔2000~3000 m),所有患者均经头颈部CTA证实存在动脉粥样硬化斑块。随访1年,根据是否发生脑梗死分为未梗死组与梗死组。首先对两组患者的临床资料和头颈部CTA检查结果进行单因素分析,筛选出有意义的变量,再通过多因素logistic回归分析脑梗死的独立影响因素,构建TIA后1年内发生脑梗死的风险预测模型以绘制ROC曲线。
结果 初步纳入患者111例。随访中出现9例失访,1例于外院放置颈动脉支架,1例发生硬膜下血肿,均不符合最终的纳入标准。最终纳入100例患者,其中梗死组26例,未梗死组74例。单因素分析显示梗死组ABCD2评分高于未梗死组[4.00(3.75~5.00)分 vs. 3.00(2.00~4.00)分,P=0.004];梗死组高血压分级>1级(69.23% vs. 41.89%,P=0.022)、具不稳定斑块(88.46% vs. 67.57%,P=0.039)、血管中重度狭窄(53.85% vs. 12.16%,P<0.001)和不稳定斑块累及血管数>1支(69.23% vs. 31.08%,P=0.001)的患者比例高于未梗死组,以上差异均有统计学意义。logistic回归分析显示,高血压分级>1级、ABCD2评分偏高及血管中重度狭窄是TIA后1年内发生脑梗死的独立危险因素,其风险预测模型为:P=1/[1+exp(-4.782+1.407×高血压分级+0.574×ABCD2评分+2.734×血管狭窄程度)]。该模型预测脑梗死的AUC为0.848(95%CI 0.763~0.933),敏感度为92.31%,特异度为70.27%。
结论 高血压分级>1级、ABCD2评分偏高及血管中重度狭窄是中高海拔地区伴头颈部动脉粥样硬化的TIA患者1年内发生脑梗死的危险因素,三者联合构建的预测模型对脑梗死有良好的预测价值。
TIA是脑梗死发生的重要预测因子。研究显示,23%的脑梗死患者在发病前会出现TIA,TIA后2、7、90 d内脑梗死发生风险分别为3%~10%、5%~12.8%、10.5%~17.0%[1-3]。TIA与脑梗死危险因素相似,如吸烟、饮酒、高血压、高血脂、糖尿病、头颈部动脉粥样硬化等,其中头颈部动脉粥样硬化是脑梗死最常见的危险因素之一。因此,在临床中应特别注意伴有头颈部动脉粥样硬化TIA患者的脑梗死风险。高原地理环境特殊,居民的TIA发病率高于平原,但生活在中高海拔地区居民因受到缺氧引发的生理适应保护,脑梗死发病率低于平原地区的居民[4-5]。中高海拔地区居民的血管危险因素、TIA/脑梗死患者动脉粥样硬化特征与平原不同,其高风险斑块特征的患病率更低[6-7]。因此,本研究推测中高海拔地区伴头颈部动脉粥样硬化的TIA患者发生脑梗死的独立危险因素可能与平原不同。目前临床普遍应用ABCD2评分量化TIA患者脑梗死风险,但其预测效能仅为中等[8]。已有多项研究试图将ABCD2评分与其他实验室或影像学指标结合以提高其预测能力,但因实验结果的多样性或操作的复杂性未能被普及[9]。为此,本研究应用头颈部CTA结合临床特征探讨中高海拔地区伴头颈部动脉粥样硬化的TIA患者1年内发生脑梗死的危险因素,并构建相应的风险预测模型,为临床早期预防及干预提供参考。
1 对象与方法
1.1 研究对象 连续纳入2018年1月—2021年9月青海省第五人民医院收治的TIA患者进行回顾性研究。
纳入标准:①符合TIA诊断标准[10],发病72 h内就诊;②年龄>40岁,居住青海省(海拔2000~3000 m)5年以上,且随访期间未长时间(>7 d)离开居住地;③入院首次头颅影像学检查(CT/MRI)无急性脑梗死病灶;④经头颈部CTA检查,结果提示目标血管(包括主动脉弓上缘、头臂干、锁骨下动脉起始段、颈总动脉、颈内动脉、大脑中动脉M1—M3段、前交通动脉、大脑前动脉A1—A3段、后交通动脉、大脑后动脉P1—P3段、椎-基底动脉)动脉粥样硬化斑块形成;⑤有1年随访结果,且本次TIA后1年内未进行头颈血管支架治疗;⑥病历资料完整。
排除标准:①既往出血性或缺血性卒中病史、头颈部血管畸形;②合并脑积水、颅内感染、颅内肿瘤;③冠状动脉支架置入或心脏起搏器安装术后;④脑外伤、手术史;⑤严重心脏、肝脏、肾脏功能障碍等;⑥合并肺炎、泌尿系统感染等感染性疾病;⑦CTA影像结果欠佳。
1.2 相关资料收集 收集患者以下临床资料:①人口学资料(性别、年龄、当前吸烟、当前饮酒);②脑梗死家族史;③既往史(心房颤动、糖尿病、高脂血症、高血压及高血压分级);④临床TIA早期脑梗死预测工具(ABCD2评分);⑤实验室指标(红细胞计数、红细胞压积、血小板计数、血小板压积、白细胞计数、中性粒细胞/淋巴细胞、TC、TG、LDL-C、HDL-C、Hcy)。
头颈部CTA判读指标:(最严重)血管狭窄程度、斑块性质、不稳定斑块累及血管数。
绝大部分患者一般资料由首次住院病历资料获得,少数资料不完善者由随访询问获得。心房颤动由心电图检查确诊,高血压、糖尿病、高血脂病史指既往已确诊或住院期间确诊;脑梗死家族史仅包括直系亲属。ABCD2评分由神经内科医师采用Johnston等[11]提出的7分法进行评分,高血压分级根据《中国高血压防治指南(2018年修订版)》[12]进行分级。所有实验室指标均由入院48 h内的肘正中静脉血获得。
1.3 方法 CTA检查方法均按照以下标准执行:采用GE 256排CT,患者取仰卧位,主动脉弓设为感兴趣区。通过双筒高压注射器,自上肢静脉注入20~30 mL生理盐水;随后注入碘海醇1.5 mL/kg,采用阈值触发技术(150 Hu),触发后延迟3 s扫描;最后注入30~40 mL生理盐水,注入速度均为5.0 mL/s。扫描参数:管电压120 kV、管电流150~400 mA(smart mA技术)、探测器宽度80 mm、螺距0.992∶1、矩阵512×512、重建层厚0.625 mm,ASiR-V 60%。CTA扫描范围为主动脉弓上缘至颅顶。由两名影像科医师根据患者首次住院CTA结果对颈动脉、颅内动脉粥样硬化情况进行再评估。
评估指标包括:①血管狭窄程度=(1-最窄部分的腔内径/近端正常管腔直径)×100%;颈动脉,0为无明显狭窄,1%~49%为轻度狭窄,50%~69%为中度狭窄,70%~99%为重度狭窄,100%为血管闭塞[13];颅内动脉,0为无明显狭窄,1%~29%为轻度狭窄,30%~69%为中度狭窄,70%~99%为重度狭窄,100%为血管闭塞[14];记录头颈部CTA血管狭窄程度。②斑块性质:临床上常将斑块性质分为稳定斑块和不稳定斑块。斑块稳定性与斑块组成成分有关。钙化斑块属于稳定斑块;非钙化斑块和混合斑块与脑梗死关系密切,属于不稳定斑块。本研究中若目标血管内含不稳定斑块,则纳入不稳定斑块组,若目标血管仅含稳定斑块,则纳入稳定斑块组。③记录不稳定斑块累及的血管数目。
1.4 随访 通过住院、门诊病历或电话随访患者首次入院后1年内脑梗死发生情况。将1年内经影像学检查证实存在脑梗死的患者纳入梗死组,1年后经影像学证实未发生过脑梗死的患者纳入未梗死组。
1.5 统计方法 采用SPSS 21.0统计软件。计数资料以例数和率(%)表示,组间比较采用χ2检验或Fisher确切概率法。计量资料符合正态分布的以表示,组间比较采用独立样本t检验;不符合正态分布的以M(P25~P75)表示,组间比较采用非参数检验。以是否发生脑梗死作为因变量(赋值:无=0,是=1),将单因素分析中有意义的因素作为自变量纳入多因素logistic回归分析独立危险因素,并绘制ROC曲线,分别检测各项独立危险因素及其联合对1年内发生脑梗死的预测价值,斑块性质赋值:稳定斑块=0,不稳定斑块=1;头颈部CTA血管狭窄程度赋值:≤轻度狭窄=0,中重度狭窄=1;不稳定斑块累及血管数目赋值:≤1支=0,>1支=1。预测模型中,高血压分级赋值:≤1级=0,>1级=1;血管狭窄程度赋值:≤轻度狭窄=0,中重度狭窄=1。P<0.05为差异有统计学意义。
2 结果
初步纳入患者111名。随访中出现9例失访,1例已于院外放置颈动脉支架,1例发生硬膜下血肿,不符合最终的纳入标准。最终纳入100例患者,年龄(63.28±10.28)岁,男性72例(72%),其中未梗死组74例,梗死组26例。未梗死组男性57例,年龄(63.51±9.78)岁,当前吸烟26例,当前饮酒12例;梗死组男性15例,年龄(62.62±11.90)岁,当前吸烟5例,当前饮酒4例。
2.1 TIA患者未梗死组与梗死组临床资料比较 两组患者性别、年龄、当前吸烟、当前饮酒、脑梗死家族史、心房颤动病史、高血压病史、糖尿病病史、高血脂病史、实验室指标比较,差异均无统计学意义(P>0.05);但未梗死组ABCD2评分和高血压分级>1级的患者比例低于梗死组,差异有统计学意义(P<0.05)(表1)。

表1 TIA患者未梗死组与梗死组临床资料比较Table 1 Comparison of clinical data between non-infarction group and infarction group in TIA patients
2.2 TIA患者未梗死组与梗死组头颈部CTA联合影像资料比较 未梗死组具不稳定斑块、血管中重度狭窄及不稳定斑块累及血管数>1支的患者比例低于梗死组,差异有统计学意义(P<0.05)(表2)。
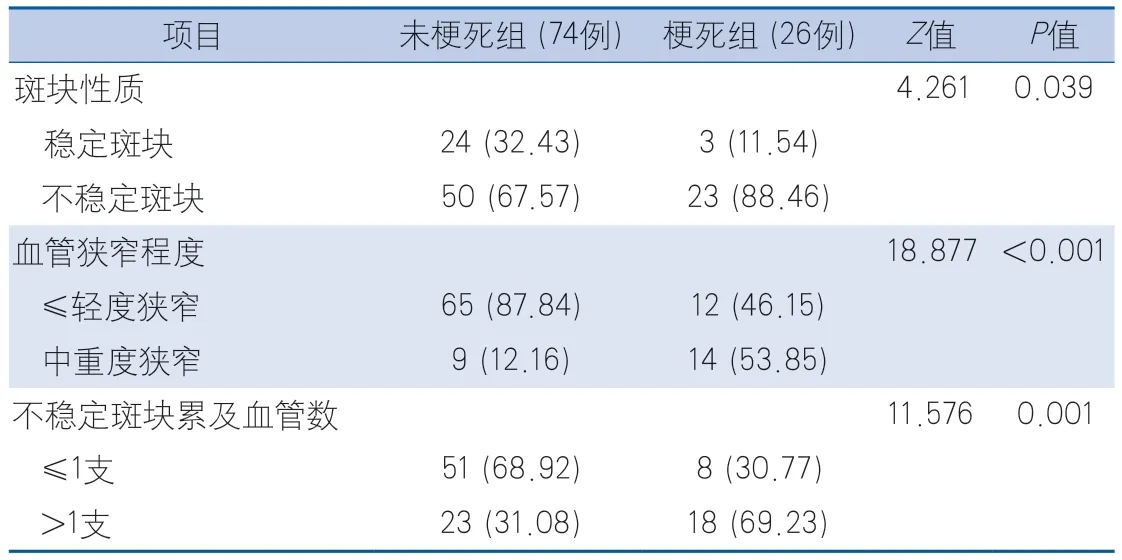
表2 TIA患者未梗死组与梗死组头颈部CTA动脉粥样硬化特征比较Table 2 Comparison of atherosclerotic characteristics of head and neck CTA between non-infarction group and infarction group in TIA patients
2.3 TIA患者未梗死组与梗死组多因素logistic回归分析结果 logistic回归分析结果显示,高血压分级>1级(OR4.084,95%CI1.180~14.137,P=0.026)、ABCD2评分偏高(OR1.775,95%CI1.107~2.847,P=0.017)、血管中重度狭窄(OR15.389,95%CI4.036~58.686,P<0.001)是TIA后1年内发生脑梗死的独立危险因素(表3)。中高海拔地区伴头颈部动脉粥样硬化的TIA患者1年内发生脑梗死的风险预测模型:P=1/[1+exp(-4.782+1.407×高血压分级+0.574×ABCD2评分+2.734×血管狭窄程度)]。Hosmer-Lemeshow拟合优度检验提示模型整体拟合良好(χ2=6.782,P=0.452)。

表3 TIA患者1年内发生脑梗死的多因素logistic回归分析Table 3 Multivariate logistic regression analysis of cerebral infarction in TIA patients within 1 year
2.4 高血压分级>1级、ABCD2评分偏高、血管中重度狭窄及三者联合预测中高海拔地区伴头颈部动脉粥样硬化TIA患者1年内发生脑梗死的效能分析 ROC结果显示,高血压分级>1级、ABCD2评分偏高、血管中重度狭窄对中高海拔TIA后1年内发生脑梗死均有一定的预测价值,但三者联合应用的预测价值更高、预测能力良好。单独应用高血压分级>1级、ABCD2评分偏高(最佳截断值为3.5分)、血管中重度狭窄以及三者联合预测的AUC分别为0.637(95%CI0.514~0.759)、0.683(95%CI0.571~0.796)、0.708(95%CI0.581~0.835)、0.848(95%CI0.763~0.933),敏感度分别为69.23%、76.92%、53.85%、92.31%,特异度分别为58.11%、56.76%、87.84%、70.27%(图1)。

图1 高血压分级>1级、ABCD2评分偏高、血管中重度狭窄预测脑梗死风险的ROC曲线Figure 1 ROC curve of hypertension grade>1, high ABCD2 score, moderate to severe stenosis of vascular predicted the risk of cerebral infarction
3 讨论
中高海拔地区地理环境特殊。久居中高海拔地区的人群可通过不断习服甚至是基因水平上的改变适应环境,同时其特殊的饮食习惯可能导致某些疾病的影响因素或特征有别于平原。研究证实,中高海拔地区居民的血管危险因素、动脉粥样硬化特征及脑梗死发生率与平原居民不同[5-7]。目前尚未见有关中高海拔地区伴头颈部动脉粥样硬化TIA患者发生脑梗死的危险因素的研究报道。因此,探讨中高海拔地区伴头颈部动脉粥样硬化TIA患者1年内发生脑梗死的危险因素,并建立风险预测模型,对中高海拔地区居民的脑梗死预防具有重要意义。
ABCD2评分量表在很长一段时间内推荐用于TIA患者分诊,但本研究单独应用ABCD2评分预测脑梗死的效能仅为中等,最佳截断值为3.5分,与相关文献报道结果一致[8,15]。究其原因,可能是由于ABCD2评分预测脑梗死主要是基于临床症状和病史,而忽略了患者潜在疾病因素如血管病变程度的影响。既往一项meta分析显示,在20%的ABCD2评分≤3分的TIA后卒中患者中,>50%的患者合并颈动脉狭窄或心房颤动[16]。本研究ABCD2评分≤3分的梗死患者中,5例(5/6)合并血管中重度狭窄,而ABCD2评分>3分的未梗死患者中,仅4例(4/32)合并血管中重度狭窄。
高血压是TIA和脑梗死发生的独立危险因素,同时也与TIA患者无症状腔隙性脑梗死独立相关[17-19]。高原高血压靶器官损伤发生率高于平原,可导致卒中风险增高[20-21]。平原地区有研究显示,高血压是TIA后发生脑梗死的独立危险因素[22-23]。高原高血压发病机制及患病率与平原不同。多数研究表明高原高血压患病率高于平原,且治疗和控制率较低[24]。本研究中,未梗死组与梗死组高血压患病率虽无差异,但高血压分级的差异具有统计学意义,高血压分级>1级是预测TIA后1年内发生脑梗死的独立危险因素。需要注意的是,高血压分级低并不一定代表着发生脑梗死的危险性低,同样需考虑其他因素的影响。本研究高血压分级≤1级的患者中,6例(6/8)合并血管中重度狭窄,而高血压分级>1级的未梗死患者中,仅2例(2/30)合并血管中重度狭窄。
头颈部动脉粥样硬化不稳定斑块或血管狭窄程度的进展可能会导致远端血管栓塞和脑组织灌注不足,是预测脑梗死风险的常用指标。既往国内平原地区有关脑梗死发生的血管因素分析中,不稳定斑块常被认为是最主要的危险因素,而血管狭窄程度则被认为与之关系相对较弱[25-27]。与平原地区的研究结果不同,本研究结果显示,相比斑块性质,血管狭窄程度是更能预测中高海拔地区伴头颈部动脉粥样硬化的TIA患者发生脑梗死的危险因素。一项关于高原与平原TIA或脑梗死患者颈动脉粥样硬化斑块特征比较的研究表明,高原环境具有抗动脉粥样硬化的作用,高原地区患者动脉高风险斑块的患病率低于平原地区患者[7]。因此,不稳定斑块可能并不是高原脑梗死发生最主要的危险因素。高原低氧环境可促进机体红细胞生成增多、血红蛋白浓度升高、血小板黏附和聚集性增强,血流阻力增大,使血液呈高凝状态,血氧饱和度降低[6]。由此推测,高原伴头颈部动脉狭窄的TIA患者可能比平原患者更易发生狭窄部位远端脑血流动力学损害和原位血栓形成,加重脑组织缺氧,导致脑梗死的发生。本研究中单独应用血管狭窄程度预测中高海拔地区伴头颈部动脉粥样硬化的TIA患者1年内发生脑梗死的效能良好。
由以上分析可知,TIA后是否发生脑梗死涉及多种因素,应用单一因素预测临床结局往往缺乏特异性。联合模型可根据患者个体特征匹配相应临床事件的发生概率进行综合分析,避免相关影响因素的丢失,可能有助于提高预测效能。因此,为更好地识别中高海拔地区脑梗死高危患者,本研究综合考虑以上3种危险因素,构建了联合风险预测模型。ROC结果显示,该模型预测能力良好且较单一指标具有更高的预测价值,能对不同风险人群进行更有效地区分。
综上所述,中高海拔地区伴头颈部动脉粥样硬化的TIA患者梗死组与未梗死组相比,在临床特征和动脉粥样硬化影像学表现方面的差异具有统计学意义。高血压分级>1级、ABCD2评分偏高、血管中重度狭窄是TIA后1年内发生脑梗死的独立危险因素,由此联合构建的模型具有良好的预测能力,AUC明显高于各因素单独应用,有利于脑梗死高危患者的识别,以便临床加强管理。且本预测模型包含的3项指标在急诊中均较易获得,方便实用,可作为急诊快速评估脑梗死风险的一种新方法。此外,本研究也存在一定的局限性,首先,CTA对密度的分辨率较低,在区分颅内细小动脉的斑块稳定性方面可能不够准确,对结果存在一定影响;其次,本研究为单中心研究,地域局限。今后需采用更先进的影像技术如高分辨率磁共振血管壁成像在不同海拔地区前瞻性纳入更多的病例进行随访,提高研究结果的准确性。
利益冲突所有作者均声明不存在利益冲突。

