系统性免疫炎症指数对急性缺血性卒中后抑郁的预测价值
罗冬,李国梁,温慧军,王军文
目的 探索系统性免疫炎症指数(systemic immune-inflammatory index,SII)与卒中后抑郁(post-stroke depression,PSD)的关系及SII对PSD的预测价值。
方法 连续纳入2019年2月—2021年2月在宝鸡市中心医院神经内科住院治疗的缺血性卒中患者,进行回顾性分析。根据发病30 d后HAMD-17评分分为PSD组和非PSD组。比较两组患者人口学特点、影像资料、临床基线数据、SII等信息,采用多因素logistic回归分析法来研究SII与PSD的关系。
结果 本研究共纳入307例患者,其中PSD组103例,非PSD组204例。PSD组患者的SII明显高于非PSD组[518.89×109/L(478.20×109/L~559.12×109/L)vs. 448.15×109/L(407.88×109/L~490.16×109/L),P<0.001]。PSD组患者HAMD-17评分与SII呈正相关(r=0.364,P<0.001)。多因素l o g i s t i c分析提示S I I增高是P S D发病的独立性危险因素(中间三分位数:OR 1.770,95%CI 1.325~2.364,P=0.003;较高三分位数:OR 2.472,95%CI 1.747~3.469,P=0.001)。ROC分析显示,SII预测PSD对应的AUC为0.765(95%CI 0.709~0.820,P<0.001),SII预测PSD的最佳临界值为478.18×109/L,此时敏感度为75.7%,特异度为67.6%。
结论 SII增高可能是PSD的独立性危险因素,对PSD有潜在的预测价值。
卒中是常见的高致残率、高致死率的疾病,给患者家庭和社会造成巨大的经济负担[1]。卒中后抑郁(post-stroke depression,PSD)是急性缺血性卒中(acute ischemic stroke,AIS)常见的严重后遗症之一,缺血性卒中比其他类型卒中更容易合并抑郁[2]。PSD严重影响卒中患者的认知功能、执行功能以及神经功能康复,导致患者生活质量下降[3],更重要的是其与卒中患者死亡率增加有密切关系[4]。因此临床工作中早期识别PSD对卒中康复至关重要。
近年来,神经炎症反应已成为PSD病理生理机制研究的热点。系统性免疫炎症指数(systemic immune-inflammatory index,SII)是一种由中性粒细胞、淋巴细胞和血小板计数构成的新型炎症生物标志物[5]。虽然目前SII预测心血管疾病、感染、炎症性疾病、肿瘤等的临床结局和预后广受关注,且有研究表明SII是预测AIS患者静脉溶栓后3个月临床预后的有效指标[6-9],但目前仍缺乏SII在PSD领域的相关研究。本研究在AIS患者中探索SII水平是否与PSD发生相关,以及SII对临床早期诊断PSD的预测作用。
1 资料和方法
1.1 研究对象 连续纳入2019年2月—2021年2月在宝鸡市中心医院神经内科接受治疗的缺血性卒中的患者。纳入标准:①年龄在18~80岁;②发病3 d内且首次诊断为AIS,诊断标准符合《中国急性缺血性脑卒中诊治指南2018》[10];③经CT、MRI检查有明确脑梗死病灶。排除标准:①卒中前诊断为抑郁、抑郁症状或既往有其他精神病史;②既往诊断为卒中认知功能障碍、痴呆、帕金森病或其他神经系统疾病;③严重失语、构音障碍、听力障碍或意识水平下降;④病情危重,预期寿命不到1个月(生命体征不平稳、严重意识障碍、发病时NIHSS评分≥25分、mRS评分≥5分);⑤有慢性炎症性疾病、肿瘤、血液系统疾病,有严重心脏、呼吸、肝脏、肾脏疾病;⑥随访中失访、退出或死亡。
1.2 临床资料收集 收集纳入患者的人口学资料,包括年龄、性别、教育水平(接受教育年限:文盲0年、小学≤6年、初中7~9年、高中或以上>9年)、BMI;血管危险因素,包括高血压、糖尿病、高脂血症、冠心病、心房颤动、吸烟史[11](日吸烟量≥1支,连续吸烟时长>1年或者戒烟时间短于1年);入院后24 h内行影像学检查(头颅CT或MRI),记录患者脑梗死主要病灶的部位,包括额叶、颞叶、顶叶、枕叶、基底节区、脑干、小脑(若病灶累及多部位,以梗死范围最大的脑区为主);根据TOAST分型记录患者脑梗死病因学分类[12];由专业神经内科医师评估患者入院后24 h内NIHSS评分。发病30 d后,所有患者来神经内科门诊复诊并进行随访,由通过专业培训的医师评估患者神经功能恢复情况(mRS)和患者抑郁情况(HAMD-17)[13]。
1.3 实验室检查及系统性免疫炎症指数计算 采集患者入院次日清晨(05:00~08:00)空腹血液样本,进行血常规及其他实验室检查,收集并提取血常规检测结果中的中性粒细胞计数、淋巴细胞计数、血小板计数。SII计算公式为:SII=血小板计数×中性粒细胞计数/淋巴细胞计数[5]。
1.4 卒中后抑郁诊断及分组 AIS 发病30 d后随访纳入患者,利用HAMD-17 进行精神心理评估。PSD 诊断标准参考《精神障碍诊断与统计手册》第五版,将HAMD-17 评分>7 分的患者纳入PSD 组[14]。
1.5 统计学分析 采用SPSS 22.0 软件进行统计学处理,计量资料首先进行Kolmogorov-Smirnov 正态性检验,符合正态分布的计量资料以表示,组间比较采用独立样本t检验;非正态分布的计量资料用M(P25~P75)表示,组间比较采用Mann-WhitneyU检验。计数资料以频数和率(%)表示,组间比较采用χ2检验。PSD 患者HAMD-17 评分与SII 关系采用Spearman 相关分析(r>0 为正相关,r<0为负相关,越接近1 或-1 相关性越强)。二元多因素logistic 回归分析用于PSD 的相关因素分析(以是否发展为PSD 为因变量,SII 作为自变量,其他单因素分析中P<0.05 的变量纳入回归模型作为校正变量),计算OR与95%CI。ROC 曲线用于分析SII 对PSD 的预测价值。以P<0.05 为差异有统计学意义。
2 结果
2.1 人口学特征和基线临床资料比较 本研究共纳入307 例AIS 患者,病例筛选流程见图1。发病1 个月后进行随访,最终103 例患者纳入PSD 组,204 例患者纳入非PSD 组,PSD 发病率为33.6%。PSD 组和非PSD 组相比,年龄、BMI、血管危险因素、TOAST 分型、脑梗死部位、中性粒细胞计数、淋巴细胞计数、血小板计数差异均无统计学意义。PSD 组患者女性比例和受教育年限高于非PSD 组(均P<0.05)。PSD 组患者入院24 h 内NIHSS 评分高于非PSD 组;PSD 组患者发病30 d 后mRS 评分差异有统计学意义(均P<0.001)(表1)。

表1 纳入患者人口学特征和基线临床资料比较Table 1 Comparison of demographic characteristics and baseline clinical data of included patients
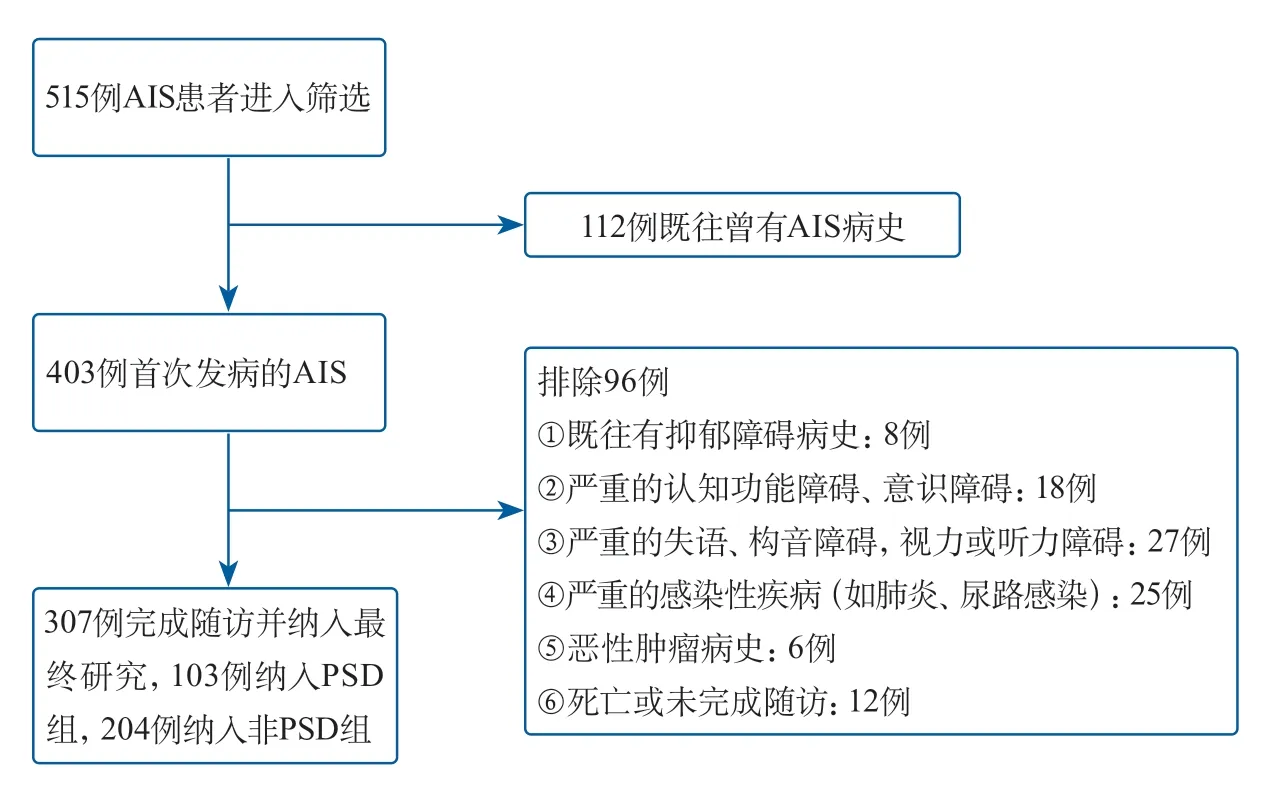
图1 纳入患者筛选流程Figure 1 Flow chart for patients’ selection
2.2 PSD患者SII与HAMD-17 评分相关性 PSD 患者SII 与AIS 发病后30 d的HAMD-17评分值呈正相关,r=0.364(95%CI0.184~0.520,P<0.001),差异有统计学意义(图2)。

图2 PSD患者SII与HAMD-17评分相关分析Figure 2 Correlation analysis of SII and HAMD-17 scores in PSD patients
2.3 SII对PSD的预测价值 根据SII值的三分位数,将纳入的AIS患者分为3个亚组,即较低三分位数组(SII<441.22×109/L),中间三分位数组(441.22×109/L~500.95×109/L),较高三分位数组(SII>500.95×109/L)。以是否发生PSD为因变量,SII为自变量,较低三分位数组为参照。logistic回归结果提示,SII的中间三分位数组、较高三分位数组为PSD的独立危险因素(均P<0.001)。校正年龄、性别、受教育年限等因素后,SII的中间三分位数组、较高三分位数组仍是PSD的独立危险因素(均P=0.001)(表2)。除模型1中考虑混杂因素外,继续校正NIHSS评分、mRS评分等因素,SII的中间三分位数组、较高三分位数组仍是PSD的独立危险因素(P=0.003,P=0.001)(表2)。ROC结果提示,SII对PSD有潜在预测价值,AUC为0.765(95%CI0.709~0.821,P<0.001)。SII的最佳预测临界值为478.18×109/L,此时敏感度为75.7%,特异度为67.6%(图3)。

表2 SII与PSD相关性的logistic回归分析Table 2 Logistic regression analysis of correlation between SII and PSD

图3 SII预测PSD的ROC曲线Figure 3 ROC curves of SII predicting PSD
3 讨论
PSD可增加卒中的致残率和死亡率,可能与卒中不良预后有关[3-4]。本研究中观察到33.6%的AIS患者发病30 d后诊断为PSD,与之前研究中的PSD发病率基本一致[15-16]。此外,本研究发现与非PSD组相比,PSD组患者脑梗死程度更严重,主要表现为入院24 h内NIHSS评分、发病30 d后mRS评分更高,提示PSD组患者的神经功能恢复情况更差,这也与既往研究结果相符[17]。大样本研究和荟萃分析发现抑郁症发病存在明显性别差异[18]。本研究发现PSD组中女性比例(58.3%)明显高于非PSD组(43.1%),提示女性可能是PSD的一个危险因素。本研究结果与Filipi等[19]研究一致:教育水平对抑郁症状及特征有影响,本研究中PSD组的受教育年限中位数为9年,高于非PSD组,提示较高教育水平与卒中患者发展为PSD有潜在联系。
炎症反应参与AIS病理生理过程[20]。同时,炎症反应与炎症因子在PSD的病理机制中发挥重要作用,IL-1β、IL-6、TNFα、干扰素γ、细胞黏附分子1 等炎症促进因子,通过加重炎症反应影响下丘脑-垂体-肾上腺轴,减少脑源性神经生长因子(brain-derived neurotrophic factor,BDNF),进而增加神经细胞毒性作用,导致PSD发生[21-23]。而IL-10、转化生长因子-β等炎症抑制因子则通过免疫调节,减轻机体炎症反应,可能降低PSD的发生风险[23-24]。脑梗死后局灶神经元缺血缺氧坏死,产生局部炎症反应导致血脑屏障损害,外周血白细胞通过受损血脑屏障浸润到梗死的大脑区域[25-26]。中性粒细胞在AIS后数小时内浸润至缺血部位,并在24~48 h达到峰值,中性粒细胞活化多可释放多种细胞因子,如MMP-9、趋化因子、蛋白水解酶、氧自由基等,这些炎性介质进一步加重兴奋性细胞毒性及炎症级联反应[27-28]。血小板通过改变细胞表面P-选择素和CD40的表达,直接与循环中白细胞相互作用,形成血小板-白细胞聚合体并激活固有免疫反应[29]。活化的血小板释放致密颗粒、5-羟色胺(5-hydroxytryptamine,5-HT)、金属蛋白和其他炎症因子,可负性影响BDNF和BDNF受体的磷酸化和表达[30-31]。通过以上机制,血小板在PSD发病机制中发挥重要作用。淋巴细胞也参与AIS后的炎症反应,既往研究中淋巴细胞在AIS中的作用机制颇受争议,不同亚型对AIS的特殊作用不同。CD4+、CD8+T细胞和γδT细胞通过产生干扰素-γ和IL-17等炎症因子加重炎症反应,自然杀伤细胞募集于缺血的脑组织可直接导致神经元死亡[32],调节性T细胞分泌IL-10,通过Janus激酶/信号传导器和转录激活因子级联信号通路、磷脂酰肌醇-3-激酶信号通路和丝裂原活化蛋白激酶信号通路发挥神经保护作用[33]。
既往研究发现,中性粒细胞计数/淋巴细胞计数增高、血小板计数/淋巴细胞计数增高与PSD相关,并可作为PSD的对立预测因素[34-35]。SII在中性粒细胞计数/淋巴细胞计数的计算公式基础上加入了血小板计数,可更合理、更全面地评价炎症反应。SII增高一般表明患者的炎症反应增强,免疫反应降低。本研究首次报道SII与AIS患者1个月后发生PSD的关系。PSD组患者的SII高于非PSD组患者,相对于较低的SII,中高水平的SII为AIS患者发生PSD的独立危险因素。本研究ROC分析结果表明,SII对PSD具有一定的预测价值。综上所述,SII可能是预测PSD的一种简单且有效的生物标志物,可能有助于临床早期识别和诊断PSD。
本研究仍存在一些不足:仅通过收集AIS患者入院时血常规检查结果计算SII,随着时间推移,AIS患者血细胞特点可能变化,因此后期研究可动态观察SII与PSD关系;本研究为单中心回顾性研究,样本量相对较小,因此本文结论仍需要更多大规模、多中心的前瞻性研究进一步验证。
利益冲突所有作者均声明不存在利益冲突。

