基于N和G蛋白的HeV抗体间接ELISA检测方法的建立
朱盈名,王迎平,冯旭东,朱桓奕,杨晓伟,陈 翔,王 艳,赵光伟*
(1.西南大学动物医学院,重庆 402460;2.上海海关,上海 200135;3.上海海关动植物与食品检验检疫技术中心,上海 200135)
亨德拉病毒(Hendra virus,HeV)是副黏病毒科亨尼帕病毒属的一种烈性人兽共患病病原,其培养需在生物安全等级为4级的实验室中进行[1]。该病毒1994年在澳大利亚患有严重发热性呼吸道疾病的马场中被报道,发病马表现发热、精神沉郁、进食减少、心动过速、呼吸困难、面部水肿和共济失调等症状,约75%的病例48~72 h内死亡[2]。此后20年在澳大利亚沿海地区共有58起HeV感染事件,呈散发态势[3]。目前我国尚未有HeV感染的报道,然而由于国际贸易、马术比赛以及赛马产业的蓬勃发展,马匹出入境频繁,存在境外输入的风险,因此HeV是我国海关、口岸、出入境等机构必检的病原之一。
HeV为单股负链RNA病毒,编码6种结构蛋白,其中G蛋白为HeV的囊膜糖蛋白,通过Ephrin B2/3受体结合宿主细胞附着蛋白感染细胞[4],是感染中重要的锚定蛋白,目前国外已有基于G蛋白的商品化马疫苗投入临床,但接种率偏低,如澳大利亚马群接种率仅为11%~17%[5];N蛋白为HeV的核衣壳蛋白,为主要抗原表位区域,可刺激机体产生中和抗体,是开发诊断试剂的优选靶点,目前已有利用该蛋白做早期诊断研究的报道[6]。针对该病毒的检验检疫国际通用的方法是采用RT-PCR或RT-qPCR技术检测病毒核酸,我国口岸部门亦是如此,然而这种方法对动物的某些隐性感染以及疫苗接种史等均不能做出有效判断,基于此,本试验构建HeV重组N、G蛋白,建立间接ELISA(iELISA)诊断方法,为海关、出入境等技术部门作为HeV临床血清学诊断提供技术储备。
1 材料与方法
1.1 材料
1.1.1 血清和马匹 马阴性血清(n=250)和阳性对照血清(非洲马瘟病毒、西尼罗病毒、马梨形虫、马传染性贫血病毒、马媾疫锥虫、马鼻疽杆菌)均由上海海关动植物与食品检验检疫技术中心提供。1岁健康雌马4匹,饲喂于上海踏雪无痕马术俱乐部有限公司。
1.1.2 主要试剂与仪器 pET30a Easy Vector,普洛麦格(北京)生物技术有限公司产品;NdeⅠ、Hind Ⅲ限制性内切酶,北京全式金生物技术有限公司产品;2×RapidTaqMaster Mix和DL 2 000 DNA Marker,南京诺唯赞生物科技有限公司产品;Ni-NTA 6FF His标签蛋白纯化试剂盒,上海七海生物医药科技有限公司产品;山羊抗马IgG-HRP,武汉三鹰生物技术有限公司产品;弗氏佐剂,上海碧云天生物技术有限公司产品;引物、核酸合成及测序由南京金斯瑞生物科技有限公司完成;酶标仪(Infinite®200 PRO),瑞士TECAN公司产品。
1.2 方法
1.2.1 密码子优化及合成 为提高基因的表达概率,使适应宿主工程菌大肠埃希氏菌BL21(DE3)的表达偏好,用Jcat网站(http://www.jcat.de/)对HeV的N和G目的基因(Gene ID:1446470、1446471)进行优化,改变低概率峰密码子。便于后续原核表达载体的构建,在序列的两端分别添加NdeⅠ和Hind Ⅲ酶切位点序列,并在5′端加入一个启动子和His标签序列以便于后续蛋白的纯化,在3′端加上终止密码子,策略如下:NdeⅠ(CATATG)-启动子(ATG)-His标签(CATCATCATCACCACCAC)-N蛋白或G蛋白基因(HeV)-终止密码子(TAATGA)-Hind Ⅲ(AAGCTT)。设计好的序列由南京金斯瑞生物科技有限公司合成。
1.2.2 重组质粒的构建 将人工合成N、G序列和pET30a原核表达载体分别用限制性内切酶Hind Ⅲ和NdeⅠ进行酶切反应,胶回收试剂盒回收其消化后的片段,继而利用T4连接酶进行两个黏末端片段的连接,酶切和连接的反应体系如下:酶切反应体系(20 μL):PET30a质粒或N基因或G基因5 μL,NdeⅠ 1 μL,Hind Ⅲ 1 μL,缓冲液2 μL,双蒸水11 μL;连接反应体系(20 μL):PET30a质粒2 μL,N或G基因5 μL,T4连接酶1 μL,T4连接酶缓冲液2 μL,双蒸水10 μL。构建的重组质粒经Hind Ⅲ、NdeⅠ双酶切鉴定和测序鉴定后备用。
1.2.3 重组质粒的原核表达 测序正确的阳性质粒按0.5 μL/100 μL 转入BL21(DE3)感受态细胞,用50 μg/mL硫酸卡那霉素作为筛选抗生素。挑取阳性克隆,接种于50 mL含有50 μg/mL卡那霉素的LB培养基中,37℃培养至OD 600 nm值=0.6,加入终浓度为1 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG),37℃、220 r/min诱导4 h。诱导完成后将菌液转移至灭菌后的50 mL离心管中,4℃、10 000 r/min离心10 min,弃上清收集菌体沉淀,加入少量灭菌生理盐水洗涤菌体,4℃、10 000 r/min离心10 min,弃上清收集沉淀,加入lysis buffer(50 mmol/L Tris-HCl,150 mmol/L NaCl,5%甘油,0.5 mmol/L PMSF,5 mmol/L 咪唑,pH7.4)室温反应30 min,冰浴,超声破碎菌体(150 W,工作4 s,停3 s,14 min)。破碎后液体4℃、10 000 r/min离心10 min,分别收集上清与沉淀,上清保存于-80℃待用,沉淀用洗涤液1(100 mmol/L Tris-HCl,2 mol/L 尿素,10 mL/L吐温-20,pH 7.4)洗涤,室温反应8 min,4℃、10 000 r/min离心10 min。收集沉淀用洗涤液2(50 mmol/L Tris-HCl,4 mol/L尿素,pH 8.0)洗涤1次,4℃、10 000 r/min离心10 min,沉淀用灭菌生理盐水洗涤,4℃、10 000 r/min离心10 min。收集沉淀为包涵体,用变性液(8 mol/L尿素)溶解包涵体,4℃ 10 h。变性后蛋白液装入透析袋,用100×体积的6 mol/L尿素、4 mol/L尿素、2 mol/L尿素、1×PBS溶液(pH7.4)在4℃分别透析复性4 h。吸出蛋白液,利用SDS-PAGE和Western blot检测蛋白表达情况,将表达的粗蛋白通过镍离子亲和层析纯化,纯化重组蛋白置-80℃保存待用。
1.2.4 HeV-N、HeV-G多克隆抗体的制备 将在-80℃保存的纯化HeV-N、HeV-G蛋白置冰水中融化,按照1∶1的比例与弗氏完全佐剂和弗氏不完全佐剂充分乳化,接种马亨德拉病毒阴性雌马。首次免疫时,将弗氏完全佐剂乳化蛋白各100 μg接种于马颈部皮下,初次免疫后14 d与28 d再注射等量弗氏不完全佐剂乳化蛋白。阴性对照组马注射等量生理盐水。每次免疫14 d后采血1~2 mL,分离血清置-20℃保存。
1.2.5 iELISA检测方法的建立 矩阵法检测HeV-N、HeV-G蛋白最佳包被浓度以及一抗的稀释倍数。在碳酸盐包被液中将纯化HeV-N、HeV-G蛋白稀释成1、2、4、6、8、10 μg/mL,每浓度铺8个酶标孔,100 μL/孔。4℃过夜包被。次日弃去孔内液体拍干,用洗涤液清洗酶标孔(每次洗涤液停留1 min,拍干,重复3次),5%脱脂奶粉200 μL/孔,37℃孵育2 h,洗涤酶标孔同上操作。以阴性马血清和免疫后马血清作为阴、阳性对照,TBS为空白对照,用TBS将血清按照1∶50、1∶100、1∶200、1∶300、1∶400、1∶600、1∶800、1∶1 000的比例稀释。100 μL/孔加入稀释后的血清(1∶50~1∶1 000),37℃孵育1 h。洗涤后加入1∶4 000比例稀释的山羊抗马IgG-HRP偶联物100 μL/孔,37℃孵育1 h。洗涤后100 μL/孔加入TMB显色液,37℃显色10 min。加入50 μL/孔ELISA终止液,使用荧光多功能酶标仪读取OD 450 nm值;以P/N值最大为评判标准。
1.2.6 iELISA检测方法阴、阳性临界值的计算 检测250份马阴性血清OD 450 nm值,计算平均值和标准差σ,以置信区间99%“平均值+3σ”为临界值,OD 450 nm值大于或等于临界值判定为阳性,小于临界值判定为阴性。
1.2.7 iELISA检测方法条件的优化 比较不同条件下iELISA检测方法的包被条件(37℃ 1、2、3 h和4℃过夜)、封闭条件(5%脱脂奶粉、2% BSA、1%明胶、5%猪血清各0.5、1、1.5、2 h)、一抗孵育时间(30、45、60、80 min)、二抗稀释度与孵育时间(1∶2 000、1∶4 000、1∶6 000、1∶8 000各30、45、60、80 min)、显色时间(10、20、30 min)。以P/N值最大为评判标准,确定最佳反应条件。
1.2.8 iELISA方法灵敏度、特异性、重复性的测定 根据已优化iELISA检测方法,用1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800、1∶25 600稀释的阳性对照确定iELISA方法的灵敏度,并利用Western blot对其进行验证。用马阳性血清与其他马属动物相关病原阳性血清(非洲马瘟病毒、西尼罗病毒、马梨形虫、马传染性贫血病毒、马媾疫锥虫、马鼻疽杆菌)确定iELISA方法的特异性。用5批不同时间包被的酶标板板与同批次酶标板检测5份血清,计算变异系数(CV)确定iELISA方法的重复性,以CV小于10%为评价标准。
1.2.9 iELISA方法准确性的测定 利用3份阳性血清与250份阴性血清对所建立的ELISA检测方法进行准确性评估,以其敏感性为纵坐标,(1-特异性)为横坐标,绘制ROC(receiver operating characteristic curve)曲线图,分析检验该方法的准确性。
2 结果
2.1 重组蛋白表达载体的构建
设计的HeV-pET30a(+)-N与HeV-pET30a(+)-G质粒经密码子优化,序列的CG含量分别从原来的57.13%和53.70%,下降到51.22%和50.60%,CAI值从原来的0.64和0.65均提高到1.0,表达概率提高。酶切鉴定结果(图1)显示N和G基因均成功连接到pET30a(+)载体,测序结果证实所构建的重组表达载体正确。

A:1.重组质粒N; 2.重组质粒N双酶切产物;B:1.重组质粒G,2.重组质粒G双酶切产物,M.DNA标准DL 10 000
2.2 重组蛋白的表达
阳性菌株经IPTG诱导,经SDS-PAGE检测(图2),发现N和G重组蛋白均成功表达;蛋白经变性、复性,用Western blot进行验证(图3),证实确为目的蛋白。

M.蛋白分子质量标准;1~6.未诱导BL21(DE3)全菌、诱导pET30a空载体、HeV-N表达蛋白、纯化的HeV-N蛋白、HeV-G表达蛋白、纯化的HeV-G蛋白

A.HeV-N鉴定结果;1~4.未诱导BL21(DE3)全菌、诱导pET30a空载体、重组N蛋白、纯化N蛋白;B.HeV-G鉴定结果;1~4.未诱导BL21(DE3)全菌、诱导pET30a空载体、重组G蛋白、纯化G蛋白,M.蛋白分子质量标准 A.Identification result of recombinant HeV-N protein,1-4.Control without chemically induced expression in BL21 (DE3),control of empty vector (pET30a),recombinant HeV-N protein,purified HeV-N protein,respectively;B.Identification result of recombinant HeV-G protein,1-4.Control without chemically induced expression in BL21 (DE3),control of empty vector (pET30a),recombinant HeV-G protein,purified HeV-G protein,respectively,M.Protein molecular weight Marker
2.3 iELISA检测方法的建立
用方阵法确定iELISA方法中HeV-N、HeV-G蛋白的包被浓度分别为10 μg/mL和8 μg/mL,被检马血清的稀释倍数为1∶800。
2.4 iELISA检测方法阴、阳性临界值的计算
在正交试验结果基础上对250份马阴性血清样品进行检测,结果进行统计学分析(图4),HeV-N蛋白检测结果平均值0.1470,标准方差0.029,即阴、阳性临界值为0.235;HeV-G蛋白检测结果平均值0.1610标准方差0.035,即阴、阳性临界值为0.267。

图4 iELISA方法临界值的确定
2.5 iELISA检测方法条件的优化
对iELISA检测反应条件进行优化,确定最佳反应条件(图5)。HeV-N蛋白最佳包被条件为4℃过夜,5%脱脂奶粉37℃封闭2 h,血清最佳作用时间30 min,二抗最佳孵育条件为1∶8 000稀释37℃作用60 min,37℃显色10 min;HeV-G蛋白最佳包被条件为4℃过夜,2% BSA 37℃封闭2 h,血清最佳作用时间80 min,二抗最佳孵育条件为1∶8 000稀释37℃作用80 min,37℃显色10 min。

A.包被时间;B.封闭时间;C.血清反应时间;D.二抗稀释倍数及时间;E.显色时间
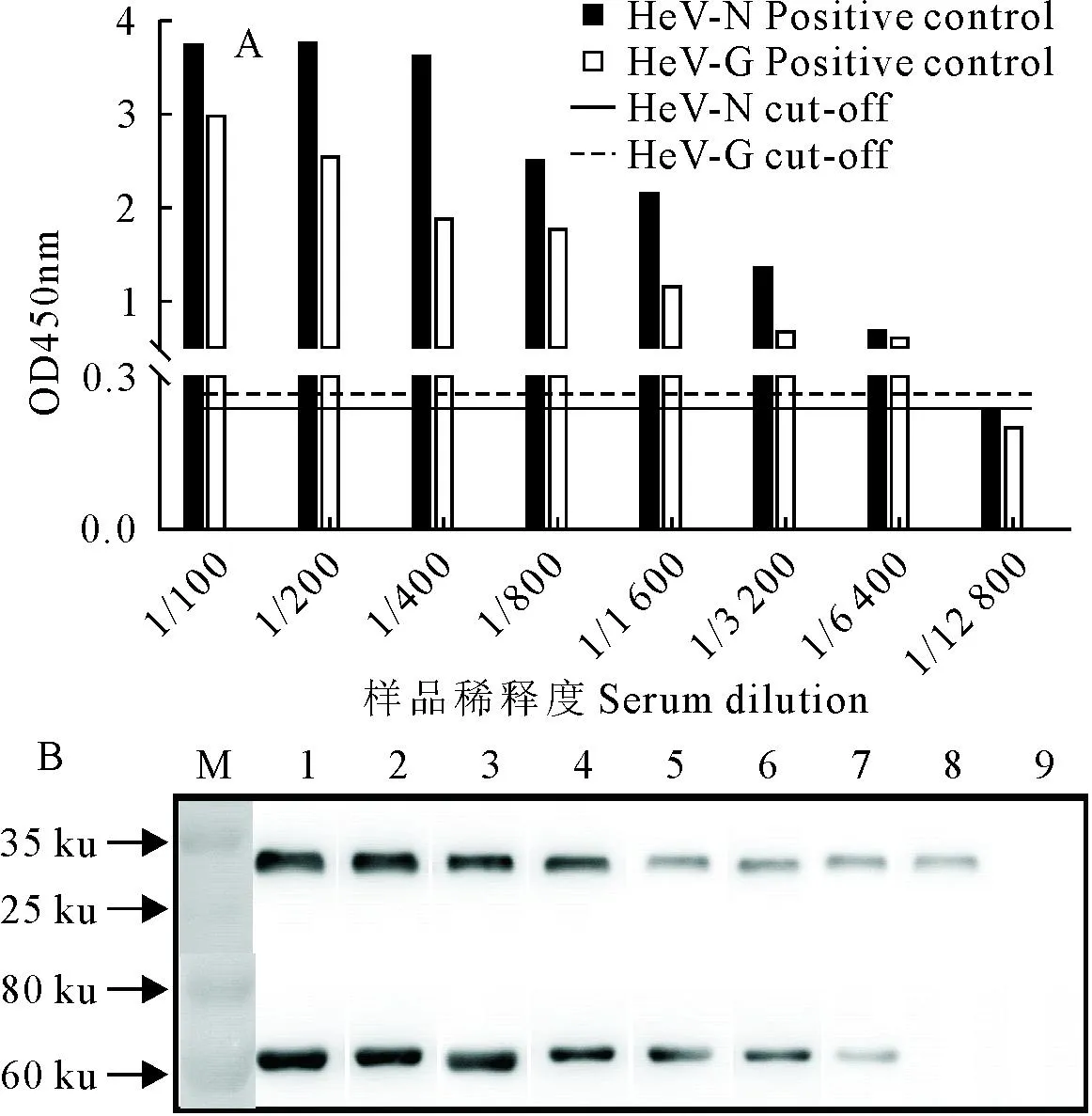
A.间接ELISA方法的敏感性试验结果;B.Western blot方法验证结果,1~9.分别为阳性对照稀释度1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800、1∶25 600
2.6 iELISA方法灵敏度、特异性和重复性的检测
对HeV-N和HeV-G两种蛋白所确立的iELISA方法进行敏感性检测,阳性血清进行1∶100~1∶125 600倍比稀释,结果显示HeV-N蛋白灵敏度大于1∶12 800,HeV-G蛋白灵敏度大于1∶6 400(图6A),Western blot试验证实随着血清稀释度的增加,其条带逐渐变弱(图6B),与iELISA灵敏性试验结果一致。特异性检测发现该方法对非洲马瘟病毒、西尼罗病毒、马梨形虫、马传染性贫血病毒、马媾疫锥虫、马鼻疽杆菌等阳性血清均不发生交叉反应(图7),所建间接iELISA检测方法特异性良好。批内和批间重复性进行检测(表1~表2),发现HeV-N和HeV-G蛋白批内、批间变异系数均小于10%,说明建立的ELISA方法具有良好的重复性。

表1 批内重复性试验结果

表2 批间重复性试验结果
1.HeV-N、HeV-G阳性样本;2.非洲马瘟病毒;3~4.西尼罗病毒;5.马梨形虫;6~7.马传贫病毒;8.马媾疫锥虫;9~10.马鼻疽杆菌
2.7 iELISA检测方法准确性的检测
HeV-N和HeV-G两种iELISA方法所绘制的检测样本ROC曲线见图8,其中HeV-N蛋白的曲线下面积为0.91,临界值为0.22,敏感度0.77,特异性0.58,95%置信区间为80.2%~101.5%;HeV-G蛋白的曲线下面积为0.93,临界值为0.27,敏感度0.88,特异性0.60,95%置信区间为79.5%~105.9%,二者的阳性样本指数均高于阈值,说明所建立的iELISA方法具有良好的准确性。

A.HeV-N ROC曲线图;B.HeV-G ROC曲线图
3 讨论
马亨德拉病毒于1994年在澳大利亚昆士兰州亨德拉郊区的马匹上首次被分离,随后证实狐蝠(蝙蝠的一种)是该病毒的宿主动物,由于狐蝠具有很强的飞行能力,其冬眠和社会行为也有利于病毒的保存、进化和传播,因此HeV具有扩散外溢的风险,自2006年以来澳大利亚每年都有该病发生的记录[7]。此外,又由于该病毒对人也具有致病力,感染后病死率很高,尽管目前尚未在我国出现,但口岸、海关以及出入境检验检疫部门已将该病毒作为入关必 检的病原之一[8]。
马感染HeV后在急性期和抗体产生之前就发生死亡或被安乐死,HeV的核酸检测是确认临床病例诊断方法[9],当前RT-PCR和实时荧光定量PCR被普遍采用[8]。血清学检测方法具有优势并可作为核酸检测的补充[10],尤其在引入HeV疫苗后,血清学检测是评估疫苗免疫效果的必要手段,也可对动物的感染情况进行检测。针对HeV开展血清学检测可作为我国出入境检验检疫部分的储备技术。
HeV中的G蛋白可刺激动物产生中和抗体,作为包被抗原建立ELISA方法可对接种过疫苗的马进行抗体水平检测,但该方法无法区分抗体是自然感染产生的还是接种疫苗产生的抗体;而HeV的N蛋白则不受疫苗的影响,基于N蛋白单克隆抗体的捕获ELISA获得成功[7]。本试验针对G和N两种蛋白分别建立其iELISA诊断方法,这对于评估HeV的感染及疫苗免疫情况的判断是有益的。HeV的培养需要在BSL-4级生物安全实验室中进行,因此获取病毒样本极其严苛,本试验采用人工合成方式,对其序列进行密码子优化,使其能够在大肠埃希氏菌表达系统中得以高效表达,以往研究中也是采用此方法[11]。
对建立的iELISA方法进行特异性、灵敏性、重复性和准确性等参数的评估,该方法可以准确识别免疫后的阳性血清,而对阴性血清及其他物种血清不识别且无交叉反应,说明该方法具有良好的临床应用价值。因我国没有标准的HeV阳性血清,且临床中也无可利用的阳性动物,因而未能用阳性临床样本对其进行检验,有待进一步优化[12],缺乏足够量的阳性血清对评估血清学诊断方法有一定的限制作用。

