健胃消胀片通过调节PI3K-Akt-eNOS通路改善大鼠胃癌前病变
黄海阳, 钟少雯, 安云, 王宇新, 朱淑敏, 高洁, 卢晓敏, 董明国
(1.东莞市中医院,广东东莞 523000;2.广州中医药大学中药学院,广东广州 510006;3.广州市番禺区中医院,广东广州 511408)
胃癌前病变(precancerous lesions of gastric cancer,PLGC)是指在慢性萎缩性胃炎的基础上伴有肠黏膜上皮化生(IM)或异型增生(DYS)改变[1]。Correa级联反应指明胃癌发生的病理演变过程:正常胃黏膜→非萎缩性胃炎→慢性萎缩性胃炎→胃黏膜肠上皮化生→胃黏膜异型增生→胃癌[2-3]。在我国,胃癌的发病率位居第2,仅次于肺癌[4]。现代年轻人常因饮食不节而罹患胃肠系统疾病,而常见的胃肠道疾病若不加以重视则可能演化为重症或恶性肿瘤。胃癌前病变是胃炎演化为胃癌的“黄金截点”,也是临床上预防胃癌的研究重点,正确认识并应对胃癌前病变、寻找针对胃癌前病变的有效治疗药物,是降低胃癌发生率的关键。
健胃消胀片为广州中医药大学东莞医院研制的中药复方制剂,具有行气消胀、健运脾胃、调和气血等功效,用于功能性消化不良、慢性胃炎、胆汁反流性胃炎等疾病,临床疗效确切。为拓展健胃消胀片的临床应用范围,本课题组前期通过多个实验考察其对胃癌前病变相关疾病模型的干预效果,发现健胃消胀片对慢性萎缩性胃炎大鼠的胃黏膜有一定的保护作用,能增强胃黏膜屏障的防御和修复能力[5-6],还能抑制胃酸分泌、促进小肠运动[7]。在前期研究的基础上,本研究拟进一步考察健胃消胀片对胃癌前病变大鼠模型治疗的潜在机制,为本病的临床合理用药提供参考依据,现将研究结果报道如下。
1 材料与方法
1.1 实验动物 40 只SPF 级6 周龄雄性SD 大鼠,体质量220~240 g,由广州中医药大学实验动物中心提供,实验动物质量合格证号:44005800008402。于SPF级环境检疫饲养,自由摄食和饮水,于动物房内适应性饲养7 d后用于后续实验。本动物实验方案已经广州中医药大学动物实验伦理委员会审核批准(批号:20210426006)。
1. 2 药物及制备 健胃消胀片(由枳实、沉香、大腹皮、莪术、山药、墨旱莲、石斛、甘草、鸡内金、紫苏梗等10味中药组成),为广东省东莞市中医院院内制剂(批号:20210426),使用时溶解于无菌生理盐水,制成终质量浓度25 mg·mL-1;叶酸片,福建海王福药制药公司生产(批号:21042810),使用时溶解于无菌生理盐水,制成终质量浓度0.5 mg·mL-1;雷尼替丁,广东省恒健医药公司生产,批号:国药准字H44021173。
1.3 试剂与仪器 N-甲基-N’-硝基-N-亚硝基胍(MNNG,广州市康明生命技术公司,批号:20210601);苏木素-伊红(HE)染色液、阿利新蓝-过碘酸雪夫氏(AB-PAS)染色液(北京雷根生物技术有限公司);大鼠胃泌素(GAS)酶联免疫吸附分析(ELISA)试剂盒、大鼠胃动素(MTL)ELISA 试剂盒、大鼠胰高血糖素(GC)ELISA试剂盒(江苏酶免实业有限公司);磷脂酰肌醇3-激酶(PI3K)、磷酸化PI3K(p-PI3K)、蛋白激酶B(Akt)、磷酸化Akt(p-Akt)、β-actin、血管内皮细胞生长因子A(VEGFA)等抗体,Anti-Rabbit lgG(H+L)HRP 二抗(美国Affinity 公司);内皮型一氧化氮合酶(eNOS)抗体(美国SAB 公司)。HM340E 型半自动轮转石蜡切片机(美国Thermo Fisher Scientific 公司);Gemini AS 型自动染色机(美国Thermo Fisher Scientific 公司);光学显微镜(日本Olympus 公司);冷冻高速离心机(美国Thermo Fisher Scientific公司);电泳仪(美国Bio-Rad公司);显影仪(广州誉维生物科技仪器有限公司);1510全波长酶标仪(美国Thermo Fisher Scientific公司)。
1.4 分组、造模与给药 40 只SD 大鼠适应性喂养1周后,随机抽取10只作为正常组,每天以2 mL生理盐水灌胃,正常喂养,连续12周。其余30只大鼠应用联合造模法构建胃癌前病变模型[8]:自由饮用质量浓度为180 μg·mL-1的MNNG,并配合3 mg·mL-1的雷尼替丁水溶液2 mL/只灌胃,连续12 周。若HE染色结果显示模型大鼠胃黏膜壁层细胞结构改变,排列疏松、异常紊乱,胞核异形,出现杯状细胞增生,肠化生现象等,AB-PAS染色结果显示模型组大鼠胃组织黏膜层显著变薄,则判断胃癌前病变造模成功。成功造模后,将大鼠随机分为模型组、叶酸组和健胃消胀片组,每组10 只。在造模第5 周开始给药:叶酸组,每只大鼠以4 mg·kg-1的叶酸溶液灌胃;健胃消胀片组,根据课题组前期实验的有效剂量范围[5-7]结合动物伦理要求,给予0.5 g·kg-1剂量的健胃消胀片混悬液灌胃。连续给药7周。全部实验大鼠在末次给药后禁食禁水12 h,麻醉满意后,进行标本取材。
1.5 观察指标与方法
1.5.1 大鼠体质量测量 记录给药期间各组大鼠体质量的变化。
1.5.2 胃部大体形态观察 取出大鼠全胃,沿大弯侧切开,倾倒内容物,生理盐水冲洗干净,观察胃部大体观病理变化与评分[9]。评分标准:无损伤,计0分;黏膜充血、水肿,计1分;黏膜散在肿物突起,计2 分;黏膜肿物突起较多,计3 分;黏膜肿物突起成片,计4分。
1. 5. 3 脾脏系数和肝脏系数 取大鼠脾脏和肝脏,计算各组大鼠脾脏系数和肝脏系数。
1.5.4 血清GAS、MTL、GC含量测定 腹主动脉取血,分离血清,根据ELISA 试剂盒说明书的操作步骤和方法,测定大鼠血清中GAS、MTL、GC含量。
1. 5. 5 HE 染色法观察胃组织病理形态 分离大鼠胃组织,在干净滤纸上纵向切段(含胃底、胃体、胃窦),以10%福尔马林溶液固定24 h 以上,经石蜡包埋后切片(厚度4 μm)。用自动染色机对切片进行HE染色,显微镜下观察比较各组胃组织病理形态变化,并对胃组织炎症程度进行评分[9],评分标准如表1。

表1 胃组织炎症程度评分标准Table 1 Scoring criteria for the degree of inflammation in gastric tissue
1.5.6 AB-PAS 染色法检测胃组织黏膜层厚度将大鼠胃组织石腊切片,二甲苯脱蜡至水。阿利新蓝染色液染色15 min,入过碘酸溶液氧化5 min,Schiff Reagent 浸染15 min,Leagene 苏木素染色液染核1 min,酸性分化液分化3 s,Scott 蓝化液返蓝。每个步骤后均蒸馏水洗,然后逐级常规乙醇脱水,二甲苯透明,中性树胶封片。显微镜下观察,并用ImageJ软件测量比较各组胃组织AB-PAS阳性表达的黏膜层厚度。
1.5.7 Western Blot法检测胃组织PI3K-Akt-eNOS通路相关蛋白表达 胃组织加入放射免疫沉淀分析(RIPA)裂解缓冲液[蛋白磷酸酶抑制剂∶苯磺酰氟(PMSF)∶RIPA=1∶1∶10;组织与缓冲液比为1∶10],匀浆裂解后在4 ℃、12 000g下离心10 min,收集上清,用二喹啉甲酸(BCA)蛋白检测试剂盒测定蛋白浓度。样品加入SDS 缓冲液于恒温金属浴中100 ℃、10 min 加热变性,十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离(30 min,80 V;40 min,120 V),将蛋白转移到聚偏氟乙烯(PVDF)膜上。室温下用5%脱脂奶粉封闭2 h,分别加入按体积比稀释的PI3K(1∶1 000)、p-PI3K(1∶1 000)、Akt(1∶1 000)、p-Akt(1∶1 000)、eNOS(1∶1 000)、β-actin(1∶4 000)等抗体4 ℃孵育过夜。TBS-0.1%Tween 20(TBST)洗涤膜3 次,每次8 min,加入二抗Anti-Rabbit lgG(H+L)(1∶4 000)室温孵育1 h后,再按上述方法洗涤膜。通过显影仪获得蛋白质图像,利用ImageJ 软件测量条带灰度比,并以β-actin 为参照,分析各组目的蛋白表达的差异。每组选取3 个不同的样本重复上述实验。
1. 5. 8 免疫荧光染色法检测胃组织VEGFA 蛋白表达 将胃组织石蜡切片经60 ℃烘片3 h后经二甲苯脱蜡、梯度酒精脱水,在枸橼酸修复液中进行抗原修复,用胎牛血清封闭30 min,滴加适宜稀释比例的一抗(VEGFA)置湿盒中4 ℃孵育过夜。PBS洗去一抗后滴加荧光二抗置湿盒中室温避光孵育1 h。PBS洗去二抗,用滤纸擦去标本外的PBS,滴加DAPI避光孵育5 min,对标本进行显核。最后用甘油封片,并在荧光显微镜下立即观察。
1.6 统计方法 采用SPSS 20.0统计软件进行实验数据分析,计量数据以均数±标准差()表示,多组比较采用单因素方差分析(One-way ANOVA)结合Post Hoc 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 给药期间各组大鼠体质量变化比较 图1 结果显示:给药期间各组大鼠体质量百分比总体呈增长趋势。正常组大鼠体质量百分比增长速度最快,实验结束时相比给药前体质量增长幅度最大;模型组大鼠于治疗第5周体质量百分比开始一度出现下降趋势,实验结束时相比治疗组开始给药时体质量增幅最小;叶酸组大鼠于治疗第2周和第5 周、健胃消胀片组大鼠于治疗第3 周和第5 周体质量百分比均有所下降,但在给药治疗后期增幅比模型组大,实验结束时相比给药治疗前的增幅均比模型组大。
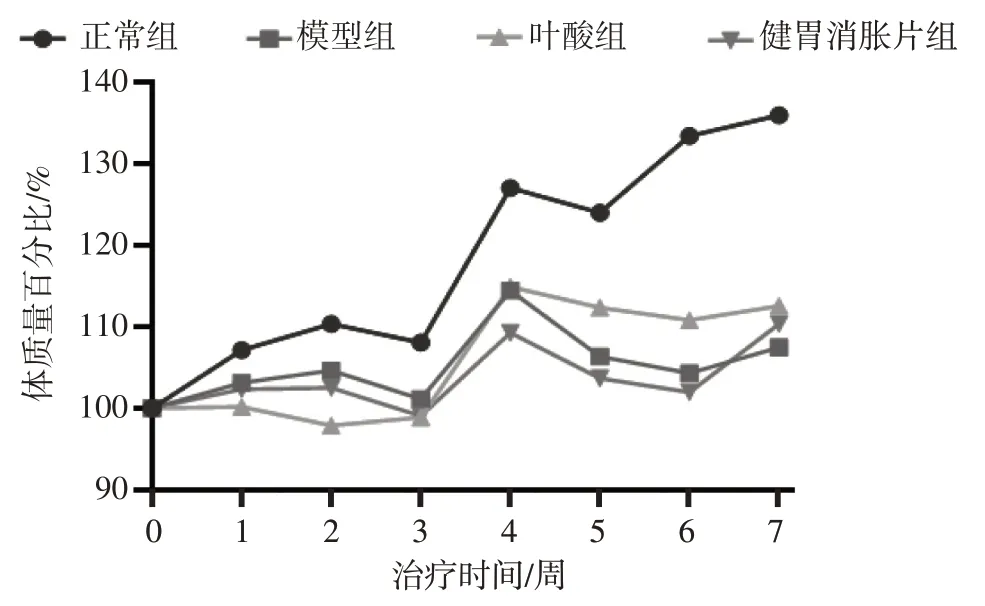
图1 给药期间各组大鼠体质量百分比变化比较Figure 1 Comparison of percentage change in body mass of rats among various groups during drug administration
2. 2 各组大鼠胃部大体观病理变化比较 图2、表2结果显示:正常组大鼠胃部大体上无明显病变的特点,色泽红润,表面平滑,无水肿或充血、糜烂、结节肿块;模型组大鼠胃部胃黏膜表面疣状突起成片,颜色泛白,糜烂明显,黏膜有明显充血、水肿现象;叶酸组大鼠胃部胃黏膜轻微充血、水肿,颜色微红,有部分突起,无明显糜烂,胃部大体观病理评分显著低于模型组(P<0.05);健胃消胀片组大鼠胃部胃黏膜外表光滑,色泽微红,无明显疣状突起,也未见明确的缺损,胃部大体观病理评分显著低于模型组(P<0.01)。
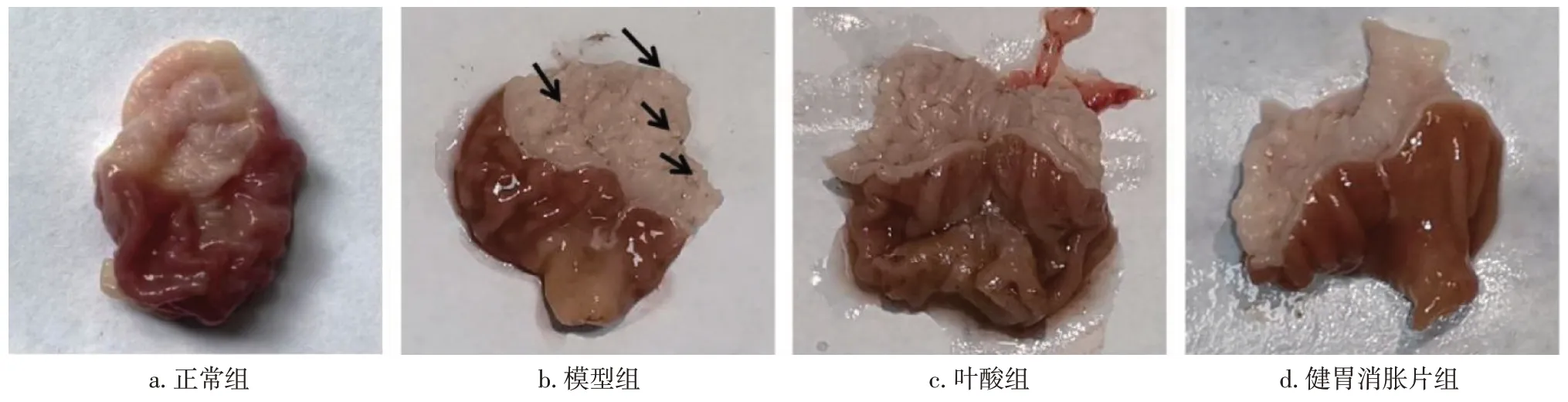
图2 各组大鼠胃部大体观Figure 2 Gross view of stomach in each group of rats
表2 各组大鼠胃部大体观病理评分比较Table 2 Comparison of pathologic scores of the macroscopic view of the stomach of rats among various groups()

表2 各组大鼠胃部大体观病理评分比较Table 2 Comparison of pathologic scores of the macroscopic view of the stomach of rats among various groups()
注:①P<0.01,与正常组比较;②P<0.05,③P<0.01,与模型组比较
胃部病变评分/分0.00±0.00 1.67±0.69①0.75±0.38②0.58±0.34③组别正常组模型组叶酸组健胃消胀片组鼠数/只10 10 10 10
2.3 各组大鼠脏器系数比较 表3 结果显示:与正常组比较,模型组大鼠的脾脏系数、肝脏系数显著降低,差异有统计学意义(P<0.01);与模型组比较,健胃消胀片组和叶酸组大鼠脾脏系数、肝脏系数显著升高,差异有统计学意义(P<0.01);2 个治疗组间比较,差异无统计学意义(P>0.05)。
表3 各组大鼠脏器系数比较Table 3 Comparison of organ coefficients among various groups of rats()

表3 各组大鼠脏器系数比较Table 3 Comparison of organ coefficients among various groups of rats()
注:①P<0.01,与正常组比较;②P<0.01,与模型组比较
肝脏系数/%2.67±0.37 2.32±0.18①2.65±0.26②2.60±0.15②组别正常组模型组叶酸组健胃消胀片组鼠数/只10 10 10 10脾脏系数/%0.22±0.03 0.18±0.01①0.22±0.04②0.20±0.01②
2.4 各组大鼠血清GAS、MTL、GC含量比较 表4结果显示:与正常组比较,模型组大鼠血清GAS含量升高,MTL、GC 含量降低,差异均有统计学意义(P<0.05 或P<0.01);与模型组比较,健胃消胀片组大鼠血清GAS 含量降低,MTL、GC 含量升高,差异均有统计学意义(P<0.01),叶酸组MTL含量升高(P<0.01),GAS、GC含量差异无统计学意义(P>0.05)。
表4 各组大鼠血清胃泌素(GAS)、胃动素(MTL)、胰高血糖素(GC)含量比较Table 4 Comparison of serum gastrin(GAS),motilin(MTL)and glucagon(GC)levels in rats among various groups()

表4 各组大鼠血清胃泌素(GAS)、胃动素(MTL)、胰高血糖素(GC)含量比较Table 4 Comparison of serum gastrin(GAS),motilin(MTL)and glucagon(GC)levels in rats among various groups()
注:①P<0.05,②P<0.01,与正常组比较;③P<0.01,与模型组比较
组别正常组模型组叶酸组健胃消胀片组GC/(pg·mL-1)60.77±7.24 46.48±5.76①54.01±15.28 59.50±6.44③鼠数/只10 10 10 10 GAS/(ng·L-1)10.21±0.52 11.56±0.47②10.90±0.61 10.20±0.63③MTL/(pg·mL-1)361.27±36.08 300.80±44.03①430.03±22.79③425.20±18.34③
2. 5 各组大鼠胃组织病理形态变化比较 图3、表5结果显示:正常组大鼠胃黏膜上皮细胞完全连续性,腺体整齐紧密排列,细胞间布局规整有序,内部结构清晰,未见异型增生细胞,无炎症细胞浸润,无充血、水肿出现,黏膜和肌层没有异常[10],见图3-b~c;模型组大鼠胃黏膜壁层细胞结构改变,排列疏松、异常紊乱,胞核异形,出现杯状细胞增生,肠化生现象(见图3-e),提示胃组织癌前病变,同时出现血管充血,水肿现象[11-12](见图3-f),与正常组相比炎症评分显著升高,差异有统计学意义(P<0.01);叶酸组部分可见杯状细胞增生(见图3-h),血管充血、水肿现象仍较严重(见图3-i),与模型组相比稍有好转,炎症评分亦有所降低(P<0.05);与模型组比较,健胃消胀片组大鼠胃黏膜壁层细胞排列尚规整,未见明显杯状细胞增生和肠化生(见图3-k),血管充血现象已明显改善(见图3-l),炎症评分显著下降(P<0.01)。以上结果提示健胃消胀片治疗胃癌前病变大鼠后,胃组织癌前病变得到明显改善。

图3 各组大鼠胃组织HE染色结果(a、d、g、j,×200;b、c、e、f、h、i、k、l,×400)Figure 3 HE staining results of rat stomach tissues in each group(a,d,g,j,×200;b,c,e,f,h,i,k,l,×400)
表5 各组大鼠胃组织炎症评分比较Table 5 Comparison of inflammation scores of gastric tissues of rats among various groups()

表5 各组大鼠胃组织炎症评分比较Table 5 Comparison of inflammation scores of gastric tissues of rats among various groups()
注:①P<0.01,与正常组比较;②P<0.05,③P<0.01,与模型组比较
炎症评分/分0.0±0.0 9.0±0.8①6.0±0.8②4.3±0.5③组别正常组模型组叶酸组健胃消胀片组鼠数/只10 10 10 10
2.6 各组大鼠胃组织黏膜层厚度比较 图4、表6结果显示:模型组大鼠胃组织AB-PAS阳性表达层与正常组相比明显变薄,即胃保护屏障变薄,黏膜层厚度差异有统计学意义(P<0.05);与模型组比较,健胃消胀片组和叶酸组大鼠胃组织黏膜层增厚,其中,健胃消胀片组AB-PAS阳性表达程度高于叶酸组,且与模型组相比黏膜层厚度差异有统计学意义(P<0.05)。

图4 各组大鼠胃组织AB-PAS染色结果(×200)Figure 4 AB-PAS staining results of rat stomach tissues in each group(×200)
表6 各组大鼠胃组织黏膜层厚度比较Table 6 Comparison of the thickness of the mucous membrane layer in the gastric tissues of rats among various groups()
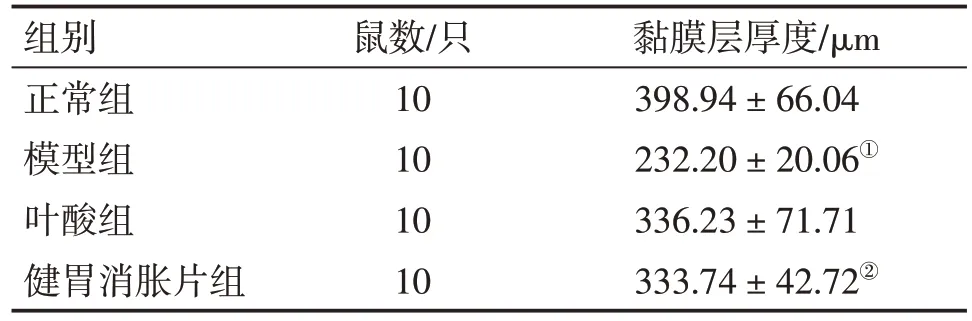
表6 各组大鼠胃组织黏膜层厚度比较Table 6 Comparison of the thickness of the mucous membrane layer in the gastric tissues of rats among various groups()
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较
黏膜层厚度/μm 398.94±66.04 232.20±20.06①336.23±71.71 333.74±42.72②组别正常组模型组叶酸组健胃消胀片组鼠数/只10 10 10 10
2. 7 各组大鼠胃组织PI3K-Akt-eNOS 通路相关蛋白表达比较 图5、表7 结果显示:与正常组比较,模型组大鼠胃组织PI3K、p-PI3K、Akt、p-Akt、eNOS 蛋白表达水平降低,其中PI3K、p-PI3K、p-Akt、eNOS 蛋白表达差异有统计学意义(P<0.01)。与模型组比较,叶酸组胃组织PI3K、p-PI3K、Akt、p-Akt、eNOS 蛋白表达升高,其中p-PI3K、Akt、p-Akt 蛋白表达差异有统计学意义(P<0.05 或P<0.01);健胃消胀片组胃组织PI3K、p-PI3K、Akt、p-Akt、eNOS 蛋白表达水平较模型组升高,其中p-PI3K、Akt、p-Akt、eNOS 蛋白表达差异有统计学意义(P<0.05或P<0.01)。
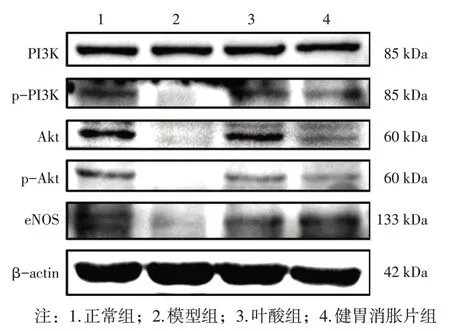
图5 各组大鼠胃组织PI3K、p-PI3K、Akt、p-Akt、eNOS蛋白的Western Blot条带Figure 5 Western Blot bands of PI3K,p-PI3K,Akt,p-Akt,and eNOS proteins in rat stomach tissues of each group
表7 各组大鼠胃组织PI3K-Akt-eNOS通路相关蛋白相对表达量比较Table 7 Comparison of relative expressions of PI3K-Akt-eNOS pathway-related proteins in gastric tissues of rats among various groups()

表7 各组大鼠胃组织PI3K-Akt-eNOS通路相关蛋白相对表达量比较Table 7 Comparison of relative expressions of PI3K-Akt-eNOS pathway-related proteins in gastric tissues of rats among various groups()
注:①P<0.01,与正常组比较;②P<0.05,③P<0.01,与模型组比较
组别正常组模型组叶酸组健胃消胀片组eNOS/β-actin 1.00±0.06 0.42±0.04①0.76±0.23 0.91±0.12②鼠数/只10 10 10 10 PI3K/β-actin 1.00±0.03 0.78±0.04①0.83±0.08 1.02±0.20 p-PI3K/β-actin 1.00±0.16 0.22±0.04①0.84±0.30②0.99±0.04③Akt/β-actin 1.00±0.36 0.34±0.13 1.10±0.19③0.85±0.04②p-Akt/β-actin 1.00±0.08 0.19±0.19①0.73±0.21②0.93±0.19③
2.8 各组大鼠胃组织VEGFA蛋白表达比较 为观察各组大鼠胃组织微血管生成和修复能力,利用免疫荧光染色法检测胃组织VEGFA 蛋白的表达。图6、表8 结果显示,与正常组比较,模型组大鼠胃组织VEGFA 蛋白表达水平显著下降(P<0.01),提示胃癌前病变大鼠胃组织血管生成与修复能力受损。与模型组比较,叶酸组胃组织VEGFA 蛋白表达水平升高(P<0.05),健胃消胀片组VEGFA蛋白表达水平显著升高(P<0.01),提示健胃消胀片治疗胃癌前病变大鼠后,能明显改善由癌前病变造成的大鼠胃组织血管生成与修复能力受损,且改善效果优于叶酸。

图6 各组大鼠胃组织VEGFA的免疫荧光染色结果(×200)Figure 6 Immunofluorescence staining results of VEGFA in the gastric tissues of rats in each group(×200)
表8 各组大鼠胃组织VEGFA蛋白阳性表达比较Table 8 Comparison of VEGFA protein positive expression in gastric tissues of rats among various groups()

表8 各组大鼠胃组织VEGFA蛋白阳性表达比较Table 8 Comparison of VEGFA protein positive expression in gastric tissues of rats among various groups()
注:①P<0.01,与正常组比较;②P<0.05,③P<0.01,与模型组比较
VEGFA阳性表达率/%24.00±1.44 5.80±1.14①9.75±2.01②17.44±1.26③组别正常组模型组叶酸组健胃消胀片组鼠数/只10 10 10 10
3 讨论
胃癌前病变是一个组织病理学概念,指相应的病理变化比正常组织或其他病理改变更易发生癌变,如胃黏膜上皮异型增生、肠上皮化生等。轻中度非典型增生经过及时治疗大部分会减轻或消退,因此,及早干预是非常有效的防癌措施。
中医认为,胃为六腑之一,以通为顺,满而不能藏。胃癌前病变相关症状多表现为胃动力减弱、腹胀隐痛等,既要消食导滞,更要从根本上强健脾胃,增加胃动力[13-15]。健胃消胀片是我院的院内制剂,临床治疗常见慢性胃病效果显著,相关的实验研究亦验证其药效。本研究进一步发现健胃消胀片能下调胃癌前病变大鼠血清中的胃泌素(GAS)含量、上调胃动素(MTL)和胰高血糖素(GC)含量,基于健胃消胀片具有行气消胀、健运脾胃的功效,提示其对胃癌前病变的改善作用可能与抑制溃疡、改善胃动力等机制有关。本研究病理分析结果显示,健胃消胀片能显著改善胃癌前病变大鼠胃部大体观病理变化及胃黏膜壁层细胞排列疏松、异常紊乱,胞核异形和杯状细胞增生、肠化生现象,并能改善炎症,药效结果优于叶酸。现代药理研究表明,叶酸通过增强胃黏膜DNA 甲基化状态、改善贫血等机制改善胃癌前病变[16-17],但叶酸会促进胃酸分泌,对胃的刺激性大。而本研究通过对胃组织病理形态的检查发现,健胃消胀片对胃癌前病变大鼠胃组织黏膜层细胞排列疏松、血管充血现象的改善作用优于叶酸;胃组织AB-PAS染色结果表明,健胃消胀片对胃癌前病变大鼠胃黏膜的修复作用亦优于叶酸,提示健胃消胀片对胃癌前病变的改善作用可能与其促进胃黏膜血液循环、保护黏液分泌功能细胞及加速黏膜屏障的重建有关。
持续的血管新生是肿瘤的基本特征之一,增殖活跃的肿瘤细胞分泌高水平的促血管生成因子,形成无序、不成熟、可渗透的肿瘤血管网络,肿瘤灌注受损,形成更利于肿瘤侵袭的缺氧微环境[18]。研究[19]表明,促进血管生成和修复能抑制胃癌癌前病变进程。PI3K-Akt-eNOS 信号通路是调控体内血管生成和修复的重要信号转导通路[20-22],该信号通路的激活可促进体内损伤组织的微血管生成和修复[23-26]。血管内皮细胞生长因子VEGFA是由VEGFA基因编码的蛋白质,该蛋白质是糖基化的有丝分裂原,其特异性地作用于内皮细胞,具有诱导血管生成和修复的作用[27]。本研究结果表明,胃癌前病变大鼠胃组织PI3K-Akt-eNOS通路相关蛋白表达水平均显著降低,VEGFA 蛋白表达亦显著下调,提示在胃癌前病变病理状态下PI3K-Akt-eNOS 通路被抑制,胃组织微血管生成和修复能力变差。而健胃消胀片能激活PI3K-AkteNOS 通路,使该通路相关蛋白表达水平升高,上调胃组织VEGFA 蛋白表达,表明健胃消胀片可能通过激活PI3K-Akt-eNOS 信号通路促进胃损伤组织的血管生成和修复能力,从而改善胃癌前病变。
综上所述,健胃消胀片对胃癌前病变大鼠的病理表征和胃组织损伤均有改善作用,其机制可能与激活PI3K-Akt-eNOS 信号通路从而改善胃损伤组织的血管生成和修复能力有关。本研究有待下一步进行前瞻性的临床研究,以论证健胃消胀片对胃癌相关病变的治疗效果。但鉴于胃癌前病变是一个漫长的过程,PI3K-Akt-eNOS信号通路的调控作用是否发生在胃癌前病变整个阶段与其是否与胃癌细胞的转移有关仍不清楚,这也是本课题将重点研究的方向。

