基于TCGA研究左右半结肠癌基因表达差异及苦参-大血藤-半枝莲作用机制
刘菁菁, 张恩欣
(1.广州中医药大学第一临床医学院,广东广州 510405;2.深圳市宝安纯中医治疗医院,广东深圳 518100)
基于左、右半结肠在生理功能、解剖学、胚胎学等方面的差异,左、右半结肠癌的临床症状、治疗反应性及预后等方面均存在显著差异。如:左半结肠癌常见梗阻、血便,右半结肠癌常见腹胀、腹痛等非特异性症状;对比左半结肠癌,右半结肠癌对人表皮生长因子受体(EGFR)和西妥昔单抗疗效反应欠佳;右半转移性结肠癌预后明显差于左半转移性结肠癌[1]。由于恶性肿瘤是致瘤因素作用下局部组织细胞在基因水平对细胞增殖失控导致的单克隆性增殖疾病,故本研究尝试利用癌症基因组图谱(TCGA)分析左、右半结肠癌的基因表达差异,从基因层面解释左、右半结肠癌的临床差异。
另一方面,已有研究通过挖掘肠癌方剂数据库筛选出中医治疗大肠癌的核心药对苦参-大血藤-半枝莲[2],该药对具有抗癌解毒、湿毒并治的功效特点,作为肠癌的辨病治疗专药意义重大。但该药对在左右半结肠癌的治疗效果及机制方面是否存在差异尚有待研究,故本研究拟通过网络药理学结合左右半结肠癌差异表达基因筛选的方法探究其具体机制,现将研究结果报道如下。
1 资料与方法
1.1 数据收集 利用TCGA下载工具gdc-client按照样本来源部位分别下载左、右半结肠癌及相应癌旁组织的转录组高通量测序计数(highthroughput sequencing counts,HTSeq counts)。
1.2 数据处理 利用R 4.1.0的rjson包提取下载样本的条形码(barcode);利用R 提取Ensemble ID 在每一个barcode 中的表达量;通过gencodgenes 数据库下载人类参考基因组GRch38基因注释文件,基于该注释文件,将Ensemble ID 转换为基因名(Gene Symbol),最终获得Gene Symbol 在每个barcode 代表样本的计数矩阵。利用R 的stringR包,根据样本barcode 区分癌组织与癌旁组织,设置癌组织为实验组,癌旁组织为对照组。
1. 3 差异基因分析及统计方法 应用统计方法R 包DESeq2[3]处理计数矩阵,设筛选条件为P<0.05,差异倍数绝对值|Abs(log2FoldChange)|>1,分别筛选左半结肠癌实验组与对照组,右半结肠癌实验组与对照组的差异基因, 并根据log2FoldChange 的正负值标注基因上调、下调情况,应用edgeR 包[4]对上述结果进行验证,筛选条件同上,最终筛选出两种统计学方法共同提示差异表达,且上调、下调一致的基因标定为差异基因,根据差异基因来源分别构建差异基因数据集,绘制火山图。将筛选得出包含基因上调及下调信息的左半结肠癌与右半结肠癌差异基因数据集通过R的VennDiagram[5]提取交集并绘制韦恩图。
1. 4 差异基因过表征分析(Over-Representation Analysis,ORA) 利用R 软件Clusterprofiler 包[6]的富集KEGG功能分别对左半结肠癌差异基因、右半结肠癌差异基因、共同差异基因进行ORA KEGG富集分析,筛选差异基因富集的生物学过程,应用R 的“enrichplot”功能,分别绘制条形图、气泡图,筛选与发病相关的左、右半结肠癌特异性通路及共同通路。
1. 5 差异基因富集分析(Gene Set Enrichment Analysis,GSEA) 由于ORA 法不考虑基因表达的差异程度[7],故对左/右半结肠癌差异基因数据集分别补充GSEA KEGG[8]富集分析,差异基因的Abs(log2FoldChange)可反映基因表达的差异程度,其取值均选择来自DESeq2,根据结果筛选与发病相关的左、右半结肠癌特异性通路及共同通路作为补充。
1.6 基于左右半结肠癌差异表达基因的肠癌核心药对网络药理学研究 利用BATMAN-TCM[9]设置筛选条件Score cutoff>20,P<0.05,构建苦参-大血藤-半枝莲药对活性成分-靶点数据集,利用Cytoscape 3.7.2 软件构建药对活性成分-靶点可视化网络,筛选核心化合物。利用VennDiagram提取药对靶点数据集与“1.3”项中左、右半结肠癌疾病靶点的交集,在线绘制蛋白质互作(PPI)网络,筛选核心靶点,并对核心靶点进行ORA KEGG富集分析,探讨药对治疗左、右半结肠癌的机制差异。
2 结果
2.1 数据收集 利用TCGA 数据库下载左半结肠癌、右半结肠癌的HTSeq counts文件。最终纳入研究的病例数为328 例。其中左半结肠癌组134 例,包括乙状结肠112 例,降结肠17 例,横结肠左侧1/3(包含结肠脾曲)5例。右半结肠癌组194例,包括盲肠95 例,升结肠84 例,横结肠右侧2/3(包括结肠肝曲)15例。
2. 2 数据处理 利用R 提取barcode,基于GRch38 注释文件实现Ensemble ID 到Gene Symbol转换,结果显示左半结肠癌组的barcode 共计150 个,对应的组织样本数为150 个,表达基因55 277种,右半结肠癌组的barcode共计221个,对应的组织样本数为221 个,表达基因55 277 种。R 软件通过stringR 包实现癌组织与癌旁组织区分。最终显示150 个左半结肠癌组织中癌组织140 个(左半实验组),癌旁组织10 个(左半对照组),221 个右半结肠癌组织中癌组织204 个(右半实验组),癌旁组织17个(右半对照组)。
2.3 差异基因分析 分别对左半实验组与左半对照组、右半实验组与右半对照组进行DESeq2 分析,edgeR 验证,绘制火山图(见图1)。结果显示:左半结肠癌差异基因共8 009 个,其中上调4 685 个,下调3 324 个;右半结肠癌差异基因共7 790 个,其中上调4 629 个,下调3 161 个。R 软件VennDiagram包提取上述两差异基因数据集的交集,得到韦恩图(见图2),重叠部分提示左半结肠癌与右半结肠癌相对于正常癌旁组织共同的差异表达基因共6 051个,左半结肠侧非重叠部分提示左半结肠癌特异性的差异表达基因共1 958个,右半结肠侧非重叠部分提示右半结肠癌特异性的差异表达基因共1 739个。其中LINC02889、SAX02、HOXB13基因在左右半结肠癌均有表达,但在右半结肠癌表现为上调,左半结肠癌表现为下调,同计为特异性的差异基因。

图1 左/右半结肠癌差异基因火山图Figure 1 Volcano map of differential genes for left/right-sided colon cancers

图2 左、右半结肠癌差异基因韦恩图Figure 2 Venn diagram of differential genes for leftsided and right sided colon cancer
2.4 差异基因过表征分析 对“2.3”项获取的差异基因进行ORA KEGG 富集分析,通过enrichplot功能分别实现左半结肠癌特异性差异基因、右半结肠癌特异性差异基因、共同差异基因结果的可视化。结果显示:左半结肠癌特异性差异基因富集的生物信号通路包含T 细胞受体信号通路、Th1和Th2细胞分化通路等共10条(见图3);右半结肠癌特异性富集的生物信号通路包含色氨酸代谢通路与酒精中毒等共7 条(见图4);左右半结肠癌共同的差异基因表达共富集于44 条信号通路(见图5),其中,PI3K-Akt 信号通路、Ras 信号通路、Wnt信号通路等均为涉及人类肿瘤疾病发生发展的重要信号通路,提示上述通路在结肠癌发病过程中的非特异性作用。

图3 左半结肠癌差异基因富集通路条形图Figure 3 Bar graph of differential gene enrichment pathway in left-sided colon cancer

图4 右半结肠癌差异基因富集通路条形图Figure 4 Bar graph of differential gene enrichment pathway in right-sided colon cancer

图5 左右半结肠癌共同差异基因富集通路条形图(P值前25条)Figure 5 Bar graph of common differential geneenriched pathways in left-and right-sided colon cancers(top 25 P-values)
2.5 差异基因富集分析 基于基因表达的差异程度利用R 软件实现GSEA KEGG 富集分析,将结果可视化。得到左半结肠癌差异基因富集通路共35 条(见图6),右半结肠癌组织差异基因富集通路共48 条(见图7),其中共同通路30 条,左半结肠癌特异性通路5条,右半结肠癌特异性通路18条。

图6 左半结肠癌差异基因富集通路(GSEA)山脊图Figure 6 Ridge map of Gene Set Enrichment Analysis(GSEA)of differential gene-enriched pathways in leftsided colon cancers

图7 右半结肠癌差异基因富集通路(GSEA)山脊图Figure 7 Ridge map of Gene Set Enrichment Analysis(GSEA)of differential gene-enriched pathways in rightsided colon cancers
2.6 基于左右半结肠癌差异基因表达的肠癌核心药对网络药理学研究 利用BATMAN-TCM 数据库,得到苦参活性化合物73种,对应靶点382个,大血藤活性化合物3种,对应靶点117个,半枝莲活性化合物9 种,对应靶点55 个,构成药对后靶点合计469 个。利用Cytoscape 3.7.2 软件构建药对活性化合物-靶点可视化网络(见图8),筛选核心化合物。根据度(Degree)值计算出核心化合物:壬酸(Degree =107)、癸酸(Degree =107)、月桂酸(Degree=107)、谷甾醇(Degree = 102)、羽扇豆酮(Degree=54)等,上述化合物可能为药对发挥作用的主要成分。利用VennDiagram 提取药对-疾病共同靶点,结果显示,药对-左半结肠癌靶点交集184 个,药对-右半结肠癌靶点交集185 个。利用ORA KEGG 法,分析药物-疾病靶点富集的生物通路,得到药对-左半结肠癌富集通路46 条,药对-右半结肠癌富集通路37 条,绘制气泡图(见图9)。结果显示:共同通路36 条,药对-左半结肠癌特异性通路10 条,药对-右半结肠癌特异性通路1 条。利用String 数据库[10]在线构建PPI 网络(见图10、图11),利用Cytoscape 的CytohHub 插件根据Degree 筛选核心蛋白,列举左半结肠癌、右半结肠癌核心蛋白前20位(见表1)。

表1 药对-结肠癌核心蛋白Table 1 Drug pair-colon cancer core protein

图8 药对活性化合物-靶点网络图Figure 8 Drug-pair active compounds-target networks map
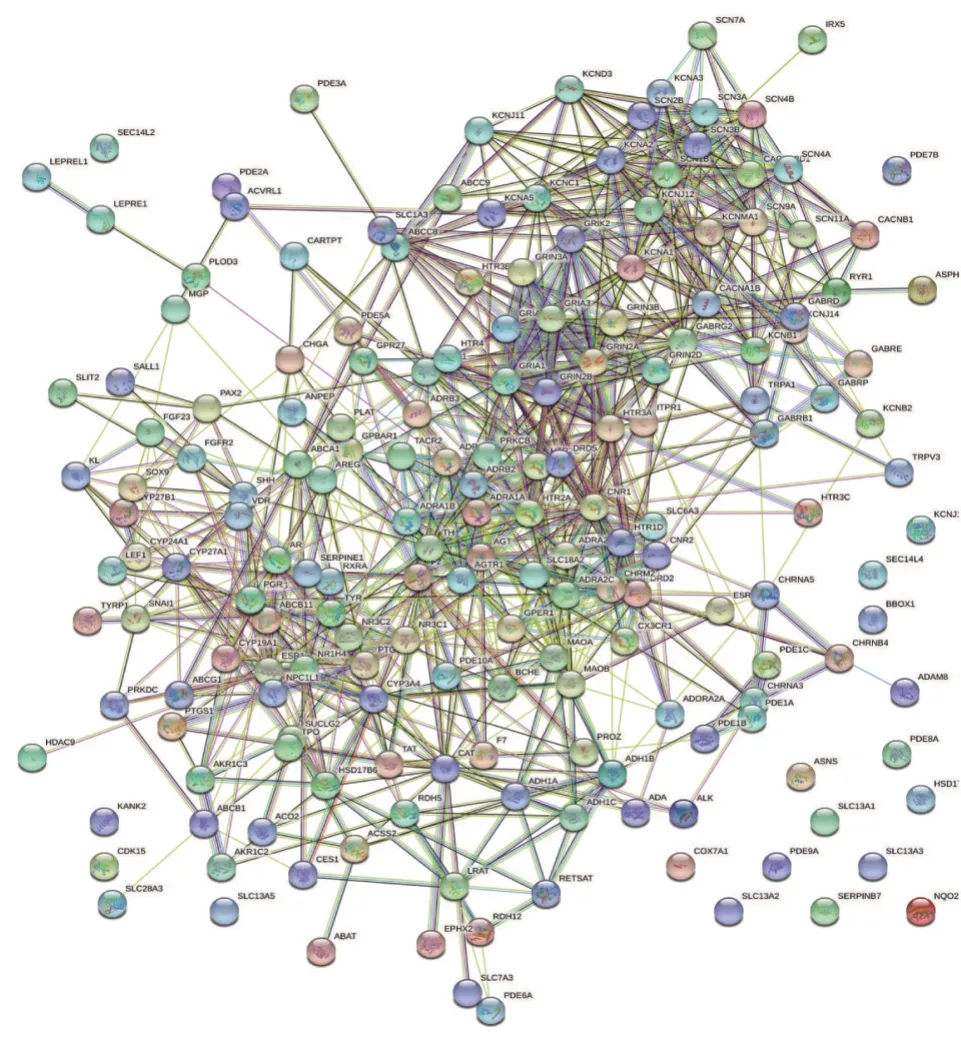
图11 药对-右半结肠癌PPI网络Figure 11 PPI network of drug pair-right-sided colon cancer
3 讨论
3.1 左右半结肠癌差异表达基因富集通路分析 在分子生物学特征分析中,本研究通过ORA 法发现左半结肠癌的特异性差异基因主要富集在以下10 条信号通路:金黄色葡萄球菌感染、造血细胞谱系、同种异体移植排斥反应、移植物抗宿主病、细胞黏附分子、Th1和Th2细胞分化、Ⅰ型糖尿病、T细胞受体信号通路、胆碱能突触、自身免疫性甲状腺疾病。以上通路揭示免疫机制异常可能参与左半结肠癌的发病过程。其中,T细胞受体信号通路参与机体T 淋巴细胞的活化过程,包括CD28 等在内的共信号分子与T 细胞受体有效结合才能使T淋巴细胞正常活化,进而发挥细胞免疫功能[11]。在该通路中,本研究结果显示,左半结肠癌组织的T 细胞共信号分子CD28、T 细胞表面抗原CD4,体细胞激酶IL2 及直接参与免疫反应的IL10等10 余种分子表达水平均较正常组织显著下调,提示细胞免疫功能抑制可能参与左半结肠癌发病。另有相关研究显示,共信号分子CD28与临床广泛应用的程序性死亡受体1 类药物(PD-1)通路存在互作关系,阻断CD28 分子或剔除CD28 基因均阻断PD-1作用后T细胞的增殖过程,影响PD-1疗效[12],故CD28 与左半结肠癌发病及免疫检查点抑制剂疗效的关系有待进一步行单基因研究探析。左半结肠癌富集的其余通路表明,其发病可能与自身免疫类疾病相关。相关研究显示,20%~40%的炎性肠病会发展为炎性肠病相关性结直肠癌,其关键通路可能涉及核因子κB 通路[13],但炎性肠病相关性结肠癌是否在左半结肠癌与右半结肠癌存在明显差异仍有待进一步研究。另一方面,本研究基于基因差异程度通过GSEA法补充发现了左半结肠癌的5条特异性信号通路,其中单磷酸腺苷激活的蛋白激酶(AMPK)通路在癌症、糖尿病等疾病中发挥着重要作用。目前,学术界对AMPK通路存在两种相反观点,即AMPK通路中的不同亚通路可能同时介导了促进或抑制肿瘤的生长、转移、血管生成两种相反的生物功能。最新研究[14]显示,AMPK促癌或抑癌的效应可能取决于肿瘤的发展阶段,在肿瘤前期可能起抑制效应,在肿瘤形成后则表现为促瘤效应。本研究结果显示,左半结肠癌组织中包括AMPK、IGF1、mTORC2 在内的14 种分子表达水平均下调,可能与肿瘤生长过程中AMPK 抑瘤功能的激活相关,而作为AMPK 激动剂的二甲双胍目前被多项整合研究发现可降低多种肿瘤发病风险[15],其在左半结肠癌的辅助疗法应用价值有待进一步挖掘。
同时,本研究基于ORA 法发现,右半结肠癌差异基因富集于以下7条通路:中性粒细胞外陷阱形成(NET formation)、系统性红斑狼疮、病毒蛋白与细胞因子及细胞因子受体的相互作用、酒精中毒、金黄色葡萄球菌感染、细胞因子-细胞因子受体的相互作用、色氨酸代谢。经相关文献研究分析,中性粒细胞外陷阱形成、酒精中毒信号通路可能与右半结肠癌疾病进程存在相关性。中性粒细胞外陷阱形成是中性粒细胞释放其去浓缩染色质并形成细胞外DNA 网络的生物过程,既往研究揭示其广泛参与感染及炎性疾病[16]。而随着研究深入,有一定数量的研究显示该生物过程同样可被肿瘤类疾病诱导并促进肿瘤进展,其促瘤机制可能与中性粒细胞诱导肿瘤微环境中的基质金属蛋白酶9(MMP9)、制瘤素M(OSM)活性进而促使肿瘤发生浸润、转移、血管生成的生物学行为相关[17-18]。作为中性粒细胞外陷阱形成过程的重要标志物瓜氨酸化组蛋白H3(citH3)在肿瘤患者中显著提高,citH3 升高提高了肿瘤患者的死亡风险,表明中性粒细胞外陷阱形成提示肿瘤疾病预后不良[19],为右半结肠癌的预后评估提供了具有研究价值的生物标志物。本研究中富集于该通路的28 个分子有26个显著上调,其中包括citH3,进一步证明中性粒细胞外陷阱形成生物过程可能密切参与右半结肠癌的发生发展,其产物citH3对右半结肠癌可能是评估预后的有效生物学标志。目前已有较大量的研究支持结肠癌的危险因素包括遗传、饮食、炎性肠病、微量元素失衡等,另有27 项队列研究显示酒精暴露使结直肠癌患癌风险升高1~1.7 倍[20];但目前暂无研究明确酒精暴露与结肠癌发病位置的相关性。故基于本研究富集通路结果可进一步开展左右半结肠癌基于酒精暴露的危险因素分析。作为补充的GSEA 分析共富集18 条信号通路,其中中性粒细胞外陷阱形成通路同样被GSEA法富集,再次证明中性粒细胞外陷阱形成通路可能与右半结肠癌相关。在18条通路中,Hippo信号通路对肠稳态起重要作用,Hippo通路的失调控可导致肠上皮的恶性转化,其机制与Hippo信号通路上的YAP/TAZ 效应蛋白表达上调及与Wnt 通路形成交叉作用有关,在肿瘤形成后,YAP 的上调又直接介导了结肠癌细胞对化疗药物5-氟尿嘧啶、抗EGFR 单抗西妥昔单抗等常用药物的耐药性[21-22]。在本研究中,右半结肠癌样本有23个富集于该通路的蛋白水平显著上调,其中包括YAP/TAZ 的正向调控因子TEA 结构域转录因子、交叉通路WNT 通路的受体蛋白FZD 及下游经典癌基因MYC 编码的DNA 结合蛋白,因此认为右半结肠癌的Hippo通路存在明显异常。目前较多的回顾性研究数据显示右半结肠癌预后明显差于左半结肠癌,且右半结肠癌使用西妥昔单抗的疗效差于左半结肠癌,这与本研究发现的右半结肠癌差异基因特异性富集于Hippo 通路结果具有一致性。Hippo通路异常可能是左、右结肠癌在预后及药物反应性上存在差异的机制之一。
3.2 肠癌核心药对治疗左右半结肠癌的机制探析 苦参-大血藤-半枝莲药对是基于《肿瘤方剂大辞典》《肿瘤良方大全》《中国药典》等构建的大肠癌方剂数据库,严格采用支持度、置信度等统计参数筛选得到的肠癌核心药对。在线数据库获得的该药对活性成分主要包括苦参碱、氧化苦参碱、苦参黄酮、马尾藻甾醇、大黄素、汉黄芩素、野黄芩素、异红花素等,与目前已有的药理学研究高度一致,表明此研究结果具有参考价值。
构建的活性化合物-靶点可视化网络图提示壬酸、癸酸、月桂酸、谷甾醇、羽扇豆酮等成分为药对的核心化合物成分。有研究[23]显示,月桂酸、癸酸、壬酸等中链饱和脂肪酸可靶向下调EGFR 1.33~1.58 倍,进而介导结肠癌细胞系HCT-15 凋亡,其抗肿瘤作用具有靶向性。有关植物甾醇类的动物模型实验[24]显示,包括谷甾醇在内的植物甾醇类可通过抑制细胞周期、诱导细胞凋亡等机制发挥抗结肠癌作用。又有纳入1 802例结直肠癌与1 813 例对照的病例对照研究[25]显示,既往植物甾醇总摄入量与结肠癌发病风险呈负相关,摄入植物甾醇可降低结直肠癌发病风险,揭示谷甾醇在内的植物甾醇类对结肠癌的“治未病”价值。羽扇豆酮被相关研究证实具有抗白血病细胞增殖作用[26],但其具体抗癌机制仍有待进一步挖掘。
根据KEGG富集分析结果,药对治疗结肠癌的生物过程是复杂的,充分体现了中药多靶点、多通路干预疾病的特点。在药对干预左右半结肠癌的非特异性通路中主要有涉及调控细胞周期的通路,包括环磷酸鸟苷-蛋白激酶G(cGMP-PKG)通路、环磷酸腺苷(cAMP)通路、钙信号通路,必需氨基酸代谢通路包括苯丙氨酸代谢、酪氨酸代谢通路。提示药对可能通过上述通路对结肠癌产生非特异性的治疗作用。细胞周期相关通路方面,cGMP-PKG通路参与细胞周期调控及逆转EGFR磷酸化的生物过程,其机制与PKG 逆转EGF 激活MAPK/ERK 通路相关[27]。cAMP 通路广泛参与细胞增殖、分化及凋亡的调控,并以下游效应因子PKA 介导主要生物学功能。相关研究显示,在恶性肿瘤细胞中,cAMP失去其双向调控细胞周期的作用,转而表现为促肿瘤细胞存活作用,其机制可能与cAMP 抑制肿瘤坏死因子α(TNF-α)诱导肿瘤细胞死亡相关[28-29]。钙信号通路则可通过诱导Caspase-12 促细胞凋亡[30]。相关研究[31]显示,多种肿瘤细胞的钙信号通路基因存在异常DNA 甲基化,其介导了肿瘤细胞中的钙离子浓聚,并为细胞增殖提供条件。必需氨基酸代谢通路方面,肿瘤细胞普遍存在对必需氨基酸的增强吸收现象,包括研究发现的苯丙氨酸、酪氨酸在内必需氨基酸异常代谢均促进肿瘤恶性发展[32]。故本药对还可通过影响必需氨基酸代谢途径参与疾病治疗。
药对治疗左半结肠癌的特异性通路共有10条,主要富集于涉及内分泌功能的信号通路及1条胃癌特异性通路,除外胃肠道的外分泌功能,伴随相关研究进展,胃肠道作为“机体最大的内分泌器官”的概念被逐渐接受[33],生理状态下的胃肠道内分泌细胞分泌包括胃泌素在内的肽类激素,并介导胃酸、胰岛素、生长激素、皮质激素等释放,肠道内分泌细胞的肿瘤转化则可表现出神经内分泌特征表型的肿瘤,临床以神经内分泌功能异常为主要表现[34]。药对可能基于调节肠道内分泌功能对左半结肠癌产生治疗效应,但结论目前缺乏相关研究支持,有待进一步验证。
药对治疗右半结肠癌富集的特异性通路为1 条,该通路主要参与瞬时受体电位(TRP)介导的炎症反应[35]。特异性富集于该通路的原因可能与右半结肠癌的生理功能有关,由于右侧结肠具有较强的吸收功能,肿瘤坏死缺血合并感染后病原体产生的毒素易被吸收进而引发感染性炎症,故本药对在右半结肠癌的治疗中可能发挥较强的抗炎作用。
基于PPI 网络的分析结果显示,药对作用的左、右半结肠癌的关键靶点存在一定的差异,在两个PPI 网络的前20 位中,药对治疗的共同关键靶点有13个,左、右半结肠癌特异性靶点各7个。但本研究结果发现,不论左半结肠癌还是右半结肠癌的关键靶点所编码的蛋白在功能上都较多地参与了机体的精神情绪调控,其中包括DRD2、MAOA、 MAOB、 HTR3A、 HTR2A、 GRIN2A、GRIN2B、SLC6A3、SLC6A4等[36-38],揭示本药对可能通过调控精神情绪活动参与结肠癌治疗过程。中医学较早地认识到情志因素在恶性肿瘤发病的作用,即宋代严用和所言“忧、思、喜、怒之气,人之所不能无者,过则伤五脏,……留结而为五积”,情志抑郁常致肝失疏泄,气机失调气血壅滞,致生肿瘤类疾病。且恶性肿瘤发病后不良情绪与疲乏、消化道症状等存在互作关系,影响生活质量[39],即中医学认为的情志抑郁,肝失疏泄,脾胃失去运化与升降也。故本药对除外抗肿瘤效应的情绪调控作用亦具有临床应用意义。
综上所述,左、右半结肠癌在基因表达与生物信号通路两个层面的差异,左半结肠癌可能与免疫功能异常、AMPK通路等生物过程相关,而右半结肠癌可能与中性粒细胞外陷阱形成、酒精中毒、Hippo通路等生物过程相关。除调控细胞周期及必需氨基酸代谢等机制外,苦参-大血藤-半枝莲药对治疗左半结肠癌具有调节肠道内分泌功能的特异性作用,对右半结肠癌的炎症反应具有特异性治疗作用,且可能对结肠癌患者具有情绪调控作用。相关研究有待进一步开展。

