基于AMPK/mTOR信号通路探究下调miR-34a对非酒精性脂肪肝大鼠的干预效果
代宇 范伟
(贵州省人民医院肝胆外科,贵州 贵阳 550002)
非酒精性脂肪肝(NAFLD)属于较常见的慢性肝病,随着物质生活提升,其发病率不断升高,表现为肝细胞脂肪过度沉淀及脂肪样变化,后期可能发展为肝硬化〔1,2〕。NAFLD不仅仅归类于肝脏疾病,更属于全身代谢类疾病,与高血压、糖尿病等多种疾病存在关联〔3〕。miR-34a与肝脏疾病具有显著相关性,参与脂质代谢的过程〔4〕。研究显示〔5〕,自噬可以降解肝细胞内脂滴,减轻肝脏脂质蓄积,进而改善肝功能,降低胆固醇水平,而AMP活化蛋白激酶(AMPK)/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路属于自噬相关信号通路。本研究探究AMPK/mTOR下调miR-34a对NAFLD大鼠的干预效果。
1 材料与方法
1.1实验动物 选取43只雄性SD大鼠,体质量180~213 g,平均(195.94±10.26)g,鼠龄(8.21±0.64)个月,生产许可证号:SCXK(粤)2020-0055;使用许可证号:SYXK(粤)2020-0242;购自广州赛业百沐生物科技有限公司,标准饲养,自由饮水,在相对湿度为30%~35%、温度为(23.51±1.51)℃下饲养1 w,阴暗交替12 h/12 h,本次实验操作均严格按照动物实验伦理相关要求进行。
1.2主要试剂 miR-34a慢病毒(上海吉凯基因化学技术有限公司),逆转录试剂盒(美国Fermentas公司),三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)检测试剂盒(南京建成生物工程研究所),兔抗小鼠单克隆抗体磷酸化(p)-mTOR、p-AMPK(Cell Signal公司),苏木素染液(武汉赛维尔生物科技有限公司),二喹啉甲酸(BCA)蛋白浓度试剂盒(上海碧云天生物技术有限公司)。
1.3主要仪器 冰冻切片机(德国Leica公司),病理组织包埋机(安徽电子科学研究所,型号:BM-Ⅱ型),高速冷冻离心机(德国Hettich公司),血糖仪及配套试纸(强生医疗器材有限公司)。
1.4miR-34a慢病毒载体构建 获取基因序列,构建miR-34a沉默转染质粒、miR-34a过表达转染质粒,设计并合成,并做慢病毒滴度测定(病毒滴度为5×108TU/ml)。
1.5动物造模〔6〕、分组及转染 大鼠适应性喂养7 d随机选取10只作为空白组,自由饮水,给予普通饲料,其余大鼠进行NAFLD模型建立,均自由饮水,给予高脂饲料(包含84%的基础饲料,4%蛋黄粉,10%猪油,2%胆固醇),进行喂养。选取造模大鼠2只,处死,通过肝组织病理苏木素-伊红(HE)染色确定造模成功,将30只造模成功的大鼠随机分为模型组、上调miR-34a组、下调miR-34a组,将10 μl miR-34a过表达慢病毒悬液、miR-34a沉默慢病毒悬液分别静脉注入上调miR-34a组、下调miR-34a组大鼠尾部,空白组、模型组注射同剂量的蒸馏水。各组大鼠均干预4 w后进行后续实验。
1.6葡萄糖耐受试验(OGTT) OGTT前大鼠禁食12 h,进行操作时在各组大鼠腹腔内注射2 g/kg的葡糖糖,0、30、60、120 min采集尾部静脉血,使用血糖仪进行血糖浓度的检查,并绘制浓度曲线,计算曲线下面积(AUC)。
1.7血清中生化指标检测 各组大鼠进行麻醉,取尾部静脉血,3 000 r/min离心10 min,离心半径5 cm,取上层血清,测定血清中TC、TG、LDL-C、HDL-C、空腹胰岛素(FINS)含量,计算胰岛素抵抗指数(HOMA-IR)。
1.8脏器系数 取各组大鼠进行脱臼处死,取肝脏、胰腺,称质量,脏器系数=脏器湿质量(g)/体质量(g)×100%。
1.9miR-34a转染效率鉴定 取各组大鼠肝组织,应用TRIzoI进行提取总RNA,依照反转录试剂盒转录为cDNA,PCR条件为:95 ℃10 s,95 ℃变性5 s,55 ℃退火,60 ℃延伸34 s,共40个循环,miR-34a上游引物5′-TCGTGACTGGGATGCTGC-3′,下游5′-TCGGCATGCATTGATTGC-3′。以β-actin基因为内参,β-actin 基因上游引物5′-CACGATGGAGGGGCCGGACTCATC-3′,下游5′-TAAAGACCTCTATGCCAACACAGT-3′。采用2-△△Ct方法计算出miR-34a的表达量。
1.10病理学观察 取各组大鼠相同肝组织,采用10%甲醛进行固定,脱水、包埋、切片,行HE染色,观察大鼠脂肪变性、小叶炎症、气球样变,评估标准依照NAFLD活动度积分(NAS)评分,标准为:(1)肝细胞呈现脂肪变性:<5%为0分;5%~33%为1分;34%~66%为2分;>66%为3分。(2)肝小叶内炎症程度:无为0分;<2个为1分;2~4个为2分;>4个为3分。(3)肝细胞呈气球样变性:无为0分;少见为1分;多见为2分。
1.11AMPK/mTOR信号通路相对蛋白表达量 Western印迹检测大鼠肝组织 AMPK、mTOR蛋白表达,加入裂解液进行组织蛋白提取,用BCA法测定各样本蛋白浓度,检测蛋白浓度,将样品上样至8%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶上,经电泳后转移至聚偏氟乙烯(PVDF)膜上,用磷酸盐缓冲液(PBS)封闭2 h后,加入分别加入兔抗p-mTOR、p-AMPK、β-actin抗体,4 ℃孵育过夜,洗膜,加二抗,室温孵育60 min。重复试验5次,显色曝光,计算目的蛋白的相对表达量。
1.12统计学处理 采用SPSS19.0软件进行配对t检验、χ2检验。
2 结 果
2.1病理学观察 如图1所示,空白组肝脏膜完整,肝索排列整齐,肝细胞形态正常细胞核大、圆,居于中,无病理变化;模型组肝索排列较为凌乱,肝细胞呈现较为严重的脂肪变性,细胞结构较为模糊不清,细胞核缩小,炎性细胞浸润较为明显;下调miR-34a组肝细胞脂肪变性严重,细胞结构模糊,炎性细胞浸润非常明显;上调miR-34a组肝索形态相对较齐,肝细胞脂肪变性较轻微,病理变化较轻。

图1 各组肝组织病理特征(HE染色,×400)
2.2miR-34a转染效率鉴定 如表1所示,与空白组相比,模型组、下调miR-34a组、上调miR-34a组miR-34a表达量上升,具有统计学差异(P<0.05);与模型组相比,上调miR-34a组miR-34a表达量升高,下调miR-34a组miR-34a表达量下降,具有统计学差异(P<0.05);与上调miR-34a组相比,下调miR-34a组miR-34a表达量下降,具有统计学差异(P<0.05),说明转染成功。
2.3各组活动度积分对比 如表1所示,与空白组相比,模型组、下调miR-34a组、上调miR-34a组肝脏系数、脂肪变性、小叶内炎症、气球样变积分均上升,具有统计学差异(P<0.05);与模型组相比,上调miR-34a组肝脏系数、脂肪变性、小叶内炎症、气球样变积分升高,下调miR-34a组肝脏系数、脂肪变性、小叶内炎症、气球样变积分下降,具有统计学差异(P<0.05);与上调miR-34a组相比,下调miR-34a组肝脏系数、脂肪变性、小叶内炎症、气球样变积分下降,具有统计学差异(P<0.05),说明下调miR-34a可改善大鼠肝脏病变。
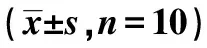
表1 各组miR-34a转染效率鉴定、活动度积分对比
2.4各组血脂水平对比 如表2所示,与空白组相比,模型组、下调miR-34a组、上调miR-34a组TC、TG、LDL-C水平均上升,HDL-C水平降低,具有统计学差异(P<0.05);与模型组相比,上调miR-34a组TC、TG、LDL-C水平均上升,HDL-C水平降低,下调miR-34a组TC、TG、LDL-C水平均降低,HDL-C水平上升,具有统计学差异(P<0.05);与上调miR-34a组相比,下调miR-34a组TC、TG、LDL-C水平均降低,HDL-C水平上升,具有统计学差异(P<0.05),说明下调miR-34a对血脂紊乱调控效果较好。
2.5各组血糖水平及AUC比较 如表2所示,与空白组相比,模型组、下调miR-34a组、上调miR-34a组血糖、AUC均上升,具有统计学差异(P<0.05);与模型组相比,上调miR-34a组血糖、AUC水平均上升,下调miR-34a组血糖、AUC水平均降低,具有统计学差异(P<0.05);与上调miR-34a组相比,下调miR-34a组血糖、AUC水平均降低,具有统计学差异(P<0.05)。
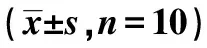
表2 各组血脂、血糖水平、AUC对比
2.6各组胰腺系数、FINS、HOMA-IR对比 如表3所示,与空白组相比,模型组、下调miR-34a组、上调miR-34a组胰腺系数、FINS、HOMA-IR均上升,具有统计学差异(P<0.05);与模型组相比,上调miR-34a组胰腺系数、FINS、HOMA-IR均上升,下调miR-34a组胰腺系数、FINS、HOMA-IR均降低,具有统计学差异(P<0.05);与上调miR-34a组相比,下调miR-34a组胰腺系数、FINS、HOMA-IR均降低,具有统计学差异(P<0.05),说明下调miR-34a可减轻胰岛素抵抗,提高口服糖耐量。
2.7各组AMPK/mTOR信号通路相对蛋白表达量对比 如表3、图2所示,与空白组相比,模型组、下调miR-34a组、上调miR-34a组AMPK表达降低,mTOR表达上升,具有统计学差异(P<0.05);与模型组相比,上调miR-34a组AMPK表达降低,mTOR表达上升,下调miR-34a组AMPK表达上升,mTOR表达降低,具有统计学差异(P<0.05);与上调miR-34a组相比,下调miR-34a组AMPK表达上升,mTOR表达降低,具有统计学差异(P<0.05)。
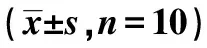
表3 各组胰腺系数、FINS、HOMA-IR、AMPK/mTOR信号通路相对蛋白表达量对比

图2 各组AMPK/mTOR信号通路蛋白表达
3 讨 论
NAFLD发病属于一种多因素进行相互作用的过程,其机制可能为胰岛素抵抗引起的肝脏TG积聚或脂肪变,肝细胞敏感性增高,能量代谢失衡,促进NAFLD的发生进展〔7~10〕。
研究指出〔11〕,NAFLD的发生与脂质代谢、炎症反应高度相关。肝脏是脂质代谢的主要场所,脂质异常合成或分解时,沉积于肝细胞,进而导致NAFLD发生。研究显示〔12〕,通过构建NAFLD小鼠模型,检测小鼠肝组织中miR-34a的表达情况,结果显示,NAFLD小鼠肝组织中miR-34a表达异常上调。另有研究指出〔13〕,通过抑制miR-34a表达,肝细胞中脂滴沉积显著减少。上述研究提示,在NAFLD肝组织中miR-34a表达异常上升,抑制miR-34a表达可延缓疾病进展。本文研究结果显示,下调miR-34a后可干预NAFLD大鼠病情的发展,HE染色指出高脂饮食可引起大鼠脂肪肝病变,经下调miR-34a干预后,脂肪病变得到缓解。有研究指出〔14〕,高脂饮食患者摄入较多的脂肪,易引起血浆中脂肪酸上升,导致胰岛素抵抗,血液中TG、LDL-C等会发生异常升高,进而脂质代谢发生紊乱。肝脏累积大量脂肪后,脂质发生过氧化,肝细胞凋亡,进展为肝纤维化等疾病,严重可致肝硬化或肝癌〔15,16〕。本研究结果表明,下调miR-34a能调控血脂紊乱,进而改善胰岛素抵抗。
AMPK为细胞能量代谢的重要因子,在NAFLD的发生发展中占据较为重要地位,活化AMPK进行合成代谢的抑制,促进分解代谢,进而使脂质沉积程度得到降低〔17〕。mTOR相关的信号通路与自噬高度相关,在自噬的发生进展发挥较为重要的作用〔18〕。当磷酸水平上升时,AMPK可抑制mTOR水平,进而加强自噬水平〔19〕。自噬与NAFLD关系密切,脂滴可转移至溶酶体,形成自噬溶酶体,降解呈游离脂肪酸,因此,自噬激活可进一步加强脂滴降解,进而达到改善NAFLD的目的〔20〕。研究显示,NAFLD状态下,自噬水平较低,体内自噬水平与代谢水平紊乱相关,当机体自噬水平打破,肝脏脂质沉积进一步加重。而miR-34a与脂质代谢水平高度相关。本研究结果推测,AMPK/mTOR信号通路活性的变化参与NAFLD的疾病进程,通过慢病毒沉默miR-34a,可抑制AMPK、mTOR磷酸化的异常变化,miR-34a可能调控AMPK/mTOR的活性变化。
综上,NAFLD发生后,伴随脂质代谢紊乱、肝功能异常等情况,经下调miR-34a干预后,可较好的改善上述情况,延缓疾病进展,其作用机制可能与调控AMPK/mTOR通路有关。

