miR-340-5p靶向调控ARID1A对甲状腺癌活性、迁移和侵袭的影响
段飞 陈羿 查官金 段训凰
(九江市第一人民医院 1耳鼻咽喉头颈外科,江西 九江 332600;2肿瘤科)
甲状腺癌是一种主要起源于滤泡上皮细胞的常见内分泌癌〔1〕。分为乳头状甲状腺癌(PTC)、滤泡状甲状腺癌(FTC)、低分化甲状腺癌(PDTC)和间变性甲状腺癌(ATC)。其中PTC和FTC占甲状腺癌病例的95%〔2〕。近十年来,甲状腺癌的发病率呈现增长趋势,这得益于医疗诊断技术的优化〔3〕。目前手术切除是大多数甲状腺癌患者的标准治疗方法。然而,晚期甲状腺癌患者的较差生存率表明仍然缺乏有效的治疗策略〔4〕。特别是低分化或是晚期甲状腺癌患者常出现淋巴转移,需要进行淋巴清扫和放射性碘治疗〔5〕。因此,探究甲状腺癌转移相关的具体分子机制,对于甲状腺癌转移患者靶向治疗的研究具有一定的意义。
MicroRNA(miRNA)是一类进化上保守的小非编码RNA,它们通过与其互补的靶mRNA结合在生物学的许多方面发挥关键作用〔6〕。目前,miRNA已成为癌症新治疗策略的有吸引力的工具和靶标〔7〕。越来越多的研究已证实,miRNA失调是许多癌症发展的原因之一〔8〕。miR-340-5p是一种基因内miRNA,位于宿主基因RNF130的内含子区域、染色体5q35.313上。miR-340-5p在哺乳动物中表达模式与宿主基因相似〔9〕。越来越多的证据表明,miR-340-5p与多种癌发展相关。胃癌细胞中miR-340-5p的水平显著高于正常胃黏膜细胞。敲降miR-340-5p通过上调细胞因子信号转导抑制因子(SOCS)3表达以抑制Janus激酶(JAK)-信号转导子和转录激活子(STAT)3信号通路从而减弱胃癌细胞的细胞增殖并阻止细胞周期〔10〕。在甲状腺癌的研究中发现,miR-340-5p通过抑制骨形态发生蛋白(BMP)4在体外和体内促进甲状腺癌的生长〔11〕。然而,目前关于miR-340-5p在甲状腺癌转移中的机制尚不清楚。转换/蔗糖不发酵(SWI/SNF)复合物对染色质调节和基因表达至关重要,其在约20%人类癌症中的中发生突变或表达差异〔12〕。ARID亚基家族被认为通过募集ATPase催化模块来增强SWI/SNF复合物活性,其中ARID1A是SWI/SNF亚基最常发生突变的基因〔13〕。在ARID1A缺乏的情况下,增强子活性控制的缺陷会损害发育程序并导致基因表达广泛失调,从而驱动肿瘤形成〔14〕。研究显示,小鼠BRAFV600E突变肿瘤中ARID1A的甲状腺特异性缺失会促进疾病进展和降低存活率〔15〕。并且研究发现,ARID1A mRNA表达与甲状腺癌分化恶性程度呈负相关〔16〕。miR-340-5p是否通过调控ARID1A影响甲状腺癌的发展有待进一步证实。本研究在甲状腺细胞BCPAP中通过分子生物学技术,探讨miR-340-5p靶向调控ARID1A对BCPAP细胞的活性、迁移和侵袭的影响。
1 材料与方法
1.1细胞培养 人类甲状腺上皮胞系(HTori-3)和人类甲状腺乳头状癌细胞系(IHH4、TPC-1、BCPAP、KTC-1)购自ATCC(美国)。非肿瘤来源的细胞系HTori-3在RPMI1640培养基中培养,癌细胞系在DMEM培养基中培养。两种培养基均添加10%胎牛血清和双抗。细胞培养放置在37 ℃的5% CO2的培养箱中。
1.2细胞活性检测 噻唑蓝(MTT)法测定不同处理后的甲状腺癌细胞活性。处理后0、24、48 h,用MTT(5 mg/ml)处理细胞4 h。然后使用二甲基亚砜溶解所得的甲臜晶体及使用酶标仪(ELX800)测量570 nm 处吸光度(OD)值。
1.3实时荧光定量聚合酶链反应(RT-qPCR)使用Trizol试剂从甲状腺癌细胞中提取总RNA。使用PrimeScriptTMRT试剂盒将1 μg RNA逆转录为cDNA。RT-qPCR使用 SYBR® Premix Ex TaqTMⅡ试剂盒进行。热循环条件如下:95 ℃ 30 s预变性,95 ℃ 10 s变性,60 ℃ 30 s退火,65 ℃ 30 s延伸,40个循环。GAPDH用作内源性对照。同样,miRNA被逆转录。使用TaqMan microRNA检测试剂盒检测miRNA表达。U6用作内源性对照。通过2-ΔΔCt方法计算表达倍数。引物序列:miR-340-5p正向:5′-AACTGTTTGCAGAGGAAACTGA-3′,反向:5′-TCTTGGGGTTATTGGTCAGC-3′;ARID1A正向:5′-AAAAGCTGACCCCTTTAGCC-3′,反向:5′-GCTCCGGTGTTTTCTTCATC-3′;U6正向:5′-CTCGCTTCGG-CAGCACA-3′,反向:5′-AACGCTTCACGAATTTGCG-T-3′;GAPDH正向:5′-TCACCAGGGCTGCTTTTAAC-3′,反向:5′-TGACGGTGCCATGGAATTTG-3′。
1.4Western印迹 使用RIPA缓冲液从处理和未处理的甲状腺癌细胞中提取总蛋白。使用二喹啉甲酸(BCA)定量试剂盒进行定量后,在10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶中分离30 μg蛋白质并转移到聚偏氟乙烯(PVDF)膜上。将膜在室温下用5%脱脂牛奶封闭1 h,然后在4 ℃下与一抗孵育过夜。使用的一抗如下:anti-ARID1A(1∶1 000;ab70816;Abcam)和anti-GAPDH(1∶2 000;ab9485;Abcam)。第2天,在室温下用0.1%TBST洗涤3次后,将辣根过氧化物酶(HRP)缀合的山羊抗兔 IgG(1∶2 000;ab6721;Abcam)在室温下孵育2 h。用0.1%TBST洗涤3次后,将印迹与电化学发光(ECL)试剂在室温下孵育3 min,并在成像系统上曝光。使用ImageJ软件评估和计算蛋白质密度值。
1.5细胞转染和双荧光素酶报告基因检测 甲状腺癌细胞用miR-340-5p抑制物购自上海生工生物公司,编码ARID1A特异性shRNA(sh-ARID1A)、相应的阴性对照(sh-NC)进行慢病毒包装。使用Lipofectamine2000试剂转染至细胞中。3′-UTR ARID1A基因位于1号染色体上,miR-340-5p的结合位点位于chr1:27108172-27108178。然后,在PCR扩增结合位点处的ARID1A 3′-UTR区域,使用点突变试剂盒对其进行点突变处理。将其与psiCHECK-2荧光素酶报告质粒连接得到野生型质粒(WT-ARID1A)和突变型质粒(MUT-ARID1A)。将细胞接种在24孔板上(1×105/孔)并在5% CO2中37 ℃培养。第2天,使用Lipofectamine2000试剂将细胞与miR-340-5p模拟物、miR-340-5p抑制物、WT-ARID1A、MUT-ARID1A或其对照质粒共转染。转染48 h后,通过Dual-Luciferase Reporter Assay 试剂盒检测荧光素酶活性。
1.6细胞迁移和侵袭 Transwell 板插入的上室有(侵袭)或者没有(迁移)涂有基质胶。在处理后24 h将在无血清培养基中适当处理的细胞(5×104)加入上室,同时将含有10%胎牛血清(FBS)的培养基加入下室。在37 ℃下孵育48 h后,使用棉签小心去除留在上室中的细胞,同时使用4%多聚甲醛在室温下将剩余的细胞染色10 min,并在6个随机区域中的侵入细胞使用光学显微镜对每个样品的视图进行计数。
1.7统计学分析 采用GraphPad Prism8.0软件进行方差分析、Tukey事后检验。
2 结 果
2.1甲状腺癌细胞中miR-340-5p和ARID1A表达 与HTori-3细胞比较,miR-340-5p在IHH4、TPC-1、BCPAP、KTC-1细胞中明显高表达,ARID1A mRNA及蛋白在IHH4、TPC-1、BCPAP、KTC-1细胞中明显低表达(P<0.05)。见表1、图1。其中BCPAP细胞系差异最为显著,因此选其作为后续研究的细胞系。

表1 不同甲状腺癌相关细胞中miR-340-5p和ARID1A mRNA及蛋白表达比较
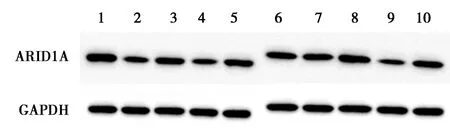
1~10:HTori-3、IHH4、TPC-1、BCPAP、KTC-1、对照组、抑制物对照+sh-RNA对照组、miR-340-5p抑制物组、sh-ARID1A组、miR-340-5p抑制物+sh-ARID1A组
2.2敲降miR-340-5p减少甲状腺癌细胞的活性、迁移和侵袭 通过转染抑制物对照和miR-340-5p抑制物检测miR-340-5p表达结果发现,与对照组相比,抑制物对照对miR-340-5p表达没有明显影响(P>0.05),miR-340-5p抑制物明显降低了BCPAP细胞中miR-340-5p表达水平(P<0.05)。MTT检测显示,与对照组相比,抑制物对照对细胞活性没有影响(P>0.05),miR-340-5p抑制物使BCPAP细胞48 h活性明显降低(P<0.05)。与对照组相比,抑制物对照对细胞迁移和侵袭没有明显影响(P>0.05),miR-340-5p抑制物使BCPAP细胞迁移和侵袭个数明显减少(P<0.05)。见表2、图2。证明miR-340-5p对甲状腺癌细胞系BCPAP的活性、迁移和侵袭具有调控作用。

表2 敲降miR-340-5p对甲状腺癌细胞的活力、迁移和侵袭影响的比较

图2 敲降miR-340-5p对甲状腺癌细胞迁移和侵袭的影响(结晶紫染色,×100)
2.3miR-340-5p与ARID1A靶向结合关系 通过Starbase在线分析发现,miR-340-5p与ARID1A具有直接结合位点。见图3。提示ARID1A可能是miR-340-5p的靶标基因。进一步构建了ARID1A双荧光素酶突变载体。见图4。通过双荧光素酶报告基因检测发现,WT-ARID1A与miR-340-5p模拟物共转染后,与模拟物对照荧光活性相比,miR-340-5p模拟物明显抑制细胞的荧光活性(P<0.05);与抑制物对照荧光活性相比,miR-340-5p抑制物共转染则明显增加荧光活性(P<0.05),而MUT-ARID1A与模拟物对照或者抑制物对照相比,miR-340-5p模拟物或者抑制物共转染后细胞中的荧光活性无统计学差异(P>0.05)。见表3。表明miR-340-5p靶向调控ARID1A表达。

图3 miR-340-5p与ARID1A存在结合位点

图4 构建ARID1A双荧光素酶载体

表3 miR-340-5p与ARID1A靶向结合关系
2.4miR-340-5p通过调控ARID1A对甲状腺癌细胞的活性、迁移和侵袭的影响 与对照组和抑制物对照+sh-RNA对照组相比,miR-340-5p抑制物组miR-340-5p表达明显减少,敲降ARID1A对miR-340-5p表达没有明显影响(P<0.05),且miR-340-5p抑制物组与miR-340-5p抑制物+sh-ARIT1A组相比,miR-340-5p表达无显著差异(P>0.05);与对照组及抑制物对照+sh-RNA对照组相比,miR-340-5p抑制物组ARID1A mRNA和蛋白表达明显增加,sh-ARID1A组ARID1A mRNA和蛋白质表达明显减少(P<0.05);miR-340-5p抑制物组+sh-ARID1A组ARID1A mRNA和蛋白表达较sh-ARID1A组明显升高(P<0.05)。证实ARID1A为miR-340-5p的下游基因。进一步分析细胞活性、迁移和侵袭变化发现,与对照组及抑制物对照+sh-RNA对照组相比,miR-340-5p抑制物组细胞48 h活性、迁移和侵袭数明显减少(P<0.05),sh-ARID1A组细胞48 h活性、迁移、侵袭数显著增加(P<0.05)。而同时敲降ARID1A明显逆转了单独敲降miR-340-5p对48 h活性、迁移、侵袭的抑制作用。见图1、图5、表4。表明miR-340-5p通过调控ARID1A影响甲状腺癌细胞活性、迁移和侵袭。

图5 各组BCPAP细胞迁移和侵袭(结晶紫染色,×100)

表4 同时敲降miR-340-5p和miR-340-5p对甲状腺癌细胞活力、迁移和侵袭影响的比较
3 讨 论
预计到2030年,甲状腺癌将成为第四大癌症〔17〕。虽然高分化甲状腺乳头状癌具有良好的预后,但50%淋巴结转移率和20%复发率仍然使甲状腺癌备受关注〔18〕。本研究在甲状腺癌多个细胞系中发现miR-340-5p和ARID1A的表达失调。
miRNA通常通过调控下游mRNA的稳定性和翻译活性来影响下游基因的表达〔19〕。miR-340-5p在癌症中具有抑癌和促癌两种调控作用〔9〕。在结直肠癌〔20〕和乳腺癌〔21〕中miR-340-5p具有抑癌作用。与正常黏膜相比,miR-340-5p在结直肠癌组织中的表达水平显著降低且与较差的预后相关〔22〕。转染miR-340-5p降低了结肠癌细胞的迁移和侵袭〔23〕。而在胃癌〔24〕、甲状腺癌〔11〕等癌症中miR-340-5p则具有促癌基因作用。研究发现,miR-340-5p过表达促进了肾癌细胞增殖、迁移、侵袭、细胞外丙氨酸水平和糖酵解水平〔25〕。Zhao等〔11〕研究发现,在甲状腺癌组织中miR-340-5p过表达,具有较高病理分级的肿瘤具有较高水平的miR-340-5p。并且miR-340-5p过表达通过抑制BMP4显著增强了甲状腺癌细胞活力和集落形成,与本研究一致。miR-340-5p在不同癌症中具有不同调控作用,推测可能是miR-340-5p具有疾病特异性。关于miR-340-5p对于癌症调控机制仍需深入探究。
ARID1A编码多功能SWI/SNF的复合亚基。ARID1A表达异常常见于多种癌症类型,如卵巢癌、结直肠癌、胆管癌等〔26〕。研究表示,在肺腺癌中ARID1A的缺失导致组蛋白去乙酰化酶(HDAC)1募集缺失,并随后增强了糖酵解相关基因的驱动转录从而促进癌症发展〔27〕。本研究证实,ARID1A是miR-340-5p的靶标下游。敲降ARID1A能够逆转miR-340-5p抑制剂对甲状腺癌细胞活性、迁移和侵袭的抑制作用。本研究只在甲状腺癌细胞中进行研究,由于癌症的转移可能涉及多种因素影响,后续将在小鼠体内进行深入验证。

