VEGFA、HIF-1α在老年肺癌组织表达及对肺癌细胞血管管腔形成的影响
王清 武香梅 刘福升 宫理达 陈震 陆爱萍
(1北京老年医院病理科,北京 100095;2北京肿瘤医院病理科)
肺癌是临床常见的恶性肿瘤类疾病,而老年肺癌则是导致患者死亡及产生不良预后的重要病因〔1〕。老年肺癌也是主要的转移致死疾病之一,其复发和转移率升高是影响老年患者生存和死亡的最关键因素,其中淋巴结转移老年是肺癌当中较常见的,可及大的影响和降低肺癌患者的生存率。血管生成在肺癌的发生和发展中具有关键的作用,而血管内皮生长因子(VEGF)A是其中重要的调控因子,其广泛存在于受损的血管内皮细胞中,可增加内皮祖细胞的迁移,在病理形态下对肺癌的血管生成起重要促进作用〔2〕。缺氧诱导因子(HIF)-1α是介导VEGF的关键执行因子,是在缺氧诱导因子中具体控制氧浓度的关键因子,在肺癌中具有高表达现象,可帮助癌细胞建立促进自身分泌的信号通路并增加其侵袭特性〔3〕。肺癌的产生常需依靠于多种受体、血管内皮生长因子、信号通路传导,且血管生成是加快肺癌疾病进展的重要因素〔4〕。肺癌细胞的生长和转移与新生血管的生成之间具有重要联系,且当癌细胞超过一定数量时便可通过分泌各种促血管生成因子,在其组织周围形成新生的血管网以促进肿瘤内部的血管循环〔5〕。因此,抑制肺癌中细胞内的血管生成已成为现阶段老年肺癌治疗的重要举措之一。本研究探讨VEGFA、HIF-1α在老年肺癌组织中表达及对肺癌细胞血管管腔形成的影响。
1 资料与方法
1.1一般资料 选取北京老年医院2020年6月至2021年12月根据世界卫生组织(WHO)病理学诊断标准确诊,并在北京老年医院进行根治手术的100例肺老年癌患者所切除的肺部病理组织作为本次研究标本。其中男63例,女37例,年龄35~73岁,平均(56.23±21.15)岁,有吸烟史患者72例,饮酒史患者78例,依据TNM分期标准,Ⅰ期39例、Ⅱ期42例、Ⅲ期19例。纳入标准:患者经病理检测确诊为肺癌;术前没有进行放、化疗及其他肿瘤相关治疗。排除标准:以往有肿瘤疾病史;重要组织器官产生病变。此次研究经医院伦理委员会批准,所有患者及家属对本次研究知情同意并签署同意书。
1.2实验仪器 肺癌细胞株SPC-A-1(上海冠导生物工程公司,货号C4601),显微镜(上海炳宇光学仪器公司产品,型号XDS-10),倒置生物显微镜(北京中显恒业仪器,货号DSZ2000X),显色试剂盒(中杉金桥生物技术有限公司),CO2培养箱(上海三藤仪器,货号DH-160I),恒温箱(北京六一,货号DYY-6C),兔抗人VEGF、癌细胞微血管密度(MVD)单克隆抗体(博世德生物技术有限公司)。
1.3细胞培养及转染 将肺癌SPC-A-1细胞接种在有10%胎牛血清的DMEM/F12培养基中,于含5%CO2的37 ℃常温培养箱中进行培养,等细胞贴壁融合80%左右时,使用0.25%的胰蛋白酶进行传代培养,1次/2 d进行传代后,取对数生长期的细胞实验。SPC-A-1置于含有10%胎牛血清的DMEM培养基中培养,将SPC-A-1细胞以每孔1×105个接种在6孔板中,待细胞汇合约80%时,更换新鲜无血清培养基继续进行培养,于12 h后将细胞溶解于Opti-MEM培养基中,加入VEGFA的抑制剂(Axitinib,10 μmol/L)、HIF-1α抑制剂(YC-1,10 μmol/L)、VEGFA+HIF-1α(Axitinib+YC-1,20 μmol/L),收集转染24 h后的肺癌细胞用于后续实验。
1.4细胞分组 将未转染的肺癌细胞进行常规培养基进行培养作为SPC-A-1细胞组;将Axitinib与SPC-A-1细胞进行培养的作为Axitinib组;将YC-1与SPC-A-1细胞进行培养的作为YC-1组;将转Axitinib+YC-1与SPC-A-1细胞进行培养的作为Axitinibt YC-1组。
1.5免疫组织化学染色法检测VEGFA、HIF-1α阳性表达 使用免疫组化法检测VEGFA、HIF-1α在癌组织及癌旁组织中的表达情况。标本均在24 h内采集于距病灶3 cm以外的癌旁组织和癌中心部位各取1块,二甲苯脱蜡,15 min/次,乙醇梯度浸泡水化,清洗擦干后过氧化氢温室下孵育15 min,磷酸盐缓冲液(PBS)冲洗3次,柠檬酸盐缓冲液微波热修复,于37 ℃,2%牛血清白蛋白(BSA)环境下封闭30 min,依据说明书用封闭液稀释一抗VEGFA(1∶1 000)、HIF-1α(1∶500),4 ℃冰箱过夜后洗膜,加入稀释的生物素标记的二抗(1∶200),37 ℃水浴30 min,洗膜后二氨基联苯胺(DAB)显色,PBS洗涤3次后用苏木素复染进行中性树胶封片,HIF-1α、VEGFA胞质中呈棕黄色颗粒沉淀为阳性,每张切片随机取5个高倍镜视野,计数100个细胞,阳性细胞数≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分,阳性强度黄色为1分,棕黄色为2分,褐色为3分,0~6分表示阳性(+),8~12分表示高阳性()所得积分相乘,将+、归为表达阳性组计算阳性率。
1.6基质胶小管形成实验检测血管生成 将96 孔培养板、无菌移液枪头等所有实验中将接触基质胶的器材放置在-20 ℃冰箱中预冷,-20 ℃保存的基质胶于4 ℃冰箱中解冻,待基质胶呈液态时向培养板每孔加入60 μl,再置于4 ℃ 15 min,常规30 min成胶。培养24 h后收集各组肺癌细胞培养上清液,将1×105个/ml单细胞悬液以每100 μl的体积接种于96孔培养板,分别加入200 μl肺癌细胞培养上清液,加200 μl RPMI1640培养液于对照组,细胞培养箱中培养24 h,使用显微镜观察类血管结构形成情况并拍照记录,使用Im-age-Pro Plus软件分析成管数量。
1.7免疫印迹检测VEGF、MVD蛋白 取对数生长期的细胞加入裂解液中裂解,裂解后的细胞于10 000 r/min离心15 min,取上清液并收集细胞裂解物,Bradford法对蛋白浓度检测,取20 μg总蛋白在1×十二烷基硫酸钠(SDS)缓冲液中,沸腾5 min,10%SDS-聚丙烯酰胺凝胶电泳(PAGE),电转移至硝酸纤维素膜,用5%脱脂奶粉的PBS-T于室温下封闭2 h后处理硝酸纤维素膜,加兔抗人VEGF(1∶1 000)、MVD(1∶800)、β-actin(1∶2 000),10%分离胶,稀释后抗体4 ℃摇床孵育过夜,TBST洗涤3次,用辣根过氧化物酶标记的二抗(1∶5 000)室温下孵育2 h,TBST洗涤3 次,采用电化学发光(ECL)法检测蛋白表达量,图片灰度值进行胶片条带的分析。
1.8聚合酶链反应(PCR)检测肺癌细胞中HIF-1α、VEGFA mRNA的表达 肺癌细胞培养48 h后,采用Trizol试剂提取各组细胞总RNA并测定其浓度,按照试剂盒说明书合成cDNA,使用反转录试剂盒将RNA逆转录为cDNA后,进行实时PCR分析。进行Real time PCR,反应条件为95 ℃ 3 min预变性,90 ℃ 5 s变性,75 ℃ 1 min退火,70 ℃ 30 s延伸,共40个循环,以β-actin作为内部标准化参照,应用2-△△Ct对基因进行相对定量计算,引物序列:HIF-1α上游引物:5′-CTGCCACTGCCACCACAACTG-3′、下游:5′-TGCCACTGTATGCTGATGCCTGAG-3′,VEGFA上游引物:5′-GTACCTCCACCATGCCAAAGT-3′、下游:5′-CTACCAGGGTCTCGATTGGA-3′,β-actin上游引物:5′-ACTGATCAGGCTAGCAC-3′、下游:5′-ACATCTGCTGGAAGGTGGAC-3′。
1.9统计学分析 采用SPSS20.0软件进行t检验,χ2检验。
2 结 果
2.1肺癌组织及癌旁组织VEGFA、HIF-1α阳性表达 与癌旁组织比较,肺癌组织中VEGFA、HIF-1α阳性表达明显较高(均P<0.001),见图1,表1。

图1 肺癌及癌旁组织中VEGFA、HIF-1α阳性表达(免疫组织化学染色,×200)
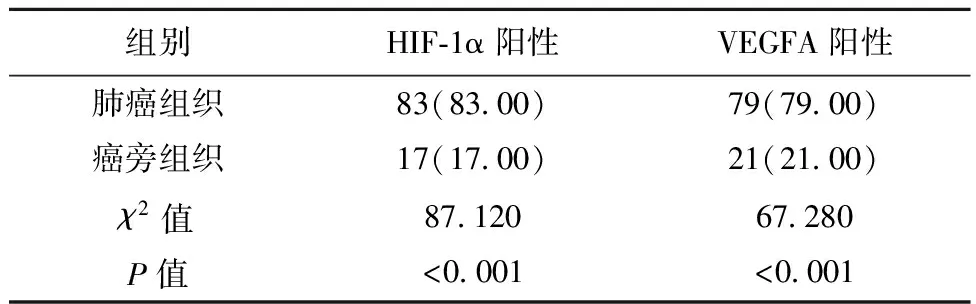
表1 肺癌组织及癌旁组织VEGFA、HIF-1α阳性表达〔n(%),n=10〕
2.2VEGFA、HIF-1α与患者淋巴转移关系 肺癌组织中患者HIF-1α阳性、VEGFA阳性是否发生淋巴结转移差异有统计学意义(P<0.05),见表2。
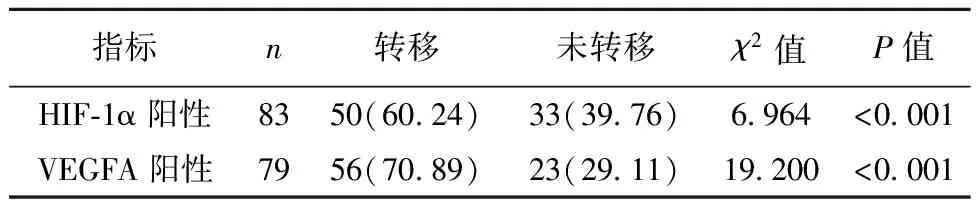
表2 VEGFA、HIF-1α阳性与患者淋巴转移关系〔n(%)〕
2.3抑制VEGFA、HIF-1α对SPC-A-1细胞血管管腔形成数量的影响 与SPC-A-1细胞组比较,Axitinib组、YC-1组、Axitinib+YC-1组管腔形成数量均明显降低(P<0.05);与Axitinib组、YC-1组比较,Axitinib+YC-1组管腔形成数量均明显降低(均P<0.05),见表3、图2。
2.4抑制后的VEGFA、HIF-1α mRNA在SPC-A-1细胞中的表达 与SPC-A-1细胞组比较,Axitinib组、YC-1组、Axitinib+YC-1组VEGFA、HIF-1α mRNA表达均明显降低(P<0.05);与Axitinib组、YC-1组比较,Axitinib+YC-1组VEGFA、HIF-1α mRNA表达均明显降低(P<0.05),见表3。
2.5抑制后的VEGFA、HIF-1α对SPC-A-1细胞管腔形成因子的蛋白表达 与SPC-A-1细胞组比较,Axitinib组、YC-1组、Axitinib+YC-1组VEGF、MVD蛋白表达明显降低(P<0.05);与Axitinib组、YC-1组比较,Axitinib+YC-1组VEGF、MVD蛋白表达明显降低(P<0.05),见表3、图3。
表3 各组细胞血管管腔形成数量、VEGF、MVD蛋白表达、VEGFA、HIF-1α mRNA比较

图2 肺癌细胞血管管腔形成数量(基质胶法,×100)
3 讨 论
肺癌是现阶段对人类健康造成较大威胁的疾病之一,且预后相对较差。HIF-1作为细胞在缺氧条件下所产生的一种核转录相关因子可促进癌细胞形成,且HIF-1α的降低能够一定程度上抑制癌细胞的增加,其原因可能是由于HIF-1所调节的血管内皮生成因子表达下降相关〔6〕。在肺癌产生的过程中,HIF-1α一方面能够促进VEGF表达,而另一方面VEGF表达又加剧了肺癌疾病的发展〔7,8〕。
HIF-1可在缺氧环境下介导区域性和系统性的缺氧反应及相关适应性反应〔9〕。以往实验研究发现,VEGFA、HIF-1在人类结肠癌、乳腺癌及子宫癌前病变中等多种癌症疾病中均具有过表达现象,且在正常组织中并无相关表达〔10~12〕。本研究结果提示,VEGFA、HIF-1α与淋巴结转移呈显著正相关,分析原因可能VEGFA阳性率升高使肺癌细胞的迁移活动增强且更易出现淋巴结转移现象相关。
本研究中肺癌细胞中抑制VEGFA与HIF-1α可抑制血管管腔形成,提示有效抑制VEGFA、HIF-1α表达对抑制肺癌细胞具有重要作用。抑制VEGFA与HIF-1α后使得肺癌细胞的滋养和增殖力进行性减退并且导致肺癌细胞管腔生成发生障碍使其重铸不足,同时也在一定程度上降低了血管内皮细胞对VEGFA、HIF-1α的敏感特性,有效抑制了血管的形成重建及新生。张文英等〔13〕研究发现,在肺腺癌中抑制VEGF可一定程度上降低肺腺癌体外微血管的形成,与本研究结果相类似。肺癌的发生及癌细胞的恶性转移都需要持续的新生血管,而VEGF为促进血管形成的关键因子,不仅能够通过与血管内皮细胞相结合而促进癌细胞的血管新生,还对促进癌转移概率、提高血管通透性、增进淋巴内皮细胞转移等具有关键调节作用〔14〕。相关研究表示,MVD的增加反映了癌细胞的血管生成增多,同时提示肺癌细胞的恶性行为能力也有所增加〔15〕。本研究发现,抑制VEGFA、HIF-1α能够显著降低肺癌细胞中的血管管腔形成因子VEGF及MVD表达。相关研究表示,VEGF可在一定程度上激活蛋白酶表达致使细胞外的基质被降解,进而在肺癌细胞的生成和发展中诱导血管因子生成而加快MVD形成〔16〕。以往在VEGF和MVD的关系研究中发现,抑制肺癌中的VEGF、MVD表达可抑制小细胞肺癌侵袭转移〔17〕。成龙等〔18〕在VEGF抑制剂治疗肺癌的疗效和安全性的研究中表示,VEGF抑制剂可提高患者的生存率。由此本文推测,抑制VEGFA、HIF-1α可使癌细胞中的血管新生、形成、成熟等受限,破坏癌细胞血管的完整性的同时抑制VEGF的血管芽生,进而阻止肺癌细胞的生长。
本研究结果提示,抑制后的VEGFA、HIF-1α对抑制肺癌细胞中的VEGFA、HIF-1α mRNA表达具有一定作用。以往研究发现,当对常规细胞进行相关有氧因子的抑制处理后,可在一定程度上使得VEGF mRNA的可逆性表达被抑制〔19〕。在该环节中HIF-1α作为主要的参与因子可通过结合VEGF周围的缺氧反应元件抑制相关因子活性并干扰VEGF mRNA的稳定性。因此,HIF-1α可能在疾病中可在转录及转录后调节VEGF的相关表达。Zhang等〔20〕研究发现,HIF-1α同VEGF表达呈正相关,在疾病中通过降低HIF-1α、VEGF可达到抑制不良肿瘤形成及肿瘤血管新生的作用。而经抑制的VEGFA、HIF-1α可通过降低肺癌中淋巴细胞、内皮细胞、血管生长因子等的生成,进而降低肺癌细胞生长和转移率。
综上,VEGFA、HIF-1α均在老年肺癌组织中呈高表达现象,并与患者淋巴结转移具有一定联系,而经抑制的VEGFA、HIF-1α对降低肺癌细胞血管管腔形成及肺癌的发生发展具有重要作用,并对预测老年肺癌患者的疾病具有积极意义。

