miR-93靶向TLR4/NF-κB信号通路对动脉粥样硬化大鼠血管内皮炎症反应的影响
李丰玲 刘云霞 刘秀 刘瑜
(潍坊医学院附属医院 1神经内一科,山东 潍坊 261031;2浮烟山综合内科;3滨州医学院烟台附属医院心血管内科;4潍坊医学院附属医院全科医学科)
动脉粥样硬化(AS)是引起心脑血管疾病发生及死亡的重要原因〔1〕。炎症是AS血管内皮损伤发生发展及恶化的重要推动因素,也是刺激巨噬细胞活化产生炎症应答、形成泡沫细胞,导致血管内皮脂质沉积及斑块形成的关键因素,并认为抑制炎症信号的生成、传导及扩大,是延缓AS发生及恶化的关键机制〔2〕。
Toll样受体(TLR)4可与动脉损伤过程中的内源性配体相结合,诱导核因子(NF)-κB入核活化,介导炎症信号产生及扩大,并调控巨噬细胞极化参与AS血管内皮脂质沉积及炎症应答〔3〕。特异性敲低TLR4及其下游炎症因子表达,可发挥抗AS血管内皮脂质沉积及炎症损伤作用〔4〕,预示干预TLR4/NF-κB信号活化,可能是治疗AS的关键策略。但靶向抑制TLR4/NF-κB信号活化的基因调控机制,还不甚明确。
微小RNA(miRNA)可与蛋白质编码基因(mRNA)的3′非翻译区(UTR)相互结合来调控蛋白质的转录及表达,并参与AS等炎性疾病的发生发展〔5〕。已有报道发现,miRNA中的miR-93在AS患者血清中呈异常低表达,并推测miR-93缺失可能是引起AS患者血管白细胞聚集和脂肪物质沉积的关键因素〔6〕。但miR-93参与AS血管内皮脂质沉积及炎症损伤的分子调控机制却并不清楚。另外,也有研究发现,miR-93与TLR4之间存在靶向调控关系,miR-93的高表达可靶向抑制TLR4表达,发挥抗骨关节炎炎症反应〔7〕,预示外源性干预miR-93表达,很可能通过抑制TLR4/NF-κB信号活化,而达到抗AS血管内皮脂质沉积及炎症损伤目的。本研究建立大鼠AS模型,探讨miR-93靶向TLR4/NF-κB信号通路对AS大鼠血管内皮炎症反应的影响。
1 材料及方法
1.1材料 取健康清洁级SD大鼠90只,雌雄各半,体质量180~220 g,鼠龄7~8周龄,购自肇庆市瑞思元生物科技有限公司,生产许可证号:SCXK(粤)2020-0053。本研究经医院动物伦理委员会批准同意,批号为IACUC-01(2020103029)。维生素D3(货号:YT2462,北京伊塔生物科技有限公司);miR-93模拟物(miR-93 agomir)及其阴性对照agomir-NC均由百奥迈科生物技术有限公司合成;TLR4激活剂RS09(货号:HY-P1431,美国MCE公司);三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度胆固醇脂蛋白(LDL-C)、白细胞介素(IL)-6、C反应蛋白(CRP)等酶联免疫吸附试验(ELISA)试剂盒均购自南京森贝伽生物科技有限公司;Movat染色液及油红O染色液购自上海一研生物科技有限公司;M1型巨噬细胞标记抗体(CD11)、TLR4、NF-κB、磷酸化NF(p-NF)-κB、三磷酸腺苷(ATP)结合盒转运体(ABC)A1、载脂蛋白(Apo)A1、巨噬细胞清道夫受体(ScR)-A、凝集素型氧化低密度脂蛋白受体(Lox)-1、IL-1β、诱导型一氧化氮(iNOS)、IL-10、几丁质酶-3样蛋白3(YM1)等抗体均购自美国Abcam公司。
1.2AS模型建立及分组 取SD大鼠75只,经腹腔注射维生素D3(60×104IU/kg)1次后,给予高脂饲料喂养8 w建立AS模型〔8〕,并按随机数字表法分为模型组、miR-93模拟物(miR-93 agomir)组、agomir-NC组、RS09(TLR4激活剂)组、miR-93 agomir+RS09组,每组15只。另取15只大鼠,正常饲料喂养+腹腔注射生理盐水(共1次),8 w后,作为正常对照组。miR-93 agomir组及其阴性对照agomiR-NC组,参照文献〔7〕经尾静脉注射5 nmol的miR-93 agomir及agomiR-NC试剂,每两日1次;RS09组参照文献〔9〕经尾静脉注射25 μg/只的RS09,每两日1次;模型组及正常对照组经尾静脉注射10 ml/kg的生理盐水;各组连续给药6 w后结束给药,进行后续试验。
1.3血脂、炎性因子、循环血管内皮细胞比例检测 末次给药结束后,麻醉,取腹主动脉血3 ml,按ELISA方法测血脂(TG、TC、HDL-C、LDL-C)和炎症因子(IL-6、CRP)水平;参照文献〔10〕中方法,分离外周单核细胞,加入CD31抗体孵育30 min后,进行流式上机检测并计算CD31阳性细胞比例,以CD31阳性细胞比例大小评价内皮细胞损伤变化。
1.4Movat及油红O染色观察胸主动脉血管内皮组织病理变化及斑块面积 各组大鼠随机取6只,麻醉后处死,取胸主动脉血管2.5 cm,于4%多聚甲醛中固定24 h后制成厚为5 μm的连续石蜡切片,每隔50 μm选1张切片(共5个切片),按Movat及油红O染色液说明书方法染色后,于光镜下观察拍照,油红O染色切片,使用Photoshop软件计算5个切片中斑块总面积百分比。
1.5免疫组化检测CD11阳性表达水平 取上述连续石蜡切片,脱蜡及破膜透化处理后,滴加1∶200的CD11兔抗大鼠一抗抗体4 ℃避光孵育24 h,滴加生物素IgG二抗,室温孵育2 h,二氨基联苯胺(DAB)显色处理后,光镜下拍照,Image-Pro Plus6.0软件分析单位面积内CD11阳性染色(棕黄色)区域的积分光密度值。
1.6实时荧光定量-聚合酶链反应(RT-qPCR)检测miR-93表达 剩余大鼠断头处死,取胸主动脉组织2 cm,剪取1 cm血管组织粉碎匀浆后,提取总RNA,反转录得cDNA,行PCR(92 ℃预变性50 s、1个循环,95 ℃变性55 s、70 ℃退火60 s,共46个循环)。miR-93以U6为内参,用2-ΔΔCt法计算基因相对表达水平。各引物序列由上海生工生物工程股份有限公司合成。
1.7Western印迹法检测蛋白表达 取胸主动脉组织1 cm,剪碎、裂解液裂解及匀浆后,提取胞浆及胞核中蛋白,二喹啉甲酸(BCA)法测蛋白浓度,制备分离胶及浓缩胶,取蛋白30 μg行电泳及电转膜操作,滴加1∶500的一抗TLR4、NF-κB、p-NF-κB、ABCA1、ApoA1、ScR-A、Lox-1、CD11、IL-1β、iNOS、IL-10,YM1及1∶900的β-actin内参抗体,4 ℃避光孵育24 h,室温滴加1∶1 100的羊抗兔二抗孵育50 min,化学发光法浸膜显影,Quantity One软件分析条带相对灰度值。
1.8统计学分析 采用SPSS22.0软件及Shapiro-Wilk软件进行t检验、方差分析、SNK-q检验。
2 结 果
2.1上调miR-93对血脂水平的影响 与正常对照组相比,模型组HDL-C水平明显降低,TC、TG、LDL-C水平明显升高(P<0.05)。与模型组相比,miR-93 agomir组HDL-C水平明显升高,TC、TG、LDL-C水平明显降低(P<0.05)。RS09组HDL-C水平较模型组进一步明显降低(P<0.05),TC、TG、LDL-C水平较模型组进一步明显升高(P<0.05)。与miR-93 agomir组相比,miR-93 agomir+RS09组HDL-C水平明显降低,TC、TG、LDL-C水平明显升高(P<0.05)。agomir-NC组与模型组血脂水平变化差异不显著(P>0.05),见表1。
2.2上调miR-93对血清炎症因子及循环内皮细胞比例的影响 与正常对照组相比,模型组血清IL-6、CRP水平、循环内皮细胞比例明显升高(P<0.05)。与模型组相比,miR-93 agomir组血清IL-6、CRP水平、循环内皮细胞比例明显降低(P<0.05)。RS09组血清IL-6、CRP水平、循环内皮细胞比例较模型组进一步明显升高(P<0.05)。与miR-93 agomir组相比,miR-93 agomir+RS09组血清IL-6、CRP水平、循环内皮细胞比例明显升高(P<0.05)。agomir-NC组与模型组血清炎症因子及循环内皮细胞比例变化差异不显著(P>0.05),见表1。

表1 各组TC、TG、LDL-C、HDL-C水平、血清炎症因子及循环内皮细胞比例比较
2.3上调miR-93对血管组织病理变化的影响 Movat染色及油红O染色可见,正常对照组血管壁层次结构清晰,无脂质沉积。模型组可见血管内膜层增加,被染成紫色的泡沫细胞聚集明显,内膜及中膜层有大量脂质弥漫,斑块面积百分比明显高于正常对照组(P<0.05)。miR-93 agomir组可见内膜层逐渐变薄,紫色的泡沫细胞聚集减少,脂质弥漫沉积减少,斑块面积百分比明显低于模型组(P<0.05)。RS09组血管内膜增厚进一步增加,紫色泡沫细胞聚集增多,脂质沉积进一步加重,斑块面积百分比明显高于模型组(P<0.05)。miR-93 agomir+RS09组紫色泡沫细胞聚集及脂质沉积较miR-93 agomir组严重,斑块面积百分比明显高于miR-93 agomir组(P<0.05)。agomir-NC组病理变化与模型组相似。见表2、图1。
2.4上调miR-93对血管组织CD11阳性表达及miR-93/TLR4/NF-κB信号轴基因及蛋白表达的影响 CD11为M1型巨噬细胞标记的特异性抗体,免疫组化阳性染色呈黄棕色。与正常对照组相比,模型组CD11阳性表达、TLR4、p-NF-κB/NF-κB蛋白表达明显升高,miR-93表达明显降低(P<0.05)。与模型组相比,miR-93 agomir组CD11阳性表达、TLR4、p-NF-κB/NF-κB蛋白表达降低,miR-93表达明显升高(P<0.05);RS09组CD11阳性表达、TLR4、p-NF-κB/NF-κB蛋白表达较模型组进一步明显升高(P<0.05),miR-93表达较模型组相比差异不显著(P>0.05)。与miR-93 agomir组相比,miR-93 agomir+RS09组CD11阳性表达、TLR4、p-NF-κB/NF-κB蛋白表达明显升高(P<0.05),miR-93表达差异不显著(P>0.05)。agomir-NC组与模型组相比上述指标变化差异不显著(P>0.05),见表2、图2、图3。

表2 各组动脉血管斑块面积、CD11阳性表达及miR-93、TLR4、p-NF-κB/NF-κB蛋白表达比较

图1 各组胸主动脉血管(×40)

图2 各组动脉血管CD11表达(免疫组化染色,×400)
2.5上调miR-93对血管组织脂质形成相关蛋白表达的影响 与正常对照组相比,模型组ScR-A、Lox-1蛋白表达明显升高,ABCA1、ApoA1蛋白表达明显降低(P<0.05)。与模型组相比,miR-93 agomir组ScR-A、Lox-1蛋白表达明显降低,ABCA1、ApoA1表达明显升高(P<0.05);RS09组ScR-A、Lox-1蛋白表达较模型组进一步明显升高,ABCA1、ApoA1蛋白表达较模型组进一步明显降低(P<0.05)。与miR-93 agomir组相比,miR-93 agomir+RS09组ScR-A、Lox-1蛋白表达明显升高,ABCA1、ApoA1蛋白表达明显降低(P<0.05)。agomir-NC组与模型组相比上述指标变化差异不显著(P>0.05),见图3、表3。

1~6:正常对照组、模型组、miR-93 agomir组、RS09组、agomir-NC组、miR-93 agomir+RS09组
2.6上调miR-93对血管组织巨噬细胞极化相关蛋白表达的影响 与正常对照组相比,模型组M1型巨噬细胞极化相关蛋白(IL-1β、iNOS)表达明显升高(P<0.05),M2巨噬细胞极化相关蛋白(IL-10,YM1)表达明显降低(P<0.05)。与模型组相比,miR-93 agomir组IL-1β、iNOS蛋白表达明显降低,IL-10、YM1蛋白表达明显升高(P<0.05)。RS09组IL-1β、iNOS表达较模型组明显升高,IL-10、YM1蛋白表达较模型组明显降低(P<0.05)。与miR-93 agomir组相比,miR-93 agomir+RS09组蛋白IL-1β、iNOS表达明显升高,IL-10、YM1蛋白表达明显降低(P<0.05)。agomir-NC组与模型组相比上述指标差异不显著(P>0.05),见图3、表3。
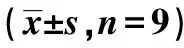
表3 各组动脉血管组织ScR-A、Lox-1、ABCA1、ApoA1蛋白、IL-1β、iNOS、IL-10、YM1表达比较
3 讨 论
AS是引起心脑血管疾病患病率及死亡率逐年攀升的重要原因,防治AS对阻止AS性心脑血管疾病流行有重要作用〔11〕。炎症是促进AS脂质沉积及斑块形成的关键因素。大量研究发现,AS患者机体中存在促炎因子如IL-6及CRP升高现象〔12〕,且IL-6及CRP等促炎介质的升高,一方面可刺激并损伤血管内皮细胞,导致血管收缩功能降低,机体循环内皮细胞比例升高而促进血管内皮损伤后再重构〔13〕,另一方面可招募巨噬细胞,使巨噬细胞活化并通过内皮细胞间隙进入血管内壁,氧化LDL-C成为ox-LDL后,吞噬ox-LDL转化为泡沫细胞,来介导炎症应答及脂质沉积〔14〕,加剧AS斑块形成、导致血管内皮功能异常及血栓形成,最终引起心血管事件的发生。本研究结果提示,AS大鼠造模成功。
另外,AS炎症刺激单核巨噬细胞活化过程中,巨噬细胞一方面可极化成具有促炎表型的M1型细胞并释放IL-1β、iNOS等促炎介质,来加剧巨噬细胞吞噬ox-LDL转化为泡沫细胞,导致斑块形成,另一方面可极化成具有抗炎表型的M2型巨噬细胞并分泌IL-10、YM1抗炎因子,来抑制ScR-A及Lox-1表达,从而延缓ox-LDL的摄取及泡沫细胞的形成〔15〕。感染、脂代谢紊乱、炎症等因素刺激动脉内皮损伤过程中,TLR4可迅速识别并结合动脉损伤过程中释放的内源性配体,诱导NF-κB入核活化,来释放大量炎症介质,刺激巨噬细胞极化,调控LDL-C修饰成ox-LDL而介导脂质形成及炎症应答,并促进炎症细胞趋化及脂质沉积,加剧AS斑块形成及内皮细胞损伤〔16〕。本研究结果提示,TLR4/NF-κB介导的炎症及巨噬细胞极化激活,可能是导致AS血管内皮损伤、泡沫细胞聚集及脂质沉积形成的关键通路。
目前已有用炎症特异性抑制剂〔IL-1受体抑制剂、NOD样受体热蛋白结构域相关蛋白(NLRP)3受体阻断剂〕来靶向抑制炎症因子的表达,发挥抗AS炎症及斑块形成,但这些靶向抑制剂并不能完全降低炎症反应的复发及心血管事件的发生〔17〕,并认为AS血管内皮炎症损伤及脂质沉积,可能与miRNA的异常表达有关,且炎症特异性抑制剂的使用,并不能逆转miRNA异常引发的炎症靶蛋白转录翻译的异常〔18〕。故寻找抑制TLR4/NF-κB炎症信号的上游miRNA,内源性靶向调控TLR4/NF-κB炎症应答信号,可能是防治AS的有效策略。miRNA中的miR-93是TLR4的上游调节因子〔19〕,已有研究发现,miR-93可靶向负调控TLR4表达,阻断TLR4/NF-κB炎症应答信号活化,来抵抗骨关节、肺炎等炎症性疾病的进一步恶化〔20,7〕。另外,miR-93已被发现在AS患者外周单核细胞中表达降低,且AS患者miR-93表达的缺失可能与ABCA1、ApoA1等脂肪转运相关蛋白的缺失有关〔6〕。但外源性上调miR-93表达,是否能靶向抑制TLR4/NF-κB炎症应答信号活化,缓解AS内皮炎症损伤及斑块形成,还未见报道。本研究结果提示,外源性上调miR-93表达,可靶向抑制TLR4/NF-κB炎症应答信号活化,降低炎症刺激引起的内皮细胞损伤、泡沫细胞聚集、脂质沉积。TLR4/NF-κB特异性激活剂-RS09可拮抗miR-93 agomir的抗炎、抗M1型巨噬细胞极化、抗泡沫细胞聚集及抗脂质沉积作用。
综上,外源性上调miR-93表达可能通过靶向抑制TLR4/NF-κB通路活化,发挥抗炎、抗M1型巨噬细胞极化、抗泡沫细胞聚集及抗脂质沉积作用,改善AS大鼠血管内皮损伤及斑块形成。但引起miR-93表达异常的上游调控机制还不甚清楚,有待后续继续研究。

