木犀草素减轻小鼠溃疡性结肠炎损伤的作用机制
王玮 杨淑媚 罗丹 李启祥 尹合坤
(江门市中心医院消化内科,广东 江门 529030)
溃疡性结肠炎(UC)是一种复杂的慢性、免疫介导的炎症性肠病〔1〕。虽然目前针对UC的治疗在临床上具有一定疗效,但长期药物治疗(如5-氨基水杨酸、激素等)会引起明显的副作用〔2〕。木犀草素(Lut)可在金银花、野菊花等多种植物中提取。Lut作为一种抗氧化剂和抗炎剂,可用于多种疾病治疗〔3〕。研究发现,Lut可通过调控细胞凋亡和自噬改善小鼠实验性结肠炎〔4〕。据报道,蛋白酪氨酸激酶(JAK)2/信号转导与转录激活因子(STAT)3是机体重要的经典炎症通路,可通过调节巨噬细胞极化来抑制机体炎症反应〔5〕。推测Lut可能通过JAK2/STAT3信号通路调控巨噬细胞极化从而减轻UC损伤。葡聚糖硫酸钠(DSS)诱导的UC模型已被广泛使用〔6〕。本研究构建DSS诱导的UC小鼠模型,探讨Lut减轻小鼠UC损伤的作用及其机制。
1 材料和方法
1.1动物和试剂、仪器 80只8~10周龄、体质量21~25 g的SPF级雄性健康C57BL/6小鼠〔SCXK(京)2019-0009〕由北京维通利华公司提供。在(20~25)℃、40%~60%的相对湿度下饲养,自由进食、饮水。本研究经医院伦理委员会批准。Lut(491-70-3,纯度HPLC≥98%)、苏木素(H104306)、伊红染色液(E292725)购自上海Aladdin;DSS(42867-25G)购自美国Sigma;小鼠白细胞介素(IL)-6(PI326)、IL-1β(PI301)、IL-10(PI522)及肿瘤坏死因子(TNF)-α(PT512)酶联免疫吸附试验(ELISA)试剂盒购自上海BEYONTIME;抗体:磷酸化(p)-JAK2(ab32101,130 kD)、p-STAT3(ab267373,88 kD)、B细胞淋巴瘤(Bcl)-2相关X蛋白(Bax,ab32503,21 kD)、胱天蛋白酶(Caspase)-3(ab32351,32 kD)、Bcl-2(ab32124,26 kD)、诱导型一氧化氮合成酶(iNOS,ab178945,131 kD)、精氨酸酶(Arg)-1(ab233548,35 kD)及β-Actin(ab8226,42 kD);TUNEL细胞凋亡原位检测试剂盒(SNM535-DUH)购自北京百奥莱博;JAK2抑制剂AG490(SIH-428-25MG-E)购自加拿大StressMarq。实验中所有涉及的引物均由上海生工合成。RM2125RTS石蜡切片、DMILLED荧光显微镜购自德国Leica;CFX 384多通道荧光定量聚合酶链反应(PCR)仪、Universal Hood Ⅱ凝胶成像系统购自美国Bio-Rad。
1.2小鼠UC模型构建及分组 将80只小鼠分为4组(根据体质量微调,尽量使各组体质量均衡),每组20只,分别为Control组、DSS组、DSS+Lut组及DSS+AG490组。小鼠驯化3 d后开始处理,除Control组外,其余各组连续7 d给予溶于饮用水3% DSS诱导UC模型〔4〕。DSS+Lut组和DSS+AG490组小鼠经口灌胃给予Lut(50 mg/kg)〔6〕和AG490(10 mg/kg)〔5〕,连续7 d,1次/d,Control组和DSS组给予等量生理盐水。于第8天颈椎脱臼处死小鼠,取结肠测量长度,再进行后续分析。每天对各组小鼠进行称重〔体质量下降率(%)=(原体质量-下降后的体质量)/原体质量×100%〕,采用疾病活动指数评价各组小鼠病情〔7〕。
1.3组织学分析 结肠组织用4%多聚甲醛固定进行石蜡包埋和连续切片(3.5 μm)。用苏木素和伊红染色,并使用Image-Pro Plus5.0系统获得图像。测量隐窝深度,对组织的结肠损伤进行评分〔8〕。评分范围为0~4分,无上皮损伤和炎症浸润0分;杯状细胞轻度减少和炎症浸润到隐窝1分;杯状细胞相对广泛减少和黏膜肌层炎症浸润2分;广泛杯状细胞减少,隐窝轻度减少,黏膜肌层广泛炎症浸润3分;隐窝广泛减少,黏膜下层炎症浸润4分。
1.4实时荧光定量(qRT)-PCR检测巨噬细胞标志物iNOS、Arg-1的表达水平 加入Trizol试剂提取各组结肠组织总RNA并制备cDNA,经qRT-PCR仪检测iNOS、Arg-1 mRNA相对表达量引物序列(5′-3′)为:iNOS上游GGCAGCCTGTGAGACCTTTG,下游GCATTGGAAGTGAAGCGTTTC;Arg-1上游GGGAA-GACAGCAGAGGAGGT,下游TAGTCAGTCCCTGGC-TTATGG;GAPDH上游CCGCATCTTCTTGTGCAGT,下游GGCAACAATCTCCACTTTGC。
1.5ELISA检测炎症因子水平 采用ELISA测定结肠组织中促炎因子(IL-6、IL-1β和TNF-α)和抗炎因子(IL-10)水平,按照试剂盒说明书操作。
1.6Western印迹检测JAK2/STAT3通路及凋亡相关蛋白表达 RIPA法提取结肠组织总蛋白,12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白并转至聚偏氟乙烯(PVDF)膜上,使用5%脱脂牛奶封闭2 h后添加一抗:iNOS、Arg-1、p-JAK2、p-STAT3、Bax、Caspase-3、Bcl-2及β-Actin,4 ℃隔夜孵育,隔天使用磷酸盐缓冲液(PBS)冲洗后,添加辣根过氧化物酶标记的山羊抗兔二抗孵育2 h,PBS冲洗后添加电化学发光(ECL)显色液显影,拍照。使用Quantity One软件分析灰度值。目的蛋白相对表达=目的蛋白条带灰度值/β-Actin条带灰度值。
1.7TUNEL法测定细胞凋亡 结肠组织用4%甲醛室温固定,洗涤、脱水、石蜡包埋,切成4 μm切片。按照TUNEL细胞凋亡原位检测试剂盒的说明书进行。染色后呈棕色细胞核的细胞为TUNEL阳性细胞(即凋亡细胞),在荧光显微镜下对凋亡细胞进行统计。
1.8统计学分析 采用SPSS25.0软件进行单因素方差分析、独立t检验。
2 结 果
2.1Lut对DSS诱导UC损伤的影响 如表1、表2所示,与Control组相比,在饮用DSS第3天后小鼠体质量下降率逐渐明显升高(P<0.05),DSS组结肠组织长度显著缩短,疾病活动指数及隐窝深度均显著增加(P<0.05)。与DSS组相比,DSS+Lut组和DSS+AG490组体质量下降率显著降低,结肠组织长度显著加长,疾病活动指数及隐窝深度均显著降低(P<0.05)。
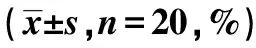
表1 各组体质量下降率
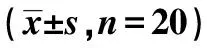
表2 各组结肠损伤指标
2.2Lut对DSS诱导的小鼠结肠组织病理学的影响 如图1所示,Control组结肠黏膜上皮细胞排列整齐,结构完整;肠壁黏膜和隐窝结构完好,杯状细胞齐整;无中粒细胞浸润,无炎症表现。DSS组结肠黏膜上皮细胞排列紊乱;隐窝脓肿形成,杯状细胞耗竭;中性粒细胞浸润,有炎症体现;DSS+Lut组和DSS+AG490组结肠黏膜上皮细胞损伤得到一定的恢复;隐窝结构几乎复原,杯状细胞增多,结构恢复;中性粒细胞浸润降低,炎症得到有效改善。与Control组〔(0.35±0.03)分〕相比,DSS组具有更高的病理学评分〔(7.65±1.15)分;t=29.719,P<0.05〕;与DSS组相比,DSS+Lut组和DSS+AG490组病理学评分〔(3.96±0.84)、(3.71±0.62)分〕明显降低(t=15.022、16.040,均P<0.05)。

图1 各组结肠组织病理学(苏木素-伊红染色,×200)
2.3Lut对DSS诱导的结肠组织中巨噬细胞极化的影响 如图2、表3所示,与Control组相比,DSS组结肠组织中iNOS、Arg-1 mRNA和蛋白表达水平均显著增加(P<0.05);与DSS组相比,DSS+Lut组和DSS+AG490组结肠组织中iNOS mRNA和蛋白表达水平明显下降,Arg-1 mRNA和蛋白表达水平明显上调(P<0.05)。

图2 各组结肠组织中iNOS、Arg、Bax、Caspase-3、Bcl-2、p-JAK2、p-STAT3蛋白表达
2.4Lut对DSS诱导的结肠组织中炎症反应的影响 如表3所示,与Control组相比,DSS组结肠组织中IL-6、IL-1β和TNF-α水平显著增高,IL-10水平显著降低(P<0.05)。与DSS组相比,DSS+Lut组和DSS+AG490组结肠组织中IL-6、IL-1β和TNF-α水平明显降低,IL-10水平明显增高(P<0.05)。
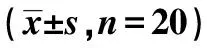
表3 各组结肠组织中iNOS、Arg-1 mRNA和蛋白表达及IL-6、IL-1β、TNF-α、IL-10水平比较
2.5Lut对DSS诱导的结肠组织细胞凋亡的影响 如图2、表4、图3所示,与Control组相比,DSS组结肠组织中细胞凋亡率显著增加,Bax与Caspase-3蛋白表达均显著增高,Bcl-2蛋白表达显著降低(P<0.05);与DSS组相比,DSS+Lut组和DSS+AG490组结肠组织中细胞凋亡率显著减少,Bax与Caspase-3蛋白表达均显著降低,Bcl-2蛋白表达显著增高(P<0.05)。
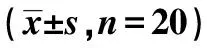
表4 各组结肠组织中凋亡细胞与Bax、Caspase-3、Bcl-2、p-JAK2、p-STAT3蛋白表达比较

图3 各组细胞凋亡(TUNEL染色,×200)
2.6Lut对DSS诱导的结肠组织中JAK2/STAT3通路的影响 如图2、表4所示,与Control组相比,DSS组结肠组织中p-JAK2和p-STAT3蛋白表达显著增高(P<0.05)。与DSS组相比,DSS+Lut组和DSS+AG490组结肠组织中p-JAK2和p-STAT3蛋白表达显著降低(P<0.05)。
3 讨 论
UC是由结直肠黏膜免疫系统功能障碍引起的慢性非特异性炎症,其发病率呈上升趋势〔1〕。DSS是一种水溶性硫酸化多糖,可破坏肠黏膜屏障的完整性,诱导UC,主要特征为结直肠溃疡、炎症细胞浸润及隐窝脓肿,是动物模型中诱发UC的理想选择〔4〕。本研究首次在小鼠模型上证明Lut可以减轻DSS诱导的小鼠UC损伤。Lut是一种多酚类黄铜化合物,可抑制肿瘤细胞的发生发展,还在一定程度上减轻器官性炎症损伤〔3,4〕。然而,缺乏Lut在UC中的研究。本研究提示,Lut可以减轻DSS诱导的小鼠的UC损伤。大量炎症因子释放是UC进一步加重的重要原因〔9〕。本研究结果表明,DSS可促进小鼠UC的炎症反应,Lut可以减轻DSS诱导的炎症反应。研究表明,IL-6、IL-1β和TNF-α都是促炎因子,其表达上调表明机体炎症反应加重〔10〕。IL-10是一种抗炎因子,其表达下调表明机体炎症不能被抑制〔11〕。
研究表明,大量炎症介质刺激巨噬细胞极化为M1型巨噬细胞,是炎症反应进展的原因之一〔12〕。在机体免疫过程中,巨噬细胞被激活成M1和M2两种不同的极化表型〔13〕。其中M1型巨噬细胞主要分泌TNF-α、IL-1β及IL-6等炎症因子,具有促进炎症反应的作用;M2型巨噬细胞主要分泌IL-10等抗炎因子,抵抗机体炎症反应〔14〕。研究显示,iNOS是M1型巨噬细胞极化标志物,Arg-1是M2型巨噬细胞极化标志物,其表达水平增高表明巨噬细胞出现M1、M2型极化〔15〕。本研究表明,DSS可刺激机体产生炎症反应,促进巨噬细胞M1、M2型极化;Lut通过抑制DSS诱导UC中M1巨噬细胞的极化,促进M2巨噬细胞的极化倾向,这与炎症因子表达改变的结果一致。
据报道,肠上皮细胞凋亡是导致肠黏膜屏障损伤和UC的重要病理特征〔16〕。正常情况下,Bcl-2和Bax处于相对稳定的状态并相互调节,意味着一旦这种稳定状态被打破,可能会诱导细胞凋亡。Caspase-3被称为死亡蛋白酶,不仅是哺乳动物的关键蛋白酶,还是多种凋亡途径的关键下游效应物〔17〕。另外,已有研究显示,在UC动物模型中Bax和Caspase-3等凋亡相关蛋白显著增高,Bcl-2表达显著降低〔18〕。因此,改善细胞凋亡对UC治疗至关重要。本研究结果与前人研究结果一致〔18〕,提示Lut还可以抑制UC小鼠肠上皮细胞的凋亡。
本研究结果提示,Lut可以抑制UC小鼠中JAK2和STAT3的活化,Lut对小鼠UC损伤的保护作用可能是通过抑制JAK2/STAT3信号通路的激活来实现的。本研究发现,Lut可能通过抑制JAK2/STAT3信号通路的激活调控巨噬细胞极化,从而减轻DSS诱导的溃疡性结肠炎损伤,因此它可能作为未来潜在的治疗溃疡性结肠炎药物。然而,本研究还存在一些局限性,首先,并未设计单独Lut组去探究Lut是否对健康小鼠存在影响;其次,由于实验开始之初并未找到合适的JAK2激动剂,故并未设计JAK2激动剂是否可以逆转来Lut对UC小鼠的保护作用。后续将针对以上不足重点探究,以完善Lut在UC中的保护机制。

