CTA联合血清MMP-9、TIMP-1对脑梗死患者颈动脉斑块诊断价值*
戴云蛟 艾伟平 刘晓翠 徐文丽 贾 婕
1.张家口市第一医院神经内一科 (河北 张家口 075000)
2.华北理工大学附属医院神经内科一三科 (河北 张家口 075000)
3.河北省沧州中西医结合医院影像三科 (河北 沧州 061000)
脑梗死具有较高的致残和死亡风险[1]。动脉粥样硬化被认为是导致脑梗死的主要原因,其会引发血栓和血管狭窄,因此,在急性脑梗死的诊断过程中,对颈动脉粥样硬化斑块的检测具有至关重要的临床价值[2]。尽管数字减影血管造影(DSA)被视为诊断颈动脉狭窄的黄金标准,但由于其有一定创伤性、高风险和高成本的特点,因此在临床实践中很少单纯用于检查[3]。相比之下,计算机断层扫描血管成像(CTA)是一种通过快速注入碘对比剂,并在靶血管中选择对比剂浓度最佳的时刻进行CT扫描的血管成像技术,借助计算机的后处理技术,可以重建出血管的三维影像,除了在血管性疾病的诊断中得到广泛应用外,CTA还可评估供血动脉的影像,定位斑块位置并进行定性诊断[4]。随着对脑血管病发病机制认识的不断深入,越来越多学者认为动脉粥样斑块的不稳定性主要受到细胞外基质的影响,其中基质金属蛋白酶类(MMPs)主要负责降解基质蛋白酶,研究发现,血浆中MMP-9和基质金属蛋白酶组织抑制剂(TIMP)-1的表达与脑梗死密切相关[5]。基于此,本研究探究CTA联合血清MMP-9、TIMP-1对脑梗死患者颈动脉斑块诊断价值。
1 资料与方法
1.1 研究对象选取2021年5月至2021年12月期间我院神经内科收治的140例脑梗死患者作为试验组研究对象。
纳入标准:符合脑梗死诊断标准[6];未接受任何治疗;知情同意。排除标准:合并有其它严重疾病如心血管病;伴有出血倾向;凝血障碍;DSA、CTA禁忌症者;其他因素导致颈动脉狭窄;合并恶性肿瘤;昏迷患者。另选择同期至我院进行体检的健康者80例作为参照组,排除标准:最近半年内曾受过创伤或外科手术;近4周患免疫性疾病、感染性疾病;合并心肝肾等严重器质性疾病患者;近3个月服用他汀类药物;合并外周血管病、肿瘤。试验组中平均年龄(61.24±4.86)岁,男87例,女53例,吸烟史68例,高血压40例,糖尿病38例;参照组中平均年龄(60.47±4.28)岁,男47岁,女33岁,吸烟史36例,高血压21例,糖尿病18例,两组间一般资料具有可比性(P>0.05)。
1.2 方法
1.2.1 头颈部CTA检测 患者取仰卧位,头框固定,进行常规头颅CT检查,CT检查参数:125mA,导管电压120Kv,基质512×512,层厚6mm,从颅底到颅顶区,确定没有脑出血,然后行颈部CTA检查。头颈部 CTA的参数:100kV,SnL40 kV,260/130mA,螺距0.9,准直2mm×128mm×0.6mm,螺旋扫描时间0.28秒,重建层间距0.6mm,层间距0.6mm,25cm×25cm。用高压注射器将碘海醇注入肘静脉,然后用自主动脉弓行扫描,直至颅顶区。
1.2.2 DSA检测 使用数字减影血管造影机和穿刺技术插管,在患者的颈内动脉和双侧颈总动脉位置注入造影剂,并进行正位、斜位和侧位检查,通过动态和静态观察记录检查结果。
血清MMP-9、TIMP-1检测:患者入院第二天空腹时采集肘部静脉血液5mL,并将离心管置于常温下,以3000r/min的速度离心10分钟分离血浆。使用酶联免疫吸附法测定血清中MMP-9和TIMP-1水平,具体操作参考说明书。
1.3 观察指标及诊断标准分析CTA诊断颈动脉斑块价值。对比试验组与参照组的血清MMP-9、TIMP-1水平差异。对比有无颈动脉斑块组间的血清MMP-9、TIMP-1水平差异,对CTA联合血清MMP-9、TIMP-1诊断颈动脉斑块的效果进行受试者特征曲线(ROC)分析。斑块CTA分级依据:大于130Hu的是有钙化斑块,CT值小于60Hu的是软斑块,60-130Hu的是混合斑块,记录斑块数量、性质等。
1.4 统计学方法数据分析采用SPSS 28.0软件,计数资料以率(%)表示,组间对比进行χ2检验,计量资料使用(±s)表示,组间对比采用独立样本t检验,血清MMP-9、TIMP-1水平单独及联合诊断颈动脉斑块的效果进行受试者特征曲线(ROC)分析,以P<0.05为有显著性差异。
2 结 果
2.1 CTA诊断颈动脉斑块价值分析DSA结果显示,140例脑梗死患者中存在颈动脉斑块者64例,无斑块组76例;CTA检测结果显示存在颈动脉斑块者64例,无斑块组76例,CTA诊断颈动脉斑块敏感度为96.88%,特异性为97.37%,准确度为97.14%,见表1和表2。DSA结果显示钙化斑块27例,软斑块10例,混合斑块27例,CTA检测结果显示钙化斑块25例,软斑块13例,混合斑块26例。

表1 CTA结果和DSA结果一致性比较

表2 CTA诊断颈动脉斑块价值分析
2.2 试验组和参照组血清MMP-9、TIMP-1比较试验组血清MMP-9水平显著高于参照组(P<0.05),TIMP-1水平显著低于参照组(P<0.05),见表3。

表3 试验组和参照组血清MMP-9、TIMP-1比较
2.3 斑块组和无斑块组血清MMP-9、TIMP-1比较经CTA检查,140例脑梗死患者中存在颈动脉斑块者64例,占比45.71%。斑块组血清MMP-9水平显著高于无斑块组(P<0.05),TIMP-1水平显著低于无斑块组(P<0.05),见表4。

表4 斑块组和无斑块组血清MMP-9、TIMP-1比较
2.4 CTA联合血清MMP-9、TIMP-1诊断颈动脉斑块的效果ROC分析ROC曲线显示血清CTA、MMP-9、TIMP-1水平单独及联合诊断颈动脉斑块AUC值依次为0.979、0.835、0.812和0.993,见表5和图1。
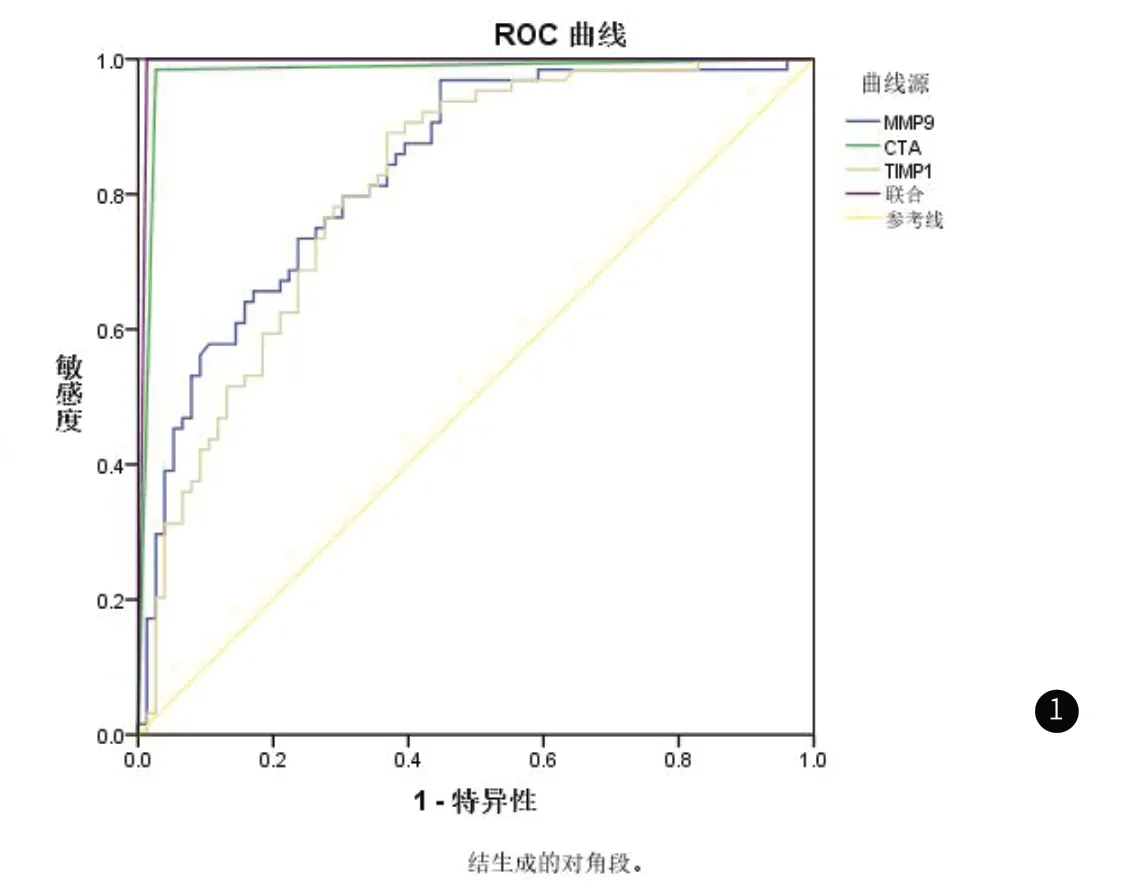
图1 CTA联合血清MMP-9、TIMP-1诊断颈动脉斑块的效果ROC分析图

表5 血清MMP-9、TIMP-1水平单独及联合诊断颈动脉斑块的效果ROC分析
2.5 典型病例图患者,男性,61岁,主因左侧肢体力弱间断发作2天入院,入院当天核磁示右侧额颞叶、侧脑室旁可见斑片状高信号;入院第二天晨起病情进展,左侧肢体肌力Ⅰ级,CTA示头臂干管壁非钙化斑块,管腔轻度狭窄。左锁骨下动脉管壁非钙化斑块,管腔轻度狭窄。右锁骨下动脉管壁非钙化斑块,管腔轻度狭窄。左颈总动脉管壁非钙化斑块,管腔轻度狭窄。右颈总动脉管壁非钙化斑块,管腔轻度狭窄。左颈内动脉管壁非钙化、混合斑块,管腔弥漫性中度以上狭窄,C6段局部管腔约重度狭窄。右颈内动脉管壁非钙化、混合斑块,管腔弥漫性狭窄,C1段管腔约中度狭窄,C7段局部管腔重度狭窄-闭塞。左椎动脉管壁混合、非钙化斑块,管腔不规则狭窄,起始部局部管腔约重度狭窄,V4段分支管腔重度狭窄。右椎动脉V4段管壁钙化斑块,管腔轻度狭窄。左侧大脑中动脉M2段管腔略狭窄。右侧大脑中动脉管腔略细,远端分支略显少,造影剂充盈略浅淡。双侧大脑前动脉A1-A3段管腔重度狭窄。右大脑后动脉P2段局部管腔略狭窄。左侧后交通动脉开放,局部管腔狭窄。余头颈部血管未见明显异常改变(图2-3)。
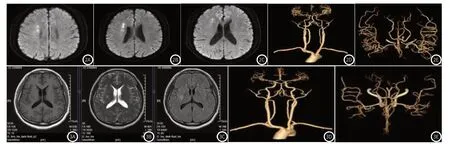
图2A-图2E 脑梗死患者存在颈动脉斑块典型病例图;患者,男性,34岁,发作性言语不利伴周身乏力4天来院。入院核磁示右侧基底节区可见多发斑片状高信号,ADC图明显信号减低,右侧基底节区可见稍长T1、稍长T2异常信号。头颈CTA:头臂干及双侧锁骨下动脉未见明显异常。双侧颈总动脉及左侧颈内动脉未见明显异常。图3A-图3E 脑梗死患者无颈动脉斑块典型病例图。
3 讨 论
脑梗死是一种神经系统疾病,其特点是由于供血动脉的狭窄或阻塞导致脑血流减少,从而引发脑细胞遭受缺血和缺氧的损害[7]。其发病机制复杂多样,其中脑血管痉挛、血栓栓塞性疾病及血流动力学异常是最常见的病因之一。颈动脉病变作为大脑的主要血液供应途径,与脑部的血流供应和脑梗死的出现有着紧密的联系[8]。颈动脉是为颅脑提供主要血液的动脉,据研究显示,大约有51%的急性脑梗死患者会出现颈动脉粥样硬化的斑块[9]。因此颈动脉斑块在脑血管病发病中起着非常重要的作用,其不仅可以影响脑血管血流动力学状态,还能引起一系列缺血性症状甚至危及生命。然而,目前在临床实践中,仍然缺乏能够早期准确预测脑梗死患者颈动脉斑块形成的指标。
随着医学影像学技术发展,越来越多的检查手段应用于缺血性脑血管病的筛查中。CTA血管边缘敏锐度高,能够精确地获取血管及其周围组织的解剖结构,了解病变血管的具体位置、狭窄程度和闭塞情况,以及确定病变血管内是否存在斑块和其稳定性[10]。资料显示,CTA对动脉狭窄具有较高的诊断效能[11]。MMPs被认为是分解细胞外基质的关键酶,它对细胞外基质的分解是导致动脉粥样斑块不稳定的主要原因[12]。MMP-9是由中性粒细胞、单核巨噬细胞、血管内皮细胞等众多细胞所合成的,而MMP9在分解细胞外的基质和促进斑块破裂的过程中发挥了至关重要的角色[13]。MMP9的表达主要受到TIMP-1和基因表达调节的控制,TIMP-1是MMP的天然抑制因子,由65个氨基酸残基组成,能够与MMP结合并阻止其降解作用,从而促进有丝分裂和血管生成,并抑制血管生成[14]。TIMP通过两个方面来抑制MMP的活化:首先,在酶原激活阶段,TIMP与MMP形成稳定的复合物,阻碍MMP酶原的自我激活。其次,在MMP被激活的阶段,TIMP可以直接与活化的MMP结合形成紧密的复合物,从而抑制其活性[15]。通过测定血浆中的TIMP-1水平,可以作为另一个可靠的指标来评估颈动脉粥样斑块的情况。马明娟等[16]研究表明,急性脑梗死患者的MMP-9水平较健康患者高,且患者脑梗死病灶的直径与MMP-9呈正相关,MMP-9的升高是急性脑梗死预后不良的危险因素。根据唐彦等[17]研究发现,急性脑梗死患者的血清TIMP-1水平相较于健康人群呈上升趋势,研究结果还显示,血清TIMP-1水平与患者神经功能缺损程度呈正相关,TIMP-1是影响神经功能缺损程度的关键因素之一。本研究结果显示,试验组血清MMP-9水平显著高于参照组,TIMP-1水平显著低于参照组,斑块组血清MMP-9水平显著高于无斑块组,TIMP-1水平显著低于无斑块组,与王斌等[18]研究结果一致。ROC曲线显示血清CTA、MMP-9、TIMP-1水平单独及联合诊断颈动脉斑块AUC值依次为0.979、0.835、0.812和0.993,进一步表明MMP-9、TIMP-1水平与颈动脉斑块关系密切,CTA联合血清MMP-9、TIMP-1对脑梗死患者颈动脉斑块具有良好的诊断价值。
综上所述,CTA联合血清MMP-9、TIMP-1对脑梗死患者颈动脉斑块具有良好的诊断价值。

