基于代谢组学技术探究针灸抑制腹泻型肠易激综合征模型大鼠肠道炎症反应的作用机制
邱宇驰 韩红伟 张家玮 付伊萌
肠易激综合征(irritable bowel syndrome,IBS)是影响着全世界高达10%的人口的功能性胃肠道疾病[1]。在我国,主要以腹泻型肠易激综合征(irritable bowel syndrome with predominant diarrhea,IBS-D)亚型发病为主。针灸在防治IBS显现出独特的优势[2],整体调护且绿色安全。研究发现,IBS主要的发病机制之一是肠道低度黏膜炎性反应[3]。目前已有研究指出IBS模型大鼠结肠组织出现病理学改变[4-6]。研究证实电针可改善IBS-D体重增长率,亦可降低结肠黏膜组织炎性因子含量亦有一定的功用[7-8],但内在机制仍不明确。
代谢组学技术属于系统生物学,能够将人作为一个整体,研究疾病的发生发展和治疗作用的内在机制,其分析思维与中医的整体思维极度相似。现已有研究者通过代谢组学技术分析IBS模型大鼠的粪便、肠道微生物从而探究中医药防治IBS的内在效应机制[9]。前期本团队的研究发现针灸能通过调节血清代谢物,影响代谢通路从而抑制炎症反应,发挥防治IBS的作用[10]。基于此,本实验将从结肠代谢模式为切入点,采用代谢组学技术,分析筛选结肠组织代谢物及其代谢途径,探究针灸抑制IBS肠道炎症反应的作用机制。
1 材料与方法
1.1 实验动物及实验环境
从三峡大学实验动物中心购进的SPF级3月龄雄性SD大鼠45只,体质量(300±20)g,许可证号:SCXK(鄂)2017-0012。在武汉体育学院饲养,SPF级环境条件控制为温度(22±2)℃、湿度(50±10)%,光照明/暗周期为12/12小时[11]。适应性喂养1周,期间自由饮食、饮水。动物实验伦理审核批准号:00287500。本研究所有动物实验流程严格按照国家科技部2006年发布的《关于做好实验动物实验操作工作的指导意见》执行。
1.2 主要仪器与试剂
戊巴比妥钠(Sigma),多聚甲醛(国药集团),异氟醚(阿拉丁),PBS溶液(ASPEN),一次性针灸针(0.30 mm×13mm,华佗牌),Rat TNF-α ELISA Kit (ELK Biotechnology,ELK1396),Rat IL-6 ELISA Kit(ELK Biotechnology,ELK1158),Rat IL-1β ELISA Kit(ELK Biotechnology,ELK1272),甲醇(Merck),乙腈(Merck),甲酸(Aladdin),二氯苯丙氨酸(BioBioPha/Sigma-Aldrich),苏木素(Sigma),伊红Y(水溶性)(国药集团),包埋石蜡(国药集团),中性树胶(国药集团)。
酶标仪(Diatek公司,DR-200Bs),冷冻离心机(湖南湘仪实验室仪器,TGL-16),制冰机(常熟市雪科电器有限公司,IMS-20),台式离心机(上海安亭科学仪器厂,TGL-16c),水浴锅(金坛市江南仪器厂,HH-W-600),石蜡切片机(德国Leica RM 2016轮转式切片机),光学显微镜(奥林巴斯BX53型生物显微镜),超高效液相色谱(Ultra Performance Liquid Chromatography,UPLC)(ExionLC AD),四级杆飞行时间质谱(Quadrupole-Time of Flight)(TripleTOF 6600, AB SCIEX),串联质谱(Tandem mass spectrometry,MS/MS)(QTRAP®),离心机(Eppendorf),恒温金属混匀仪(杭州米欧仪器有限公司),显微镜(奥林巴斯BX53型生物显微镜)。
1.3 模型制备
45只SD大鼠随机分为对照组、模型组、针灸组,每组15只。对照组大鼠不做任何的处理。模型组、针灸组大鼠通过急、慢性应激相结合方法进行IBS-D模型制备[6]。采取缺水24小时、剥夺食物24小时、痛苦的夹尾巴1分钟、45℃水中接触5分钟、在4℃水中游泳3分钟、昼夜倒置12/12小时、水平振动(120 r/min)45分钟等7种不同压力源,以抓阄的方式,每天随机选择2种压力源进行造模,持续3周,其中连续2天保证无重复特定的压力源,若抓阄的压力源重复则重新抓取,共21天。1周的休息之后,在第28天采取急性束缚应激方法,包裹大鼠的肩部、上肢前肢和胸廓1小时。当天测定内脏疼痛阈值,若模型组大鼠内脏疼痛阈值高于对照组(P<0.05),则提示造模成功[12]。
1.4 干预方法
针灸组大鼠在每日造模前,穿上自制合身的鼠衣,采用针灸干预“内关”“足三里”“关元”三穴,参照《实验动物常用穴位名称与定位》[13]。使用0.30 mm×13mm华佗牌毫针直刺,针刺得气后进行手法行针,平补平泻,频率120次/分钟,每隔4分钟行针1分钟;悬挂并进行艾灸,自制艾条长12 cm,直径7 mm,用支架固定,置于穴位旁2~3 cm,保证大鼠在平静的状态下,留针及艾灸时间为15分钟,每日1次,共28日。
1.5 检测指标
1.5.1 稀便率测定 三组大鼠在造模前和干预后均进行稀便率测定比较。测定方法如下:将各组大鼠单独放置在笼底为不锈钢网格的笼具中饲养,垫有滤纸的托盘放置在网格下,每隔1小时更换滤纸,记录大鼠粪便总粒数、稀便粒数,以滤纸上有无污迹区分干稀便,总时长为6小时。稀便率(%)=稀便粒数/粪便总粒数×100%[14]。
1.5.2 ELISA法检测血清、结肠黏膜肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素(interleukin,IL)-6、IL-1β含量 实验第29天,对大鼠腹腔注射2%戊巴比妥钠(0.2 mL/100 g)[15]进行麻醉,然后打开腹腔,采集5 mL大鼠腹主动脉血,标本血放置在4℃离心机上,3 000 r/min,离心20分钟,然后取上层血清,-20℃保存,待测。取血后,找到大鼠结肠段并进行分离,用生理盐水洗去内容物,剥离并洗净肠道黏膜,-20℃保存,待测。按照ELISA试剂盒说明书测定血清、结肠黏膜TNF-α、IL-6、IL-1β含量。
1.5.2 结肠病理学观察 麻醉后,打开腹腔,找到大鼠结肠段并进行分离,用生理盐水洗去内容物,清理肠道黏膜,4%多聚甲醛中固定、石蜡包埋、切片烤片(厚度一般为4 μm)、脱蜡、苏木素—伊红(hematoxylin-eosin,HE)染色,最后风干镜检,用奥林巴斯BX53型生物显微镜进行观察大鼠结肠组织的病理学改变。
1.5.3 结肠转运功能的测定 实验第28天,三组大鼠各随机取6只在干预结束后给予24小时禁食,再予以异氟醚进行麻醉处理,在大鼠距肛门3 cm直肠内放入直径3 mm的玻璃小球。待大鼠苏醒后,立即放入笼内垫有干净滤纸的笼具,然后喂食饮水。记录从大鼠苏醒至玻璃小球排出的时间[16]。
1.5.4 结肠代谢组学检测 (1)样本处理:从三组大鼠各随机取6只用于结肠组织代谢组学检测。同1.5.2步骤取结肠组织,用PBS洗干净,液氮淬灭并存入-80℃冰箱中。检测时,先从-80℃冰箱中取出样品,在冰上解冻并进行后续操作,取出样本,用滤纸吸掉样本表面的血液,用手术刀切下一块样本,用镊子夹到去皮后的EP管中,称量(50±2)mg,并记录重量;向称量好的样本中加入一粒钢珠,在30 Hz的条件下匀浆4次,每次30秒;在匀浆好的离心管中滴入1 mL70%甲醇内标提取液;振荡5分钟,冰上静置15分钟;在4℃条件下,12 000 r/min离心10分钟;离心后吸取上清液400 μL,放入对应的EP管中;静置于-20℃冰箱,过夜;在4℃条件下,12 000 r/min再离心3分钟;离心后,取上清200 μL装到对应的样瓶内衬管中。然后上机分析。
(2)TM广靶检测技术:TM广靶是将非靶(高分辨、广覆盖)与广靶(高灵敏、精定量)结合。首先用高分辨四级杆飞行时间质谱(Quadrupole-Time of Flight)对样本进行二级谱扫描,提取MRM离子对信息,再整合广靶库,例如迈维自建库,公共数据库HMDB、MoNA、MassBank、METLIN、NIST、MetDNA,对高分辨中的物质进行定性,随后对定性的物质离子对和RT(Retention time)转移到LC-MS上进行数据采集,得到峰面积,构建样本的特异性数据库,最后利用三重四极线性离子阱质谱仪(QTRAP)对库中物质开展MRM精准检测[10]。
(3)数据处理与分析:采用软件R进行PCA分析,软件MetaboAnalyst R (R)进行偏最小二乘判别分析(partial least squares discrimination analysis,OPLS-DA),分析代谢物,并通过京都基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库找到富集代谢通路。
1.6 统计学方法

2 结果
2.1 大鼠稀便率比较
造模前,各组大鼠之间稀便率无明显差异。造模后,模型组与对照组比较,稀便率显著升高,差异有统计学意义(P<0.05);针灸组与模型组比较,稀便率显著降低,差异有统计学意义(P<0.05)。见表1。
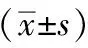
表1 各组IBS-D模型大鼠造模前后稀便率情况
2.2 大鼠血清、结肠黏膜TNF-α、IL-6、IL-1β含量比较
模型组与对照组比较,血清TNF-α、IL-6、IL-1β含量均显著升高,差异有统计学意义(P<0.01);针灸组与模型组比较,血清TNF-α、IL-6、IL-1β含量均显著下降,差异有统计学意义(P<0.05,P<0.05,P<0.01),见表2。

表2 各组IBS-D模型大鼠血清TNF-α、IL-6、IL-1β含量比较
模型组与对照组比较,结肠黏膜TNF-α、IL-1β含量均显著升高,差异有统计学意义(P<0.05);模型组与对照组比较,结肠黏膜IL-6含量差异无统计学意义(P>0.05)。针灸组与模型组比较,结肠黏膜TNF-α、IL-6、IL-1β含量差异均无统计学意义(P>0.05)。见表3。

表3 各组IBS-D模型大鼠结肠黏膜TNF-α、IL-6、IL-1β含量比较
2.3 大鼠结肠组织病理学情况
镜下观察可见对照组大鼠结肠黏膜层有少量炎症浸润,腺体数量丰富,轻微损伤(蓝色箭头);模型组大鼠结肠可见明显黏膜层厚度变薄,较多腺体消失,局部可见明显腺体损伤,同时可见较多细胞核固缩胞体消失,空洞明显(红色箭头);针灸组大鼠结肠有较多炎症细胞浸润于黏膜层顶端,少量腺体损伤(黄色箭头)。见图1。

注:A 对照组;B 模型组;C 针灸组。
2.4 大鼠结肠动力结果比较
模型组与对照组比较,玻璃小球排出时间显著缩短,差异有统计学意义(P<0.05);针灸组与模型组比较,玻璃小球排出时间显著延长,差异有统计学意义(P<0.05)。见表4。

表4 各组IBS-D模型大鼠结肠动力结果比较
2.5 结肠代谢组学多元化分析
2.5.1结肠PCA分析 将对照组、模型组、针灸组样品中的所有代谢物的含量采用PCA进行分析,如图2。对照组、针灸组组内聚集情况良好,模型组有少量离散值,说明三组数据较为稳定。模型组与对照组比较结果显示第一主成分(PC1)可以解释原始数据24.81%特征,可以发现在第一主成分发生分离;模型组与针灸组比较显示第二主成分(PC2)可以解释原始数据15.31%特征,可以发现在第二主成分发生分离,但是组间差异不明显,可能受取样的不确定因素,还有个体差异的影响,因此进一步做OPLS-DA进行模型评价。

注:A 对照组与模型组比较的PCA得分图;B 模型组与针灸组比较的PCA得分图。
2.5.2 结肠OPLS-DA分析 正交偏最小二乘法判别分析(OPLS-DA)结合了正交信号矫正(OSC)和PLS-DA方法,能够将X矩阵信息分解成与Y相关和不相关的两类信息,通过去除不相关的差异来筛选差异变量。根据OPLS-DA模型分析代谢组数据,去除不相关的差异来筛选差异变量,评价模型的稳定性。模型组与对照组、针灸组与模型组比较分析为有效的模型。结果显示模型组与对照组、针灸组分离明显。见图3。

注:A 对照组与模型组比较的OPLS-DA得分图及模型评价;B 模型组与针灸组比较的OPLS-DA得分图及模型评价。
2.5.3 差异代谢物筛选 从PCA、OPLS-DA分析对照组、模型组、针灸组样本比较所测的代谢物,然后进行单变量统计分析,比较两组样本代谢物的差异性,选取fold change≥2和fold change≤0.5且VIP≥1的代谢物,为差异显著。模型组与对照组比较,差异代谢物有1183个,下调37个,上调69个;针灸组与模型组比较,差异代谢物有1260个,下调13个,上调15个。通过火山图(Volcano Plot)进行可视化展示如图4。

注:A 对照组与模型组比较差异代谢物;B 模型组与标本配穴组比较差异代谢物。火山图中的每一个点表示一种代谢物,横坐标表示某代谢物在两样品中定量差异倍数的对数值;纵坐标表示VIP值。图中绿色的点代表下调差异表达代谢物,红色的点代表上调差异表达代谢物,黑色代表检测到但差异不显著的代谢物。
2.5.4 筛选相同差异代谢物 对照组与模型组、模型组与针灸组共有6个相同的差异代谢物。与对照组比较,模型组的代谢物肉碱C13:0上调,肉碱C7:DC水平下调,L-苯丙氨酸-L-亮氨酸水平上调,环(酪氨酸-亮氨酸)水平上调,甘油2-磷酸水平下调;与模型组比较,针灸组代谢物肉碱C13:0水平下调,肉碱C7:DC水平上调,L-苯丙氨酸-L-亮氨酸水平下调,环(酪氨酸-亮氨酸)水平下调,甘油2-磷酸水平上调。见表5。

表5 三组IBS-D模型大鼠对比相同的差异代谢物
2.5.5 代谢通路分析 将差异显著代谢物按照KEGG中通路类型进行分类及富集,其中模型组与对照组对比差异代谢通路有2条(P<0.05),分别是色氨酸代谢、类固醇激素生物合成。针灸组与模型组对比差异代谢通路有1条(P<0.05),是卟啉与叶绿素代谢。见图5。

注:A 对照组与模型组比较差异代谢物KEGG富集图;B 模型组与针灸组比较差异代谢物KEGG富集图。横坐标为每个通路对应的Rich factor,纵坐标为通路名称,点的颜色代表p-value,越红表示富集越显著。点的大小代表富集到的差异代谢物的数量。
3 讨论
研究证明,无论是结肠的神经丛神经元的改变[17],还是微生物的变化[18],或是基因的改变[19]等多个层面,均参与了IBS的发病机制。本研究通过观察稀便率、炎性因子含量、结肠动力,发现针灸后,大鼠稀便率降低,血清炎性因子TNF-α、IL-6、IL-1β含量降低,结肠组织黏膜层仅见少量的炎症细胞,提示针灸能够改善腹泻症状并抑制炎症反应。有趣的是,针灸并未通过降低大鼠结肠黏膜TNF-α、IL-6、IL-1β含量发挥抗炎作用,因此本团队进一步利用代谢组学技术分析结肠的差异代谢物及代谢通路。本研究发现三组对比相同的差异代谢物中除曲二糖之外,其他代谢物在模型组与针灸组的趋势相反。说明针灸能够通过调节肉碱C13:0、肉碱C7:DC、L-苯丙氨酸-L-亮氨酸、环(酪氨酸-亮氨酸)、甘油2-磷酸的水平,发挥抗炎的作用。
据研究报道,肉碱稳态与糖尿病、慢性肾功能衰竭、乳糜泻、心血管疾病、炎症性肠病等疾病的发生发展有关[20]。在不同的研究中也证实了肉碱与抑郁症、双相情感障碍和其他精神疾病的相关性[21-22]。提示针灸可能通过调节肉碱稳态在抑制炎症反应和改善情感状态两个方面发挥防治IBS的作用。对冠心病心血瘀阻证的研究发现,随着L-苯丙氨酸和L-异亮氨酸含量的下降,氨基酸的转运和代谢将会受到影响[23-24]。氨基酸代谢异常是IBS发病机制“脑—肠”轴异常的重要影响因素,关乎着外周和中枢的神经反应,影响IBS临床症状。此外,L-苯丙氨酸-L-亮氨酸水平还可以影响血管新生[25]。提示针灸可能通过调节L-苯丙氨酸和L-异亮氨酸含量影响氨基酸代谢,维持血管稳态,调节神经反应,改善IBS临床症状。研究发现,甘油2-磷酸也多与血管的钙化有关[26]。因此,本团队推测针灸可能是通过调节肉碱C13:0、肉碱C7:DC、L-苯丙氨酸-L-亮氨酸、环(酪氨酸-亮氨酸)、甘油2-磷酸的水平,影响肉碱稳态和氨基酸代谢,从而调节神经反应,维持血管稳态,抑制炎症反应。
通过KEGG代谢通路分析发现,IBS-D大鼠结肠的代谢通路主要涉及色氨酸代谢通路和类固醇激素生物合成。针灸干预后,发现差异代谢物主要是参与了卟啉与叶绿素代谢通路。卟啉与叶绿素代谢参与人体很多生理功能,但对卟啉与叶绿素代谢代谢与消化系统疾病相关性的研究报道不多。Khaled等报道卟啉代谢紊乱可能会干扰与自闭症神经系统表型相关的病理学,粪卟啉和前丙哌啉可用作自闭症患儿可能的生物标志物[27]。Katarzyna等报道褪黑激素对24日龄苜蓿幼苗在百草枯诱导的氧化应激期间会影响叶绿素代谢[28]。提示针灸可能通过调节卟啉与叶绿素代谢通路,影响神经系统,抑制氧化应激反应,从而改善IBS临床症状。
精神心理因素是IBS的重要病因之一,已被专家达成共识[29]。中医学认为IBS属于“肠郁”范畴。笔者分析该病的病机为心神失调,肠腑失司。在中医治病求本思想和标本理论的指导下,采用标本配穴法,选择“关元”“足三里”固护先天、后天之气,固护肠腑;选择“内关”祛除邪气,调养心神,标本兼治。由于针刺联合艾灸疗效高于单纯的针灸或者艾灸[30],因此本研究采用的针灸并用防治IBS。本研究证实了针灸能够通过调节结肠组织卟啉与叶绿素代谢通路,调节肉碱C13:0、肉碱C7:DC、L-苯丙氨酸-L-亮氨酸、环(酪氨酸-亮氨酸)、甘油2-磷酸代谢物含量,抑制炎症反应。推测针灸抑制炎症反应可能是通过参与神经传导反应,改善精神状态,从而调节炎性因子。
不同于前期采用代谢组学技术分析标本配穴针灸对IBS-D大鼠血清代谢物及代谢通路的研究结果,此次的研究从结肠的角度初步发现了针灸防治IBS的重要靶标。针灸不仅能够通过这些靶标调节免疫,抑制炎症反应,从而减轻IBS腹泻腹痛的临床症状,更有可能这些靶标参与结肠相关的神经传导反应,改善了精神心理状态,从而发挥防治IBS的作用。本研究所得结果为针灸通过调控“脑-肠”轴防治IBS提供了实验依据,为临床防治IBS提供新的治疗思路。但这些靶标如何参与发挥的内在作用机制仍需进一步更深入的研究。

