“三法三穴”推拿手法干预早期对MinoCCI模型大鼠脊髓背角IL-17A/RA、C/EBPβ信号通路影响的研究
陈金平 刘志凤 于天源 王厚融 张英琦 杨震杰 萨出拉 官乾 徐亚静 张润龙 张汉钰 刘家玥 孙佳伟
神经病理性疼痛(neuropathic pain,NP)是由于躯体感觉系统病变或者疾病导致的疼痛[1-2],其发病机制复杂,治疗效果欠佳,根据损伤部位可分为周围型神经病理性疼痛(peripherally-induced neuropathic pain,pNP)与中枢型神经病理性疼痛,其中pNP临床发病率较高[3]。脊髓背角作为第二级神经元,在pNP后对痛觉、温度觉信息的传导以及最终形成痛觉的过程中发挥着极其重要的作用[4]。
推拿在pNP临床治疗中效果确切。课题组前期通过RNA-seq技术探究推拿镇痛相关机制,发现推拿长期及早期镇痛可能与白介素-17(interleukin-17)信号通路关系密切[5-6],pNP可引起IL-17信号表达异常。因此,对该通路中的关键指标白介素-17A(interleukin 17A,IL-17A)、白介素-17A受体(interleukin-17A receptor, IL-17RA)与转录因子CCAAT增强子结合蛋白β(transcription factor CCAAT/enhancer binding protein β, C/EBPβ)进行研究。本研究建立轻度坐骨神经慢性压迫性损伤(Minor chronic compression injury of sciatic nerve, Minor CCI)模型大鼠,通过机械缩足反射阈值(paw mechanical withdraw threshold,PMWT)与冷敏阈值(cold sensitivity threshold, CST)观察干预1次后大鼠痛、温觉的恢复情况,并通过蛋白免疫印迹法(western bolt, WB)检测L4~6脊髓背角中IL-17A与C/BEPβ表达,通过荧光定量聚合酶链式反应(real time-polymerase chain reaction, RT-PCR)检测IL-17A/RA与C/BEPβmRNA表达,对推拿早期镇痛启动机制进行探讨。
1 材料与方法
1.1 实验动物及分组
雄性SD大鼠24只,体质量(200±10)g,购买于斯贝福(北京)生物科技有限公司,许可证号SCXK(京)2019-0010,饲养于北京中医药大学屏障环境动物房[SYXK(京)2020-0033],3只/笼,环境温度为(25±1)℃,相对湿度(50±5)%,昼夜节律,大鼠自由进食,每周更换垫料2次。实验程序经北京中医药大学动物使用和管理委员会批准(BUCM-4-2022082601-3039),符合动物福利与伦理原则。
适应性饲养1周后,通过电子测痛仪(BIO-EVF5)筛选痛阈值均一的大鼠,并通过随机数字法将大鼠分为假手术组、模型组和推拿组,每组8只。
1.2 主要仪器与试剂
仪器:按摩推拿手法模拟仪(专利号200710187403.1),VonFrey电子测痛仪(BIO-EVF5,生产厂家BIOSEB),小动物气体麻醉机(美国SurgiVet公司),电泳仪(美国BIO-RAD公司),MultiSkan3酶标仪(美国Thermo公司),电动组织匀浆器(美国FLUKA公司),Spectra Max Quick Drop型超微量分光光度计(上海美谷分子仪器有限公司),AG 22331 Hamburg PCR扩增仪(德国Eppendorf公司),CFX96TM Optics Module实时荧光定量PCR系统(美国Bio-Rad公司),凝胶成像仪(美国Bio-Rad公司)。
试剂:兔用IL-17A抗体(生产批号:BA11232558)、兔用C/EBPβ抗体(生产批号:AG06299152),彩虹预染蛋白marker(生产批号:BB10198356),以上试剂均订购于北京博奥森生物技术有限公司;高效组织裂解液(生产批号:20221020),BSA标准品(生产批号:20221009),5×蛋白上样缓冲液(生产批号:20221110),以上试剂均订购于北京索莱宝科技有限公司;RNA提取试剂盒(广州美基生物科技有限公司,生产批号:RLB23-01),cDNA第一链合成试剂盒(美国Thermo公司,生产批号:01157375)。
1.3 造模及干预方法
1.3.1 造模 根据课题组前期研究成果进行造模[7],造模前12小时禁食、禁水,模型组与推拿组制备Minor CCI模型大鼠模拟临床pNP。模型组、推拿组造模方法:使用异氟烷对大鼠进行气体麻醉,待大鼠完全麻醉后,将大鼠取出并按俯卧位固定在鼠板上,将右侧髋股交界区剃毛、消毒;沿坐骨神经体表投影区切1 cm切口,钝性分离,暴露坐骨神经;在坐骨神经游离处7 mm用铬制4-0可吸收性外科缝线结扎,结扎度不可过紧,避免影响神经外膜血流,结扎完成后对组织逐层缝合,滴入适量消炎药与生理盐水,避免术后伤口感染。假手术组造模:只剥离暴露出坐骨神经,不进行结扎,其余步骤同模型组与推拿组。
1.3.2 干预方法 术后7天开始干预,干预前需适应环境30分钟,待大鼠安静后开始干预,干预期间保持安静。假手术组与模型组:将大鼠仰卧位束缚于鼠板上束缚9分钟。推拿组:使用按摩推拿手法模拟仪依次对患侧殷门穴、承山穴、阳陵泉穴分别实行点、拨、揉法[8],每穴1分钟/法,参数设置:力度10 N,频率60次/分钟。
1.3.3 行为学检测 分别于造模前、干预前1天以及干预后即刻进行机械刺激及冷板实验的行为学检测。
1.3.4 PMWT 通过PWMT对大鼠痛觉敏化程度进行评价。提前20分钟将大鼠放置于箱底部放置网格铁丝网透明玻璃箱内,待其停止探索活动后,使用VonFrey电子机械测痛仪,将刺激探头对准大鼠足底部进行刺激,逐步增加刺激量,每次刺激间隔时长不低于10分钟,当大鼠出现缩足、舔足时记录数值。
1.3.5 CST 通过CST对大鼠温度觉敏化程度进行评价。将大鼠放置于表面温度为(4±1)℃的冷板上适应5分钟,上方罩一有机玻璃罩限制其活动范围,待大鼠停止探寻活动后,记录其5分钟内缩足、舔足的次数。大鼠活动及体位变化引起的抬足不记入。
1.4 取材及指标检测
1.4.1 取材 干预完成,行为学测试完毕后,每组随机选取6只大鼠,使用浓度为10%的水合氯醛(0.35 mL/100 g)对大鼠进行腹腔注射麻醉,取L4~L6节段脊髓背角。
1.4.2 WB检测脊髓背角中IL-17A、C/EBPβ的蛋白表达 取适量脊髓背角组织放于EP管中,并加入组织裂解混合液(PMSF∶RIPA=1∶100;样本重量:组织裂解液=1∶10),将EP管置于冰上,将脊髓组织研磨至肉眼不可见,每次震荡10分钟,共4次。混合液4℃、12 000 r/min离心20分钟,吸取上清液,避免吸到沉淀。37℃恒温培养箱孵育25分钟,酶标仪检测吸光度并计算样本上样量,加5×蛋白上样缓冲液并混匀,95℃变性5分钟。
配12%的分离胶及5%的浓缩胶,上样后稳定电泳分离胶60V、20分钟;分离胶80V、90分钟。快转400 mA、25分钟,快速封闭液封闭20分钟。根据marker裁膜,一抗(IL-17A 1∶1 000,C/EBPβ 1∶1 000,β-actin 1∶5 000)室温摇床1小时后,4摄氏度过夜。1×PBST洗膜3次,二抗(辣根酶山羊抗兔Ig G1∶10 000)摇床1小时,显影液均匀滴在膜上后进行显影。
1.4.3 RT-PCR检测脊髓背角中IL-17A、IL-17RA、C/EBPβ的mRNA表达 在超净台环境中取适量脊髓背角组织,用组织细胞RNA提取盒对组织RNA进行提取后,使用cDNA第一链合成试剂盒将RNA逆转录成cDNA后进行扩增。引物序列号:GAPDH上游引物:ATGACTCTACCCACGGCAAG,下游引物:TACTCAGCACCAGCATCACC;IL-17A上游引物:TGCCTGATGCTGTTGCTGCTAC,下游引物:GCGTTTGGACACACTGAACTTTGAG;C/EBPβ上游引物:GCTGAGCGACGAGTACAAGATGC,C/EBPβ下游引物:CTTGTGCTGCGTCTCCAGGTTG;IL-17RA上游引物:CCATAACAGCCGCAGACTATATTCC,下游引物:GCAGATAATCAGCAGGATGACAGAG。扩增完成后根据2-△△Ct法计算相对表达量。
1.5 统计学分析

2 结果
2.1 各组大鼠PMWT结果
PMWT基线:假手术组、模型组与推拿组相比,无显著性差异(P>0.05);干预前:模型组、推拿组低于假手术组(P<0.01),模型组与推拿组无显著性差异(P>0.05);干预后:模型组与推拿组低于假手术组(P<0.01),推拿组高于模型组(P<0.01)。见表1。

表1 各组大鼠PMWT结果
2.2 各组大鼠CST结果
CST基线:模型组、推拿组与假手术相比,无统计学差异(P>0.05);干预前:模型组高于假手术组(P<0.01),推拿组高于假手术组(P<0.05);干预后:模型组高于假手术组(P<0.01),推拿组与假手术组无显著差异(P>0.05),模型组高于推拿组(P<0.01)。见表2。
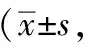
表2 各组大鼠冷板实验抬足次数结果次)
2.3 各组大鼠IL-17A、C/EBPβ蛋白表达量比较
IL-17A:干预后,模型组高于假手术组,有显著性差异(P<0.05),推拿组与假手术组无显著性差异(P>0.05),模型组高于推拿组,有显著性差异(P<0.05)。
C/EBPβ:干预后,模型组高于假手术组,有显著性差异(P<0.05),推拿组与假手术组无显著性差异(P>0.05),模型组高于推拿组,有显著性差异(P<0.05)。见表3、图3。

注:J为假手术组,M为模型组,T为推拿组。

表3 各组大鼠IL-17A、C/EBPβ蛋白表达量
2.4 各组大鼠IL-17A、IL-17RA、C/EBPβ的mRNA表达比较
IL-17A mRNA:干预后,模型组高于假手术组,有显著性差异(P<0.01),推拿组高于假手术组,有显著性差异(P<0.05),模型组高于推拿组,有显著性差异(P<0.05)。
IL-17RA mRNA:干预后,模型组高于假手术组,有显著性差异(P<0.01),推拿组与假手术组无显著性差异(P>0.05),模型组高于推拿组,有显著性差异(P<0.05)。
C/EBPβ mRNA:干预后,模型组、推拿组均高于假手术组,有显著性差异(P<0.01),模型组高于推拿组,有显著性差异(P<0.05)。见表4。

表4 各组大鼠IL-17A、IL-17RA、C/EBPβ的mRNA结果
3 讨论
前期实验证明,“三法三穴”推拿手法干预后可有效恢复大鼠超微结构,改善自发性疼痛、提高痛阈及温度觉的恢复等[9-12],但尚不清楚推拿如何启动镇痛。本实验根据前期实验结果[5-6],验证IL-17A/IL-17RA/C/EBPβ信号通路在干预1次后即刻的镇痛作用及其启动镇痛的相关机制。根据研究发现,推拿干预1次后可抑制IL-17A、IL-17RA、C/EBPβ mRNA在脊髓背角的表达(P<0.05);同时也可抑制IL-17A、C/EBPβ蛋白在脊髓背角的表达(P<0.05),发挥即刻镇痛作用。
3.1 Minor CCI模型适合模拟pNP的早期研究
Minor CCI模型模拟临床pNP,适合短期研究设计。前期研究证实,相较于经典CCI模型,Minor CCI与经典CCI模型在机械缩足痛阈趋势保持一致,且模型更加稳定,自残现象更少[7]。而经典CCI模型则会出现不同程度的自残现象,同时还会产生异常的热性痛觉亢进,但热性痛觉过敏并不是临床中NP的表现之一[13]。因此选择Minor CCI模型作为本次实验研究对象,能避免因模型损伤过重,在早期研究中出现效果不明显的情况,同时本实验根据临床患者出现疼痛以及怕冷的临床表现[14],对机械痛觉以及对冷敏化程度进行研究。
根据行为学结果可以发现,造模后,模型组与推拿组的痛阈值明显低于假手术组(P<0.01),表现经典,提示造模成功。而在“三法三穴”推拿手法干预1次后,推拿组较模型组在PMWT以及CST可出现较为明显的改善(P<0.01)。比较有趣的一点是推拿组相较于假手术组的CST无显著性差异(P>0.05),与PMWT相比,CST数据较不稳定,样本之间差异较大。针对该结果,主要考虑有以下几点:首先是个体差异性,个体样本之间的表现在机械痛阈上随保持一致,但在对冷的感受上则不一致,该现象与临床患者表现一致;另一点考虑则是超出推拿即刻镇痛作用维持的时效,但该观点还需进一步验证。基于行为学结果,证实推拿1次既可发挥即刻镇痛作用又可改善冷敏化状况。
3.2 IL-17A与NP关系密切
IL-17A主要是由Th17细胞产生,介导炎症及自身免疫性疾病[15]。IL-17可通过间接招募损伤神经元区域中的免疫细胞,进而释放炎性因子,参与NP的发生与发展[16-17]。受损区域神经元中IL-17A表达上调的同时,可通过其受体IL-17RA将信号传递给感觉神经元,从而促进神经再生[18]。IL-17可直接或间接激活神经系统中小胶质细胞和星形胶质细胞,释放多种炎症介质及趋化因子进而对神经元产生损害[19-20]。CCI造模后第3天,背根神经节中C/EBPβ表达升高,可引起自发性疼痛、机械性痛阈以及温度觉的敏化,而当抑制C/EBPβ的表达时则可缓解其敏化症状[21]。C/EBPβ过多表达可促使脊髓小胶质细胞活化,加剧神经炎症反应[22]。因此,抑制IL-17A/RA的结合及其下游的传导,可能成为治疗pNP新思路[23],但目前还未有相关研究在IL-17A介导的C/EBPβ通路在pNP早期进行研究,因此本实验基于上述理论进行研究。研究结果显示,相较于模型组,推拿干预后可抑制脊髓背角中IL-17A/RA表达(P<0.05),并且抑制了下游通路中C/EBPβ mRNA与蛋白的表达(P<0.05),从而发挥即刻止痛的作用,此结果与前人认为的IL-17A/RA为潜在性治疗靶点的相关研究成果吻合[24]。因此可以认为推拿干预1次后可通过抑制IL-17A、IL-17RA、C/EBPβ信号通路实现早期镇痛。
综上所述,本实验揭示了“三法三穴”推拿手法干预即刻便可有效缓解因pNP导致的疼痛,其启动机制与抑制IL-17A、IL-17RA、C/EBPβ信号通路有关。但是本实验还存在一定局限性,如未验证干预1次后镇痛效果的维持时长,尤其是对冷敏化情况的研究。此外,也未对早期镇痛过程中脊髓背角IL-17A对胶质细胞形态的影响进行研究,后期实验可从这两方面入手进一步验证,为临床推拿治疗pNP提供更多证据,为推拿学的发展提供科学支撑。

