乌梅丸及拆方对溃疡性结肠炎模型大鼠炎症因子和神经肽表达的影响
许宗颖 张冬梅 张雪丽 王文雅 张迪 陈萌
溃疡性结肠炎(ulcerative colitis,UC)是一种肠道非特异性炎症性疾病,常见临床表现为腹泻、粘液脓血便及腹痛,病变主要涉及直肠、结肠黏膜和黏膜下层。UC在任何一个年龄段均可发病,且发病率呈上升趋势[1]。UC的肠黏膜屏障改变及肠道免疫紊乱是UC的主要发病机制,神经肽分泌合成和释放的异常存在于UC结肠组织的不同解剖层次,与疾病活动及结肠炎症相关,神经—免疫网络异常被认为是UC的病理机制之一。
乌梅丸在《伤寒论》原著中主要用于治疗蛔厥、久泻久利和厥阴病提纲证,多用于治疗肝脾胃肠的功能失常,包括UC。乌梅丸中乌梅味酸涩性,敛肺涩肠;黄连、黄柏味苦,解烦治利;干姜、附子、肉桂、细辛、蜀椒味辛性温热,温中祛寒;党参、当归味甘性平,健脾养肝,气血双补。在经方中乌梅丸这种四种不同药味的配伍方式仅此一例,因此乌梅丸配伍研究具有很高的价值。
UC属于中医“久痢”“痢疾”“肠澼”等疾病范畴,寒热错杂是UC的主要证型之一[2]。UC病程长,病机复杂,与乌梅丸适应症相符合。临床及实验室研究均证实乌梅丸对UC具有较好治疗前景,乌梅丸能够调节肠道免疫,减轻肠道炎症。乌梅丸及其拆方能否通过神经—免疫网络的途径干预UC尚不明确。因此,本研究以乌梅丸四味独特配伍形式进行拆方,通过观察乌梅丸及拆方对UC模型大鼠炎症因子、神经肽的作用,为乌梅丸治疗UC的作用机制和配伍规律提供依据。
1 材料与方法
1.1 实验动物及实验环境
SPF级雄性SD大鼠83只,体质量(220±20)g,合格证号:SCXK(京)2020-0033,由斯贝福(北京)生物技术有限责任公司提供。饲于SPF级动物房,室温控制在(25±0.5)℃,相对湿度控制在50%~60%,采用12/12明暗光照,自由摄食饮水饲养。本研究遵循实验动物伦理,并获得北京中医药大学伦理委员会的批准(BUCM-4-2020092905-3119)。
1.2 实验药物
乌梅肉(批号:2005001)购于安国市聚药堂药业有限公司;党参(批号:2002012)、干姜(批号:1911002)、当归(批号:D2005028)购于四川新荷花中药饮片股份有限公司;黄连(批号:20200101)、黄柏(批号:20191201)、细辛(批号: 20191201)、肉桂(批号:20203001)、黑顺片(批号:20200201)购于安徽桐花堂中药饮片科技有限公司;花椒(批号:200401)购自广东联丰中药饮片有限公司。中药经鉴定均符合《2020中国药典》一部各品种项下规定。
阳性药柳氮磺胺吡啶肠溶片(Sulfasalazine,250 mg×60片,批号:09190605)产自上海信谊天平药业有限公司。
各组药物按照以下剂量配制:全方组:乌梅肉(醋制)25 g、炮附子6 g、干姜10 g、肉桂6 g、细辛6 g、花椒4 g、黄连16 g、黄柏6 g、党参6 g、当归4 g;酸味组:乌梅肉(醋制)25 g;苦味组:黄连16 g、黄柏6 g;辛味组:炮附子6 g、干姜10 g、肉桂6 g、细辛6 g、花椒4 g;甘味组:党参6 g、当归4 g。将各组生药及阳性对照药打成细粉,过五号筛,备用。
1.3 主要实验试剂
造模试剂乙酸(acetic acid,AA)购自Alfa Aesar(中国)化工有限公司;麻醉剂戊巴比妥钠购于Sigma化学试剂有限公司;大便隐血试剂盒(联苯胺法)购自上海源叶生物技术有限公司;胃饥饿素、血管活性肠肽(vasoactive intestinal peptide, VIP)、 P物质(substance P,SP)、五羟色胺(5-hydroxytryptamine,5-HT)ELISA试剂盒购自RayBiotech生物技术有限公司;白介素(interleukin,IL)-6、IL-8、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、神经肽Y(neuropeptide Y,NPY)、降钙素基因相关肽(calcitonin gene-related peptide,CGRY)购自北京冬鸽生物有限公司。
1.4 主要实验仪器
全自动组织脱水机(莱卡,ASP300S),半自动轮转式切片机(莱卡,RM2245),多功能染色盖片工作站(莱卡,ST5020-CV5030),超低温全自动组织研磨仪(CLINX 6300),台式高速冷冻型离心机(Eppendorf,5424R,5810R),酶标仪(BIO-RAD,iMark),光学显微镜(OLYMPUS-BX53)。
1.5 动物分组、造模与给药
采用区组随机法将实验大鼠分为空白对照组、模型组、全方组、酸味组、苦味组、辛味组、甘味组、阳性药组。其中,模型组13只,其余各组每组10只。
通过乙酸灌肠法复制溃疡性结肠炎大鼠模型[3]。各组大鼠造模前24小时禁食不禁水。以3%戊巴比妥钠(30 mg/kg)剂量腹腔注射麻醉大鼠,将石蜡油浸润婴儿10 cm圆头灌肠管,由肛门缓慢插入6~8 cm,将4%乙酸-生理盐水溶液2 mL于1分钟内缓慢推注入内,保持2分钟后用4 mL生理盐水冲洗干净。空白对照组灌以等量生理盐水。每只大鼠使用新灌肠管,灌入乙酸后抬高大鼠臀部,夹闭肛门,防止乙酸漏出。造模24小时后,模型组随机抽取3只大鼠进行造模效果评价。
4%乙酸造模24小时后,给药组给药剂量参考人(默认60 kg)和动物间按体表面积折算的等效剂量比值6.3折算,全方组大鼠每日给药量为900 mg/kg,酸味组270 mg/kg,苦味组235 mg/kg,辛味组340 mg/kg,甘味组110 mg/kg,阳性药组300 mg/kg,以10 mL/kg大鼠体质量的容量灌胃给药,每日2次,连续7天。模型组和空白对照组每天给予等量的蒸馏水灌胃。实验结束后模型组、辛味组大鼠死亡3只,全方组、酸味组、甘味组、阳性药组死亡2只,苦味组死亡1只。
1.6 样品采集与处理
末次给药后,各组大鼠禁饮禁食12小时后取材。麻醉方式同前,腹主动脉取血,1 200 g离心10分钟分离血清。取远端结肠6~8 cm,观察溃疡并拍照,取一段10%多聚甲醛中固定,剩余结肠用预冷PBS冲洗表面污物,滤纸吸干,-80℃冻存备用。
1.7 指标检测
1.7.1 疾病损伤指数(disease damage inde,DAI)评分 DAI评分包括体重减轻、大便质地、便血[4]。根据粪便潜血检测试剂盒的使用说明进行大便出血检测。造模后每隔一天观察DAI,动态观察结肠损伤程度和给药组的干预效果。
1.7.2 结肠组织病理检查 组织病理学观察取固定的结肠组织,常规程序化梯度脱水,乙醇二甲苯混合溶液、二甲苯程序化透明。处理好结肠组织后进行石蜡包埋,常规化修块、4~5 μm切片、展片、贴片、烤片。制片完成后进行苏木素—伊红染色,光学显微镜下观察结肠组织的病理变化。比较各组大鼠结肠粘膜层、黏膜下层和肌层的结构完整程度,大肠腺结构、隐窝形态、及炎性细胞的变化。
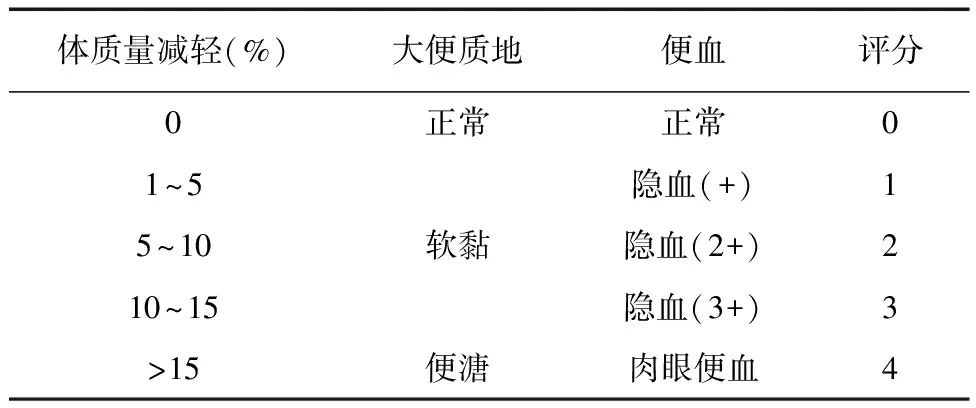
表1 DAI评分标准
1.7.3 血清炎症细胞因子和结肠组织神经肽水平检测 采用ELSIA法检测各组大鼠血清IL-6、IL-8、TNF-α及结肠组织5-HT、胃饥饿素、VIP、SP、NPY、CGRY水平。具体操作按照说明书进行。
1.8 数据处理

2 结果
2.1 各组大鼠DAI评分
在饲养期间,空白对照组大鼠精神状态良好,食欲、活动正常,体重逐渐增加,大便质地软硬适中。乙酸造模后,大鼠粪便不成形,可见肉眼血便,体质量明显下降(P<0.05)。实验过程中,模型组大鼠少动,食欲减退,饮水量减少,体重增长缓慢,毛色灰黄无光泽,脱毛,炸毛,大便质地偏软,不成形。各给药组大鼠体重逐渐增加,精神状态较好,进食和饮水量减少,毛发黄,无光泽,大便质地偏软。
与空白对照组比较,模型组、全方组、酸味组、苦味组、辛味组及阳性药组大鼠体质量增量明显降低,差异具有统计学意义(P<0.05)。与空白对照组比较,模型组大鼠大便质地、便血及DAI评分明显增加,差异具有统计学意义(P<0.05)。全方组、酸味组、苦味组DAI评分明显增加,差异具有统计学意义(P<0.05)。与模型组比较,甘味组大鼠体质量增量增加(P<0.05),全方组、酸味组、苦味组及阳性药组大鼠便血减少(P<0.05),各给药组DAI评分均降低(P<0.05),差异有统计学意义。见表2。

表2 各组UC模型大鼠体质量增量及DAI评分结果
2.2 各组大鼠结肠组织病理学变化
结肠组织大体观察结果表示,经4%乙酸造模后,结肠组织大面积充血溃烂,提示造模成功。给药7天后,模型组结肠组织仍可见0~2 cm2大小的溃疡,结肠壁增厚明显,与周围组织粘连,肉眼可见充血。各给药组大鼠存在局部充血,部分大鼠结肠组织与周围组织粘连。
经苏木素—伊红染色后,空白对照组结肠组织结构相对完整,固有层内有许多肠腺。黏膜下层和肌层结构完整。乙酸造模后结肠结构破坏,局灶区广泛的黏膜扭曲、脱落,肠腺大量减少,隐窝消失、萎缩;可见大量炎性细胞浸润,炎症细胞浸润粘膜下层。模型组大鼠结肠组织中结肠上皮细胞部分丢失,隐窝结构改变、分支、扭曲、萎缩,基底部增厚,粘膜基底部浆细胞增多。各给药组大鼠结肠上皮结构存在部分缺失,隐窝较模型组增加,保留大量黏液,可见淋巴细胞组和隐窝形态改变。见图1。

注:A 空白对照组;B 模型组(造模结束);C 模型组(实验结束);D 全方组;E 酸味组;F 苦味组;G 辛味组;H 甘味组;I 阳性药组。
2.3 各组大鼠血清组织炎症表达水平
与空白对照组比较,模型组大鼠血清IL-6、IL-8、TNF-α水平升高(P<0.05),差异具有统计学差异意义。
与模型组比较,全方组、酸味组、苦味组、辛味组、甘味组、阳性药组大鼠血清IL-6、IL-8、TNF-α水平均降低(P<0.05)。各给药组之间存在统计学差异,其中,酸味组、苦味组、辛味组IL-6水平较甘味组降低(P<0.05)。见表3。

表3 各组UC模型大鼠血清炎症因子水平
2.4 各组大鼠结肠组织神经肽表达水平
与空白对照组比较,模型组大鼠结肠组织VIP、SP、胃饥饿素、5-HT、NPY水平显著增加(P<0.05),CGRY水平显著降低(P<0.05)。
与模型组比较,全方组、苦味组、阳性药组大鼠结肠组织VIP、SP、胃饥饿素、5-HT、NPY水平显著降低(P<0.05),CGRY水平显著升高(P<0.05)。与模型组对比,酸味组大鼠结肠组织VIP、SP、胃饥饿素、5-HT、NPY降低(P<0.05);辛味组大鼠结肠组织VIP、胃饥饿素、5-HT降低(P<0.05),SP、CGRY水平显著升高(P<0.05);甘味组大鼠结肠组织VIP、SP、胃饥饿素、NPY降低(P<0.05),CGRY水平显著升高(P<0.05)。辛味组大鼠结肠组织SP水平较其余给药组大鼠结肠表达水平显著升高(P<0.05)。见表4。

表4 各组UC模型大鼠结肠组织神经肽表达水平
3 讨论
五味理论是药性理论的核心之一,通过五味与功效的关系指导临床遣方用药。五味本身也体现了阴阳的消长,如辛甘发散属阳,酸苦涌泄属阴。经方中仅乌梅丸一例通过四味合法配伍从运动和数量两方面协助人体的开阖消长过程。乌梅丸四味配伍同时实现了温阳滋阴、补虚泻实、寒热并调、气血兼治,可用于治疗证候错杂、反复发作性疾病,尤其适合肝脾胃肠功能失常。因此,本研究基于四味配伍方式对乌梅丸进行了拆方,从酸、苦、辛、甘四味来观察对UC大鼠的治疗具有协同或独特的作用。
UC的病理机制比较复杂,神经—免疫网络在UC病理过程中发挥双向调节作用。肠道免疫屏障改变诱导炎症反应发生,炎性介质刺激神经肽分布和表达水平异常[5],神经肽又能参与炎症反应。促炎细胞因子IL-6、IL-8、TNF-α是UC的炎症标志物,TNF-α诱导其他促炎细胞因子如IL-6的分泌和结肠腺癌的转化,TNF-α单抗英夫利昔已经被用于UC的治疗[6]。IL-6是早期结肠炎相关癌发生的关键肿瘤启动子,UC患者中呈增高表达[7]。IL-8能够吸引中性粒细胞、T细胞,研究表明上调与内镜检查严重程度正相关[8]。本课题组前期研究证实了乌梅丸能够减轻UC大鼠的炎症反应和UC的严重程度[9]。此次结果表明乌梅丸抗炎作用可能与抑制促炎因子IL-6、IL-8、TNF-α的表达有关,各拆方组DAI评分均降低,对UC具有初步的改善作用,酸、苦、辛、甘组能抑制IL-6,IL-8,TNF-α的水平,说明四味可能通过协同作用抑制炎症反应。
神经肽是神经—免疫网络的中间物质,多种神经肽参与UC的炎症免疫反应。VIP能够促进结肠修复和内稳态,抑制促炎细胞因子如IL-2、IL-6、γ干扰素的分泌来保护粘膜炎症[10]。炎症相关的水肿与VIP表达有关,VIP能调节粘膜水和电解质的分泌[11]。结肠VIP过度分泌会导致水样腹泻,UC出现的便溏及大便次数改变有关与该神经肽有关[12],部分研究表明患者结肠组织和血浆VIP增加[13]。本研究表明乙酸诱导的溃疡性结肠炎大鼠模型中结肠组织的VIP升高,乌梅丸及拆方组对VIP水平具有明显的降低作用,乌梅丸四味配伍可能通过VIP共同发挥止利作用。乌梅丸及其拆方可能直接调控和间接通过VIP抑制IL-6的释放。
SP是一种神经肽和疼痛传递介质,大量SP会对肠动力起抑制作用[14]。SP浓度与UC的疾病活动程度呈正相关,UC乳糜泻患者尤其明显[15]。神经末梢SP释放可以激活血小板释放5-HT,共同影响肠道分泌、运动[16]。本研究发现UC模型大鼠SP显著升高,模型处于UC活动期,全方组、酸味组、苦味组、甘味组均能降低SP,全方改善SP的效果更明显。辛味是五味中特殊的气味,辛味与痛觉相关,辛味药具有增加血流,血管通透性和强镇痛的药理作用,这种作用可能与辛味药刺激SP大量释放有关。研究发现附子、丁香这两位辛味药的配伍也能导致便秘大鼠血清P物质水平的升高[17],这与本文的研究结果类似。
胃饥饿素是一种潜在的UC神经肽指标,具有促进食欲和增加生长激素分泌、影响细胞的增殖和生存、显著的抗炎活性的作用,相关研究表明UC血浆和结肠黏膜胃饥饿素水平升高[18]。本研究发现UC模型大鼠胃饥饿素水平升高,表明给药组能降低模型组高水平胃饥饿素水平,其中,苦味组、辛味组似乎能更好发挥调节作用。
NPY刺激水和电解质的吸收,引起血管收缩,参与肠道应激反应[19]。NPY被认为具有促炎作用,在UC患者和DSS大鼠结肠炎模型中均发现免疫细胞激活后能够表达NPY,NPY以自分泌的形式调节免疫细胞[20]。UC患者自主神经系统亢进,患者心理压力增大,外周NPY水平增高,而进一步刺激肠道炎症[21]。本研究表明UC模型大鼠结肠组织NPY水平升高,全方组、酸味组、苦味组、甘味组均能降低NPY水平,表明乌梅丸及其拆方可能通过减轻炎症和压力发挥作用。
CGRY是感觉神经的主要成分,是UC诊断和治疗的靶点,CGRY能调节巨噬细胞、淋巴细胞等多种免疫细胞,抑制T细胞的增值,降低巨噬细胞抗原提呈和活化淋巴细胞[22]。在UC患者和动物模型中可见CGRY mRNA水平明显降低,与UC疾病程度相关[23]。本研究认为CGPY的水平与模型选择可能有一定的关系,乙酸化学灼烧能够直接损伤神经丛,降低CGPY的表达。全方组、苦味组、辛味组和甘味组升高CGPY水平,可能通过刺激CGPY修复神经存在的保护和促进黏膜愈合作用,或通过神经—免疫网络途径发挥作用。
5-HT参与调控肠道分泌、蠕动、内脏敏感性[24],研究表明5-HT还参与单核细胞/巨噬细胞中细胞因子的释放、T-淋巴细胞的激活和中性粒细胞的招募[25]。UC患者和动物模型可见结肠黏膜5-HT释放量增加,炎性浸润的结肠黏膜能够诱导释放更多的5-HT,且释放量与UC疾病活动程度呈正相关[26-27]。5-HT的增加也是导致UC患者肠分泌增加和内脏高敏感的原因之一,还能影响肠道分泌和吸收NPY[24]。异常高水平的5-HT也是造成UC患者发生情感障碍的危险因素之一[28]。本研究表明乙酸模型5-HT水平显著高于对照组,乌梅丸全方及其拆方能够降低5-HT水平,可能通过调节5-HT水平发挥改善内脏敏感和便溏症状的作用。乌梅丸及其拆方对UC炎症的抑制作用可能也能通过降低5-HT水平实现,这种调节作用是乌梅丸各拆方的协同作用。
本研究还观察了阳性药SASP对UC标志性神经肽的作用,SASP对神经肽和细胞因子均具有较好的调节作用。综上,乌梅丸及其拆方能够通过调节结神经—免疫网络中神经肽和细胞因子这一机制来干预UC,全方作用神经肽范围更为广泛,其余各拆方组对部分神经肽具有调节作用,各拆方组能够通过协同作用发挥抗炎作用。
——以“收”为主 多酸少辛

