金线莲提取物对脂多糖诱导的小鼠急性肺损伤的保护作用及机制研究
朱亮 包晓君 王群星 徐菲拉
急性肺损伤(acute lung injury,ALI)是指除心源性外的各种直接或间接因素所致的肺组织结构特征性病理改变而出现的临床综合征,年死亡率达30%~40%,是临床常见危重症[1]。目前ALI 尚无有效的治疗方法,患者预后并不理想。ALI发病机制仍未确切阐明,失控性炎症反应或是ALI病情进展中的关键环节[2]。细胞因子和炎症趋化因子因肺内炎症细胞过度活化、募集,在短时间内形成级联反应,产生“细胞因子风暴”,导致广泛肺上皮细胞和肺血管内皮细胞的损伤,最终造成ALI的发病及发展[3]。脂多糖(lipopolysaccharides,LPS)是革兰阴性菌细胞壁主要毒性成分,可诱导免疫细胞介导的炎症反应网络,引起一系列的前炎因子释放,进而诱发ALI,其诱导的体内实验模型与临床ALI 高度相似[4]。相较于腹腔注射LPS 的动物模型,鼻腔滴入LPS 诱导ALI 体内模型可更好地模拟ALI 的发病过程与机制[5]。金钱莲为兰科开唇兰属多年生草本植物,是民间珍贵的中药材,具有较明显的抗炎、镇痛、抗肿瘤、护肝、免疫调节、降血糖、降血压等药理作用,并已广泛应用于临床[6-10]。但金线莲对ALI的药理作用尚未见报道。本研究采用LPS 鼻腔滴注构建小鼠ALI 模型,观察金线莲对该模型的保护作用,并初步探讨其作用机制。
1 材料和方法
1.1 实验动物 60 只SPF 级雄性ICR 小鼠,体质量25~30 g,购于北京斯贝福生物技术有限公司,动物生产许可证号:SCXK(京)2019-0010。
1.2 药物与试剂 金线莲由浙江金华天宁堂生物科技公司提供,经金华市中心医院徐菲拉主任医师鉴定为Anoectochilus formosanus Hayata。金线莲提取物的配置:取金线莲生药64 g,加水1 000 mL 浸泡2 h,煎煮4 h,药液经旋转蒸发仪浓缩至160 mL 作为高剂量组(生药浓度0.4 g/mL),梯度稀释成中(0.2 g/mL)、低剂量(0.1 g/mL),备用;按70 kg 成人体重计算,成人给药剂量为0.285 g/kg,根据人与动物间体表面积折算的等效剂量比值[11],换算为本实验小鼠给药剂量:高剂量为5.200 g/kg,中剂量2.600 g/kg,低剂量为1.300 g/kg。LPS购于美国Sigma公司,批号为153963,使用时称取0.8 mg,用0.9%氯化钠溶液溶解定容至2 mL,4 ℃冰箱保存。
地塞米松粉剂购于上海源叶生物科技有限公司,批号:H07N9Z74419,使用时称取2.5 mg,用0.9%氯化钠溶液溶解定容至4 mL,4 ℃冰箱保存。人核因子κB抑制蛋白α(I-kappa-B-alpha,IκBα)抗体、髓过氧化物酶(myeloperoxidase,MPO)抗体均购于美国Proteintech公司,批号为00056584 和00045155;磷酸化细胞外信号调节蛋白激酶(phosphorylated extracellular signalregulated kinase,p-ERK)抗体、β 肌动蛋白(β-actin)和磷酸化IκBα(phosphorylated IκBα,p-IκBα)购于美国Affinity 公司,批号为56o9874、12w2944 和68m1458;小鼠IL-6 ELISA 试剂盒、小鼠单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)ELISA 试剂盒、小鼠IL-12/p70 ELISA 试剂盒、小鼠IFN-γ ELISA试剂盒、小鼠TNF-α ELISA 试剂盒、小鼠IL-10 ELISA试剂盒均购于江苏酶免实业有限公司,批号分别为MM-46428M1、MM-0082M1、MM-0174M1、MM-0182 M1、MM-46435 M1、MM-46420M1;细胞外信号调节蛋白激酶(extracellular signal-regulated kinases,ERK)抗体、p-ERK 抗体、c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)抗体、磷酸化JNK(phosphrylated JNK,p-JNK)抗体、p38抗体、磷酸化p38(phosphorylated p38,p-p38)抗体、腺苷单磷酸活化蛋白激酶α(adenosine monophosphate activated protein kinase α,AMPKα)抗体、磷 酸 化AMPKα(phosphorylated adenosine monophosphate activated protein kinase α,p-AMPKα)抗体、MPO抗体、山羊抗兔IgG 预吸附二抗均购买于美国Abcam公司,批号分别为GR3305911-2、GR1489866-8、GR70875 11-65、GR5455638-19、GR5455638-19、GR337 6466-11、GR0837100-56、GR40 28577-36、GR9346133-12、GR 3214733-25。二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒购于北京索莱宝科技有限公司,批号为20220218。
1.3 ALI 模型的建立及分组处理 小鼠适应性饲养1周后,随机分为模型组、对照组、地塞米松组、金线莲高、中、低剂量组,每组10 只。模型组、对照组给予0.9%氯化钠溶液灌胃,地塞米松组给予地塞米松5.0 mg/kg 溶液腹腔注射,金线莲高、中、低剂量组分别给予不同剂量(1.3、2.6、5.2 mg/kg)的金线莲提取物灌胃,均为0.33 mL/只;连续给药2 d[12]。48 h后用4%水合氯醛溶液按0.01 mL/g 腹腔注射麻醉小鼠,对照组给予0.9%氯化钠注射液滴鼻,其余各组给予LPS 滴鼻,50 μL/只。4 h后,重复给药1次。24 h后造模完成[13]。取LPS 处理过的小鼠颈椎脱臼处死,剥离肺组织制备石蜡切片,采用常规HE 染色法进行组织病理学观察,以肺组织肺泡壁增厚,炎性细胞浸润等病理变化判断ALI 模型制备成功。随后每组取5 只小鼠,颈椎脱臼处死;解剖并暴露支气管及肺组织,使用0.9%氯化钠溶液从支气管内注入肺部后吸出,冲洗3 次,获得肺泡灌洗液;4 ℃3 000 r/min 离心10 min,收集上清液并分装后置于-80 ℃冰箱保存,备用。解剖取肺组织,滤纸吸水后称湿质量并记录;取部分左肺脏以10%甲醛固定,剩余左肺称质量。新鲜右肺置于-80 ℃冰箱保存备用。
1.4 指标检测
1.4.1 6 组小鼠肺组织病理学检查 采用HE 染色法,显微镜下观察各组小鼠组织病理变化。
1.4.2 6 组小鼠肺组织湿干比(wet/dry,W/D)的检测取部分左肺组织,洗去残留血液,用滤纸吸干表面水分后称质量,得到湿质量(W)。随后放入60 ℃烘箱内烘48 h,再次称质量,得到干质量(D),计算W/D。W/D 越大,表示肺组织的水肿程度越高。
1.4.3 6组小鼠肺泡灌洗液中炎症细胞因子的检测 采用ELISA 法。按照相应试剂盒说明,测定肺泡灌洗液中IL-6、MCP-1、IL-12/p70、IFN-γ、TNF-α和IL-10水平。
1.4.4 6 组小鼠肺组织中MPO、p-ERK、IκBα 和p-IκBα 蛋白表达水平的检测 采用免疫组化法。取剩余左肺组织,按免疫组化试剂盒说明经过脱腊、抗原修复后进行免疫组化检测。显微镜下观察并拍照,棕黄色为阳性信号。应用Image Pro Plus 软件测量图像的累积光密度值和区域面积值,以两者比值确定肺组织中MPO、p-ERK、IκBα 和p-IκBα 蛋白表达水平。
1.4.5 6 组小鼠肺组织中ERK、p-ERK、JNK、p-JNK、p38、p-p38、AMPKα、p-AMPKα、MPO 蛋白相对表达量检测 采用Western bolt 法。取右肺组织裂解,根据BCA 定量检测试剂盒方法检测总蛋白。电泳分离,转膜、封闭液封闭,用TBST 洗膜3 次,10 min/次,将膜放入含ERK、p-ERK、JNK、p-JNK、p38、p-p38、AMPKα、p-AMPKα、MPO 一抗稀释液的孵育盒中,4 ℃摇床振荡孵育过夜;TBST 洗净后,用5%脱脂奶粉封闭液稀释二抗,室温摇床振荡反应1~2 h,用TBST 洗净后加入ECL 发光试剂充分接触反应3 min。凝胶成像仪成像后,chemi capture 软件保存图像,以β-actin 为内参,采用Image J 软件分析各蛋白相对表达量。
1.5 统计学处理 采用SPSS 22.0 统计软件。计量资料以表示,两组样本间比较选用两独立样本t检验,多组样本间比较采用单因素方差分析,两两比较采用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 6 组小鼠肺组织病理学观察 对照组肺组织结构基本正常,层次清晰,未见明显病理学变化;模型组肺组织出现大量炎症细胞浸润,组织结构破坏;地塞米松组与金线莲高剂量组少量炎症细胞浸润,组织结构基本完整;金线莲中剂量组和金线莲低剂量组有较多炎症细胞浸润,组织结构存在破坏,见图1(插页)。

图1 小鼠肺组织病理学观察
2.2 6 组小鼠肺组织W/D 比较 与模型组比较,对照组、地塞米松组、金线莲高剂量组、金线莲中剂量组肺组织W/D 显著降低(P<0.01),见表1。
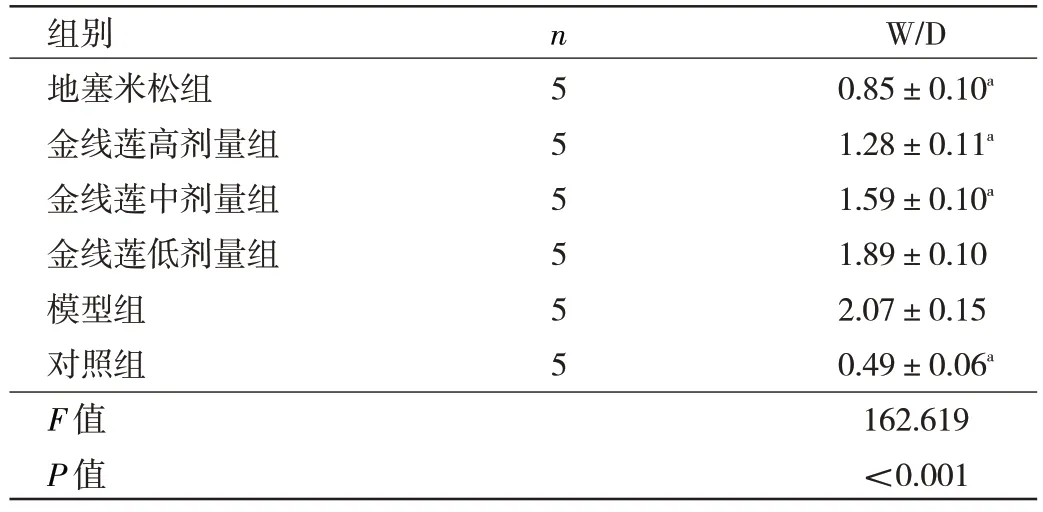
表1 6 组小鼠肺组织的W/D 比较
2.3 6 组小鼠肺泡灌洗液中炎症细胞因子水平的比较 与模型组比较,对照组、地塞米松组、金线莲高剂量组肺泡灌洗液中IL-6、MCP-1、IL-12/p70、IFN-γ、TNF-α 和IL-10 的水平均显著降低(均P<0.05);金线莲中剂量组IL-6、IFN-γ、TNF-α 和IL-10 水平均显著降低(均P<0.05),金线莲低剂量组,各炎症细胞因子水平变化均无统计学意义(均P>0.05),见表2。

表2 6 组小鼠肺泡灌洗液中炎症细胞因子水平比较
2.4 6 组小鼠肺组织中MPO、p-ERK、IκBα 和p-IκBα蛋白表达水平比较 与模型组相比,对照组、地塞米松组与金线莲高剂量组肺组织MPO、p-ERK、p-IκBα蛋白表达水平均显著降低(均P<0.05),但IκBα 蛋白表达水平均无显著性变化(均P>0.05)。见图2(插页)和表3。

图2 免疫组化检测小鼠肺组织MPO、IκBα、p-ERK、p-IκBα 的表达情况
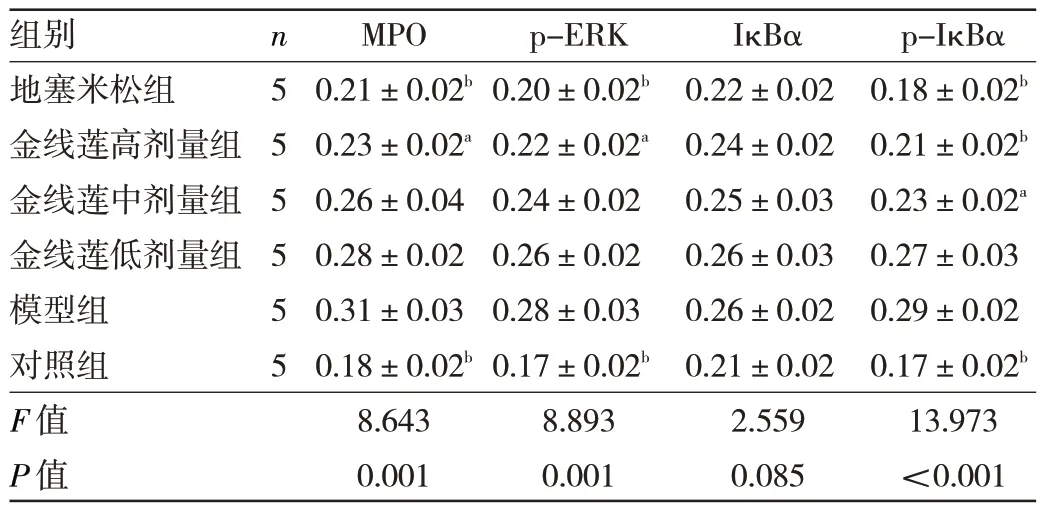
表3 6 组小鼠肺组织中MPO、p-ERK、IκBα 和p-IκBα 蛋白表达水平比较
2.5 6 组小鼠肺组织中ERK、p-ERK、JNK、p-JNK、p38、p-p38、AMPKα、p-AMPKα、MPO 蛋白相对表达量比较 与模型组相比,对照组、地塞米松组、金线莲高剂量组、金线莲中剂量组肺组织中p-ERK、p-JNK、pp38、p-AMPKα、MPO 蛋白相对表达量显著降低(均P<0.01),ERK、JNK、p38、AMPKα 蛋白相对表达量未见显著变化,见图3 和表4。

图3 小鼠肺组织中ERK、p-ERK、JNK、p-JNK、p38、p-p38、AMPKα、p-AMPKα、MPO 蛋白电泳图

表4 肺组织中ERK、p-ERK、JNK、p-JNK、p38、p-p38、AMPKα、p-AMPKα、MPO 蛋白相对表达量比较
3 讨论
ALI 是一种以呼吸困难、急性低氧呼吸衰竭、双侧肺浸润、肺水肿、进行性低氧血症等症状为特征的危重症综合征,当氧合指数<200时即被称为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),ARDS 是由ALI 发展而来的一个复杂的级联过程,是同一疾病过程的两个阶段[14]。该病发病率较高,是新型冠状病毒感染重症患者的常见并发症。目前临床上缺乏特异有效的治疗手段,通常只能采用以控制感染、机械通气、液体管理等为主的支持性治疗。研究发现,以金线莲为主药的方剂治疗新型冠状病毒感染患者,可显著改善患者咽痛、发热、喘憋气促等临床症状,缩短呼吸道病原核酸检测转阴时间[15]。这提示金线莲可能对LPS诱导的ALI小鼠具有保护作用。
炎症反应在ALI 的发病过程起到关键作用。炎症反应促使过多的炎症细胞迁移并释放大量促炎和细胞毒介质,造成血管通透性广泛增加和上皮损伤,导致间质及肺泡水肿和透明膜发育,过度的炎症过程在ALI 的病理生理中起着关键的有害反应,有效控制过度炎症反应的发生、发展是目前治疗ALI 的重要策略[16-17]。金线莲提取液通过抑制巨噬细胞释放炎性因子和上调抗炎因子水平发挥对LPS 诱导的小鼠急性炎症反应的保护作用[18]。本研究结果显示,与对照组相比,LPS 模型小鼠肺组织病理切片伴有明显的炎症细胞浸润,肺泡间隔及肺泡壁增宽,肺组织的W/D 升高,说明模型建立成功。使用金线莲提取物干预ALI 小鼠,小鼠肺组织病理损伤有所减轻,炎症细胞浸润改善。这提示金线莲提取物对LPS 所致ALI 小鼠肺部病理变化有较好的改善作用。ELISA 检测显示高剂量金线莲提取物可使肺泡灌洗液中IL-6、MCP-1、IL-12/p70、IFN-γ、TNF-α 和IL-10 水平不同程度降低(均P<0.05),提示金线莲提取物通过抑制炎症过度反应、降低中性粒细胞的浸润来保护LPS 诱导的ALI。
MPO 是中性粒细胞外捕网的重要成分,亦是中性粒细胞的功能标志和激活标志,具有促氧化和促炎的特性,其异常表达可激活炎症反应信号进而诱发各种慢性炎症性疾病[19-20]。本研究的Western blot 检验和免疫组化实验均验证了金线莲提取物可使经LPS 诱导的ALI 小鼠肺组织中升高的MPO 表达水平显著降低,提示金线莲提取物具有显著的抗炎作用。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路中的丝氨酸/苏氨酸蛋白激酶参与了全身炎症反应及其调控机制。目前研究表明,ALI 过程中MAPK 信号通路可调节下游产物活性,影响炎症细胞黏附血管内皮、在炎症部位激活并释放炎症因子[21]。其中,ERK、JNK 和p38 等蛋白质已证实与ALI 关系密切[22]。当MAPK 通路被激活时,p-ERK、p-p38 和p-JNK 单独或联合转移到细胞核,诱导相关炎症因子靶基因的表达并促进炎症反应。研究发现,泽漆水提物可通过下调JNK、p38、ERK1/2 蛋白表达,降低炎症因子TNF-α、IL-6 等细胞因子的分泌,从而减轻LPS 诱导的ALI 的炎症反应,减轻肺部损伤;麻杏石甘汤通过抑制炎症反应以改善LPS 诱导的ALI,原因可能是麻杏石甘汤可显著下调肺组织中NF-κB、ERK1/2、JNK 和p38 的蛋白表达从而影响MAPK/NF-κB 信号通路;p38 抑制剂可通过调节Treg 细胞和Th17 细胞失衡来减轻LPS 导致的ALI[23-25]。种种证据表明,MAPK 信号通路可作为研究治疗ALI 的潜在病理机制。本研究显示,相较模型组,金线莲高、中剂量组肺组织中p-ERK、p-JNK、pp38、p-AMPKα 和MPO 蛋白相对表达量显著降低,p-ERK、p-IκBα 和MPO 蛋白表达水平显著降低,提示金线莲对ALI 小鼠的抗炎作用机制可能与调节MAPK 信号通路有关。
综上所述,金线莲一定程度上改善了LPS 诱导的小鼠ALI,其潜在的机制可能是通过MAPK 信号通路干预细胞因子,发挥抗炎作用。但本实验未能就金线莲对MAPK 信号通路靶向调节作用及其上下游蛋白的反馈性调节作用进行研究,拟在今后的实验中对上述问题做进一步讨论。总之,调控MAPK 信号转导通路干预“细胞因子风暴”是金线莲防治ALI 的有效靶点之一,提示金线莲药物及其新型制剂的开发可能是一种新的治疗策略。

