生物信息学分析TOP2A在肝细胞癌中表达和预后机制及其对肝癌增殖、迁移的影响*
刘有浩 栾欣怡 杨 莹 李浩然 李宏彬
山西医科大学汾阳学院,山西省汾阳市 032200
肝癌(Hepatocellular carcinoma,HCC)是常见的恶性消化道肿瘤之一,发病率高,手术效果欠佳,预后极差[1]。大多数肝癌患者都是在后期确诊的,很大程度上耽误了最佳治疗时间,因此了解与肝癌发病有关的分子机制,并找寻有价值的肝癌生物因素标志供临床参考诊断十分具有意义。
有研究表明拓扑异构酶(DNA)Ⅱα[Topoisomerase (DNA) Ⅱ alpha,TOP2A]可以促进癌细胞的增殖和迁移,如髓母细胞瘤[2]、肺癌细胞[3-4]、甲状腺癌[5]及食管鳞状细胞癌细胞[6-7],充分证实了TOP2A 作为生物标志因素影响肿瘤的发生和发展,可以作为癌症诊断和预后的重要指标。本研究通过生物信息学方法探讨TOP2A在肝癌中的表达,并且降低肝癌细胞中TOP2A的表达,观察其对细胞增殖和迁移能力的影响,分析其在HCC发生发展中的作用机制,为患者的早期诊断提供新的思路和依据。
1 材料和方法
1.1 实验试剂及仪器 人肝癌细胞(HepG2细胞株)、TOP2A抑制剂(锐博生物)、DMEM培养基(Gibco)、青链霉素(美仑)、胎牛血清(ExCell Bio)、无菌PBS缓冲液(美仑)、0.25%EDTA胰酶(美仑)、T25培养瓶(NEST)、6孔板、96孔板(NEST)、CCK-8试剂盒(博士德)、引物(生工生物)、RNA提取试剂盒(聚合美)、RNA逆转录试剂盒(聚合美)、SYBR Green试剂盒(聚合美)、0.2mL 8联管(NEST)。
1.2 TOP2A在肿瘤组织和细胞系的差异表达 通过TIMER 2.0在线数据库 (http://timer.cistrome.org)选择 Exploration栏目下的Gene_De,输入基因名TOP2A后点击submit,分析比较TOP2A在33种肿瘤组织和癌旁组织中的表达情况,癌组织和癌旁组织中TOP2A的表达差异有统计学意义用灰色背景标识。利用HPA数据库(https://www.proteinatlas.org/),文字框中输入基因名TOP2A,选择cell line,得到TOP2A在不同肿瘤细胞系和TOP2A在不同肝癌细胞中的表达结果。
1.3 TOP2A在肝癌组织和癌旁组织中的表达 利用GEPIA2数据库(http://gepia2.cancer-pku.cn/#index)选择Expression DIY栏目,输入基因名TOP2A,以log2FC<1且P<0.01为筛选条件,疾病类型选择肝癌(LIHC),分析TOP2A在TCGA数据库肝癌组织和癌旁组织的表达差异。GEO数据库(http://gepia2.cancer-pku.cn/#index)中下载GSE56267和GSE121248数据集,运用R软件处理数据,使用Graphpad软件比较TOP2A在肝癌组织和癌旁组织中的表达差异。
1.4 TOP2A表达与肝癌患者预后之间的关系 利用GEPIA2数据库(http://gepia2.cancer-pku.cn/#index)选择Survival Analysis,输入基因名TOP2A,疾病类型选择肝癌(LIHC),分析TOP2A mRNA表达与患者的生存预后关系。
1.5 TOP2A基因共表达和GSEA富集分析 利用Linkedomics在线数据库(http://www.linkedomics.org/login.php)设置参数疾病类型:肝癌,数据类型:TCGA-LIHC,基因名称:TOP2A,统计方法: person 相关系数,分析肝癌组织中TOP2A共表达的正负相关基因。选择“LinkInterpreter”菜单,对该数据库筛选出的相关基因进行KEGG 通路富集分析。
1.6 细胞培养及分组 HepG2细胞接种于含 10%胎牛血清的 DMEM 培养液中, 37℃、5%CO2培养箱内培养,显微镜下观察细胞融合达到80%~90%,吸出培养基,并PBS洗3次,胰酶消化,重悬细胞液,调整细胞浓度为1×105,接种于6孔板中,24h后加药换液,参照锐博转染试剂riboFECTTM说明书进行实验。分为两组,阴性对照组(Control组)使用阴性对照siRNA进行转染,实验组使用TOP2A抑制剂(浓度为50nM)进行转染,继续将细胞放置于培养箱中培养,48h后提取RNA,使用QPCR检测沉默效果。
1.7 细胞划痕实验 对数生长期细胞消化后重悬细胞悬液,显微镜下计数,以1×104个/孔接种于6孔板,置于37℃、5%CO2培养箱中培养24h,待细胞融合至80%,进行转染,转染24h后,用20μL枪头比着直尺,垂直于培养板划痕,吸出培养基,无菌PBS洗涤细胞,去除细胞碎片,置于细胞培养箱中培养,分别于0h、24h使用倒置显微镜观察结果并照相, Image J软件测量划痕面积。设立三组平行试验,用Graphpad软件统计分析实验结果。
1.8 CCK-8 法检测细胞增殖能力 设置对照组和实验组(分组参考材料方法1.6),将HepG2以2×103个/孔接种于96孔板,每组5个复孔,细胞培养24h,待细胞贴壁良好后吸出培养基,进行转染,在培养箱中分别孵育0h、12h、24h三个时间点,吸出培养基,预混CCK-8与培养基1∶9比例制成溶液,每孔加入100μL的混合液,将培养板放置于37℃、5%CO2的细胞培养箱中孵育1h,使用酶标仪检测各孔在450nm波长处的OD值,实验至少重复3次。
1.9 统计学方法 运用GraphPad 8.0 软件进行统计学分析和绘图。实验均重复3次,所有数据以均数±标准差表示,组间数据比较使用独立样本t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 TOP2A在肿瘤组织和细胞系中的差异表达 利用TIMER2.0在线数据库,对TOP2A在正常组织与肿瘤组织中的表达进行研究,结果表明与正常组织相比,肿瘤组织中TOP2A在膀胱移行细胞癌、乳腺浸润性癌、胆管癌、结肠癌、食管癌、头颈部鳞状细胞癌、肾嫌色细胞癌、肾透明细胞癌、肾乳头状细胞癌、肝脏肝细胞癌、肺腺癌、肺鳞状细胞癌、前列腺腺癌、直肠腺癌、胃腺癌、甲状腺癌、子宫内膜癌中表达明显上调,具有统计学意义(P<0.05),见图1a。HPA数据库结果显示,TOP2A在胆管癌、骨癌、宫颈癌、食管癌、肝癌、白血病、肺癌、淋巴癌、睾丸癌等细胞中均有表达,见图1b。通过进一步的分析发现TOP2A在Hep-G2、Hep3B2.1-7、Huh-7、PLC/PRF/5等肝癌细胞系中表达上升,见图1c,充分佐证了TOP2A可能参与肝癌的发生发展进程。

图1 TOP2A在肿瘤组织和细胞系中的差异表达
2.2 TOP2A在肝癌组织和癌旁组织中的表达及肝癌患者预后的关系 通过GEPIA数据库,研究关于TOP2A基因在160例正常组织和369例肝癌组织中的表达差异,结果显示TOP2A在肝癌组织中的表达水平明显高于正常组织,见图2a。在GSE45267数据集和GSE121247数据集中对TOP2A在正常组织和肝癌组织的表达差异进行进一步的验证,结果表明,与正常组织相比,TOP2A在肝癌组织中显著高表达,见图2b、c。通过此三组数据验证TOP2A在肝癌组织和正常组织的表达情况,结果一致表明TOP2A在肝癌组织中表达均显著上升,差异有统计学意义(P<0.001)。利用生存分析探索TOP2A不同表达对HCC患者预后的影响,通过GEPIA2数据库对182例TOP2A高表达组和182例TOP2A低表达组HCC患者预后的情况进行分析,结果显示TOP2A高表达组患者总生存周期明显低于低表达组患者,差异具有统计学意义(P<0.05),见图2d。

图2 TOP2A在肝癌组织和癌旁组织中的表达及肝癌患者预后的关系
2.3 TOP2A基因共表达和GSEA富集分析 为了进一步探究TOP2A在肝癌中的发展机制,通过LinkedOmics 数据库寻找肝癌中与TOP2A共表达相关基因,结果表明,19 922个基因与TOP2A表达相关,见图3a,与TOP2A表达呈正相关的有13 571 个基因,相关性最强的前50个基因为KIF18B、BUB1B等,见图3b,6 351个基因与TOP2A表达呈负相关,负相关性最强的前50的基因为NDUFF1、CCL14等,见图3c。相关基因GSEA富集分析后, KEEG 通路富集分析表明,TOP2A可能参与细胞周期、DNA复制、P53信号通路、氧化磷酸化等过程,见图3d。
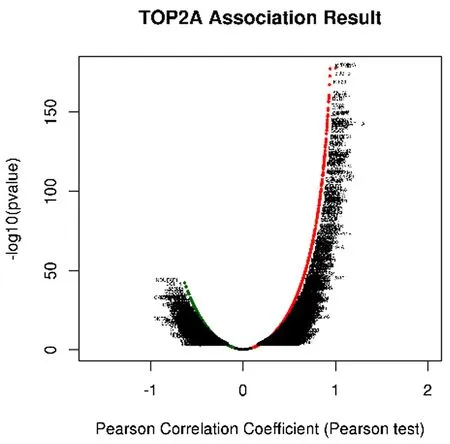
a
2.4 抑制TOP2A基因对细胞增殖和迁移的影响 HepG2细胞接种于含 10%胎牛血清的 DMEM 培养液中,在适宜条件下进行培养,待实验操作结束后分成对照组和实验组,采取不同的措施,对照组用siRNA进行转染,实验组加入TOP2A抑制剂,然后提取两组的RNA,使用QPCR检测沉默效果,发现抑制剂
a、b、c分别为TOP2A在GEPIA数据库、GSE45267数据集、GSE121247数据集中肝癌组织和正常组织中的表达情况 d.GEPIA2数据库中TOP2A表达与肝癌患者生存期的关系。*P<0.05,****P<0.000 1在50nM、48h的条件下,TOP2A在肝癌细胞系中的表达明显下降,见图4a。

a
利用细胞划痕实验来检测TOP2A对肝癌细胞迁移的影响,实验结果发现,在0h时,两组划痕面积的大小基本一致,对于肝癌细胞迁移的影响无较大差别,但培养24h后,发现对照组划痕面积明显变小,实验组划痕面积相较于0h时并没有明显变化,除此之外,对照组中肝癌细胞的数量显著增多,呈现双层甚至三层排列,而实验组中肝癌细胞的数量变化不大,分布较为散在,见图4b、c。这就表明,降低TOP2A表达后肝癌细胞的迁移能力下降。
利用CCK-8对正常组和实验组肝癌细胞的增殖进行研究,结果观察到,在0~24h内,正常组肝癌细胞的增殖随时间的推移逐渐上升,而实验组肝癌细胞的增殖恰好相反,随时间的推移而逐渐下降,且在12h和24h时,肝癌细胞增殖下降得尤为明显,见图4d。表明降低TOP2A使肝癌细胞的增殖明显下降。
3 讨论
肝癌作为严重威胁人类健康的恶性肿瘤之一,其发病率和死亡率逐年明显上升[8-9],目前虽有手术切除、药物治疗等措施,但因发现时已为肝癌中晚期而导致治疗结果不佳,况且预后效果较差[10],因此深入研究肝癌的发生发展机制,探究有价值的生物因素标志对于临床早发现、早诊断、早治疗十分具有意义。TOP2A作为染色体上的上调基因,通过参与DNA的转录复制以及染色体的凝集分离等过程调节拓扑状态和结构[11-12]。研究表明TOP2A 的表达常见于 S 期、G2 期和 M 期,而其表达异常可影响生物节律,在肿瘤细胞的发生、侵袭、转移、化疗耐药等过程中有着重要作用[13-15]。本文利用生物信息学以及体外验证实验找寻肝癌的核心基因TOP2A并且分析其在肝癌发病以及预后过程的重要价值。
本文研究中,首先通过TIMER 2.0在线数据库,分析33组肿瘤组织和癌旁组织中TOP2A的表达情况,其次利用HPA数据库,探索TOP2A在不同肿瘤细胞系和TOP2A在不同肝癌细胞中的表达结果,结果表明,与正常组织相比,TOP2A在大部分肿瘤组织中的表达均明显上调(P<0.01),说明其可能作为肝癌的诊断标志物,然后进行进一步的调查,发现TOP2A在Hep-G2、Hep3B2等肝癌细胞系中的表达显著上升,说明TOP2A有望作为肝癌的新生物标志因素。利用GEPIA2数据库,剖析TOP2A在TCGA数据库中369例肝癌组织和160例癌旁组织的表达差异,研究显示,其在肿瘤组织中的表达含量远高于正常组织,进一步论证了TOP2A参与肝癌的发生与发展。GEPIA2数据库中选取TOP2A高表达组182例和TOP2A低表达组182例肝癌预后情况,解析了TOP2A的表达与患者生存预后的关系,发现高表达组明显缩短了患者的生存周期,高表达与患者的预后明显负相关。最后,利用Linkedomics在线数据库,寻找肝癌中与TOP2A共表达相关基因,结果显示19 922个基因与TOP2A表达相关,与TOP2A表达呈正相关的有KIF18B、BUB1B等13 571 个基因,NDUFF1、CCL14等6 351个基因与TOP2A表达呈负相关,通过TOP2A基因共表达和GSEA富集分析,KEGG通路富集证明了TOP2A可能参与细胞周期、DNA复制、P53信号通路、氧化磷酸化等过程,调控机体细胞增殖,免疫反应等过程,细胞周期的失控是肿瘤恶性转化的标志之一,其功能失控可导致肿瘤细胞向远处转移[16]。通过这一系列的生物信息学方法,可以判定TOP2A可以作为评估肝癌的生物因素标志。
为进一步验证TOP2A对肝癌的影响,利用人肝癌细胞株HepG2进行细胞培养,待培养结束后,分为正常组和实验组,经过实验验证,发现在50nM、48h的条件下,TOP2A在肝癌细胞系中的表达会明显下降,细胞划痕实验表明抑制TOP2A表达后肝癌细胞迁移能力显著下降,通过CCK-8实验来探索TOP2A对于肝癌细胞增殖的影响,观察发现24h内,正常组中肝癌细胞的增殖上升,但实验组中肝癌细胞的增殖下降,所以我们可以判定,TOP2A可以促进肝癌细胞的增殖。经过生物信息学和体外实验的结果,提示TOP2A对于肝癌的发生发展有显著的影响。
综上所述,TOP2A在肝癌组织中高表达,参与肝癌的发生发展且与不良预后密切相关,可以作为肝癌早期诊断和预后的新生物指标,抑制TOP2A后能够阻抑肝癌细胞的增殖和迁移[17],因此也给肝癌免疫治疗提供新靶点。本研究也有一定的局限性,研究中检测的样本量较小,关于TOP2A是否可以作为肝癌诊断的标志性基因还应扩大样本量并且做更深入的研究;缺乏动物实验,未考虑肝癌细胞在体内和培养皿环境不同所造成的差异,也未考虑多种动物模型下不同肝癌细胞种类的差异。除此之外研究单单利用了在线数据库和体外验证实验,还需要后期收集临床样本,同临床结合验证其在肝癌中的表达差异和相关性。本研究也为TOP2A的后续研究提供了一定的思路和依据。

