结核分枝杆菌SepF蛋白的生物信息学分析
宋娜娜 李永明 山东省青岛市精神卫生中心 266034
由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)引起的结核病(TB)是导致人类死亡的重要原因。2022年约140万人死于TB[1]。此外,耐药结核病例大幅度增长。Mtb感染很难治疗,因为Mtb的大部分生命周期都处于非复制(NR)状态。由于NR Mtb对抗生素作用具有高度耐受性,并且可以突变为耐药性(DR),因此常规结核病(TB)治疗无效。适当控制细胞内病原体Mtb的细胞分裂对其生长、存活、发病机制和抗生素耐药性至关重要。然而,分枝杆菌调节其细胞周期的分裂成分和机制尚不完全清楚。细胞分裂是细菌繁殖的必要过程了解分枝杆菌的分裂机制及相关作用蛋白可能有助于TB新型疫苗的研发。有研究表明Mtb的Rv2147c基因及其编码的SepF蛋白是一种细菌细胞分裂相关蛋白[2],参与细菌细胞分裂过程但在TB中结构和功能尚不明确。本研究利用生物信息学方法预测SepF蛋白的结构和功能,为抗结核药物靶点选择提供理论依据。
1 资料与方法
1.1 目的基因及相关编码信息获取 从GenBank数据库中获取SepF蛋白的核酸及氨基酸序列等信息。SepF蛋白的Gene ID为887394,其蛋白序列为NP_216663.1。
1.2 方法
1.2.1 Rv2147c基因相关信息分析。Rv2147c基因序列信息从NCBI获取,使用ORF Finger软件分析其开放阅读框。
1.2.2 SepF蛋白基本理化性质分析。SepF蛋白的理化特征(如分子质量、分子式、氨基酸构成、不稳定指数等)采用Expasy的Protparam预测。
1.2.3 SepF蛋白的亲疏水性及信号肽、跨膜区、磷酸化位点分析。蛋白磷酸化位点是与细胞内信号传导相关的调节生物活性的特定位点。SepF蛋白的亲疏水性采用ProtScale分析;采用SignaIP6.0 Server分析信号肽;采用PSORTb分析亚细胞定位;采用DEEP TMHMM分析跨膜区;采用NetPhos3.1分析磷酸化位点。
1.2.4 SepF蛋白二级结构分析与三级结构建模。将SepF蛋白氨基酸序列输入SOPMA软件分析SepF蛋白的二级结构;SWISS-MODEL软件通过分析氨基酸序列构建三级结构模型。
1.2.5 蛋白质抗原表位分析。应用IEDB软件预测SepF蛋白的B细胞表位,预测优势抗原表位;采用软件预测分析T细胞抗原表位,选取HLA-A*02:01基因型>21分的优势抗原表位进行综合分析。
1.2.6 相互作用蛋白预测。SepF的互作蛋白利用STRING数据库预测并对其生物学功能进行富集。
2 结果
2.1 Rv2147c基因相关信息及序列分析 Rv2147c基因的位于Mtb H37Rv的2406118-2406843,全长657bp,CG含量约占64%。SepF蛋白由218个氨基酸构成,序列号为NP_216663.1。Rv2147c含有3个ORF,最长ORF 657 bp,编码218个氨基酸(见图1)。

图1 Rv2147c基因的开放阅读框分析
2.2 SepF蛋白的理化性质 SepF蛋白由218个氨基酸构成,分子质量为25 027.83ku,等电点5.40。SepF分子式为C1095H1668N320O337S10,包含3 430个原子。预测SepF蛋白脂肪指数为49.36,不稳定指数53.74,可能为不稳定蛋白。
2.3 SepF蛋白的亲疏水性及信号肽、跨膜区、磷酸化位点分析 SepF蛋白亲水性系数最高得分为2.222,最低得分为-2.889,为亲水性蛋白(见图2a)。PSORTb分析结果显示,SepF蛋白定位于胞质。使用SignaIP6.0 Server软件预测的SepF蛋白信号肽(见图2b),标准值D值小于阈值,表明SepF蛋白无信号肽端。TMHMM结果表明,SepF蛋白无跨膜螺旋(见图2c),且218个氨基酸位于膜内侧的可能性为1.0。NetPhos 3.1结果显示,28个磷酸化位点(13个Serine,6个Threonine,9个tyrosine)存在于SepF蛋白(见图2d)。
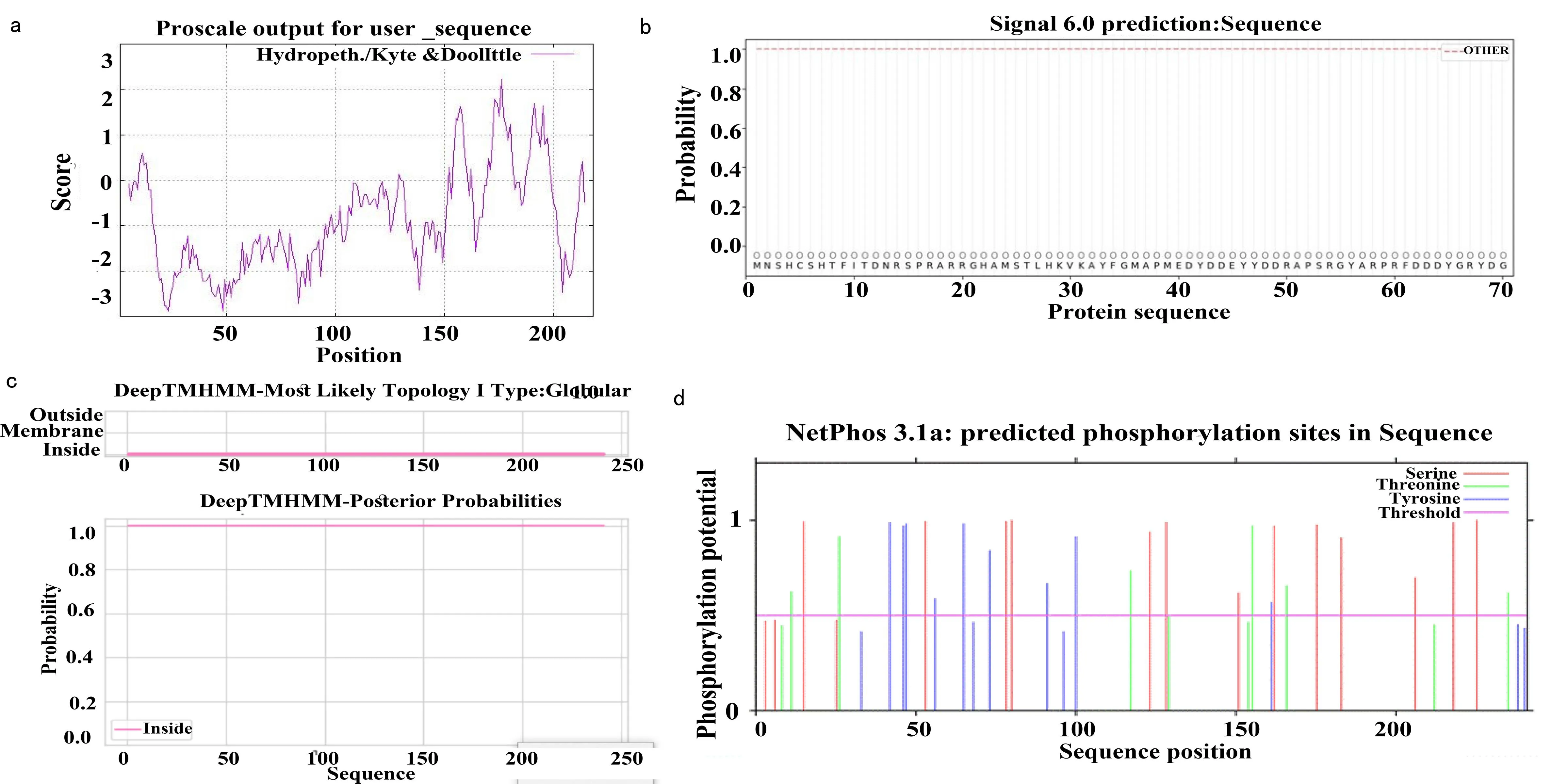
图2 SepF蛋白的亲疏水性及信号肽、跨膜区、磷酸化位点分析
2.4 SepF蛋白的二、三级结构 使用SOPMA进预测SepF蛋白二级结构(见图3a),其中包含29.05%的Hh,8.71%的Ee,3.32%的Tt,58.92%的Cc。SepF蛋白三级结构模型(见图3b)。
2.5 SepF蛋白相关抗原表位 应用IEDB软件预测SepF蛋白的B细胞表位,其中序列10-22,39-149,162-163等为优势抗原表位。采用软件预测分析T细胞抗原表位,HLA-A*02:01其中>21分以上的有8个。
2.6 SepF相互作用蛋白 STRING数据库预测SepF的互作蛋白,结果见图4。包括ftsQ、ftsZ、ftsW、Rv2148c、yfiH等可与SepF蛋白相互作用富集于细胞分裂生物学过程。Rv2148c是一种非必需的保守蛋白,功能未知。在大肠杆菌中,yfiH有助于维持肽聚糖的组成,并且从大肠杆菌染色体中敲除pgeF导致丝氨酸或甘氨酸掺入细胞壁,导致对β-内酰胺类抗生素的敏感性增加。在革兰阳性菌细胞分裂起始阶段聚合的FtsZ与SepF组合形成一种称为原环的结构。在原始环形成后,“晚期”分裂蛋白(ftsQ、ftsW等)开始组装以促进参与细胞壁重塑的下游过程[3]。
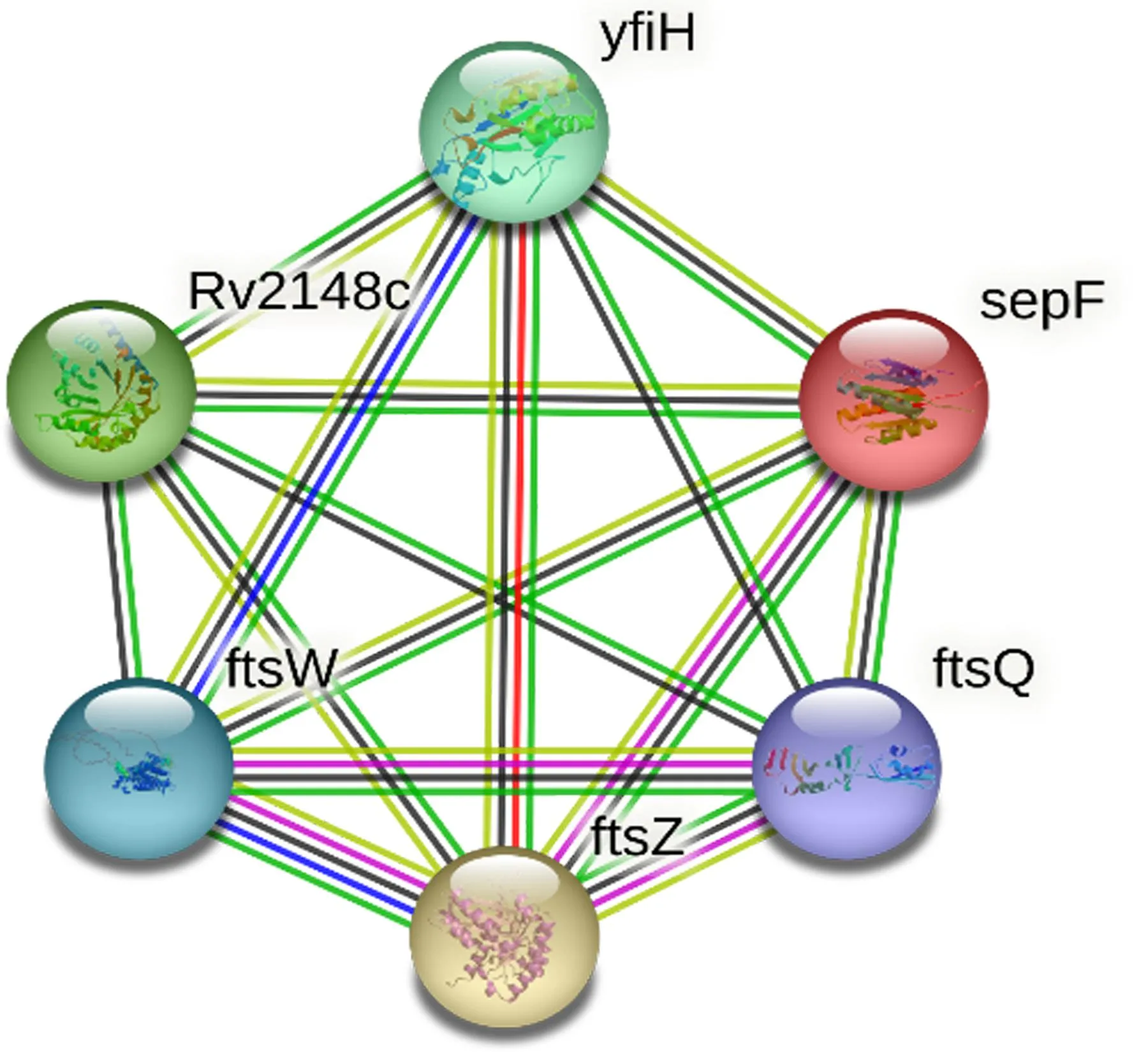
图4 SepF蛋白的相互作用蛋白预测
3 讨论
耐多药结核和广泛耐药结核的出现严重威胁人类和公共卫生安全。细菌对3种或3种以上“二线”抗生素的耐药性被归类为极度耐药结核病(XDR-TB),迫切需要开发具有新作用机制的新型抗结核药物,与真核细胞不同,细胞分裂在很大程度上仍未用于开发新的细菌治疗目的。细胞分裂是生物发展过程中的基本环节,因此它是开发抗结核药物的一个非常有希望的目标。
生物信息学分析显示SepF蛋白氨基酸组成中排名前三位的都是脂肪族氨基酸,包括Arg(13.3%)、Asp(12.8%)、Ala(10.1%),有研究表明SepF可能与膜蛋白相互作用,或者SepF是一种外周膜蛋白,并且对脂质双层本身具有亲和力[4],这也表明调控SepF可能会影响Mtb膜结构的分配,从而影响Mtb自身存活或是宿主免疫机制。SepF蛋白为定位于细胞质的亲水性蛋白质,含有磷酸化位点表明其与信号传导相关。本研究预测SepF蛋白含有29.05%的Hh,说明该蛋白相对保守。SepF蛋白Cc占58.92%,说明其具有重要功能。SepF蛋白的重要功能可能为抗结核疫苗的研发提供重要的理论支持。
预测SepF的可能相互作用蛋白为包括ftsQ、ftsZ、ftsW、Rv2148c、yfiH等可与SepF蛋白相互作用富集于细胞分裂生物学过程。细胞分裂是一个复杂的多步骤过程,需要以空间和时间控制的方式有序组装各种蛋白质。尽管在大肠杆菌中对协调细胞分裂的分子事件进行了最好的研究,但对Mtb的细胞复制过程知之甚少,Mtb是一种生长缓慢的细胞,倍增时间为24h。与大肠杆菌相比,Mtb的细胞分裂机制可能不同。有研究表明SepF在包皮分枝杆菌和枯草芽孢杆菌中参与其细胞分裂过程。保守的细胞分裂蛋白SepF在细胞中Z环的合成过程中与FtsZ形成聚合物,FtsZ是细菌中的关键细胞分裂蛋白,这是细胞分裂的第一阶段。此外,SepF还充当Z环的膜锚。SepF过表达会阻断包皮分枝杆菌中的细胞分裂,为什么会这样尚不清楚。在枯草芽孢杆菌中发现SepF过量生产不会干扰Z环组装,而是阻止负责隔膜合成的晚期分裂蛋白的组装[5]。这表明,除了将FtsZ细丝锚定在膜上外,SepF在细胞分裂中也具有调节作用。在革兰氏阳性菌中,FtsZ聚合物通过外周膜蛋白SepF附着在细胞膜上。一旦Z环组装完成,所谓的晚期细胞分裂蛋白就会被招募,负责分裂隔膜的合成,例如肽聚糖糖基转移酶FtsW。晚期蛋白质的组装需要枯草芽孢杆菌中存在保守的跨膜蛋白FtsL、DivIC和DivIB,以及大肠杆菌中的同源蛋白FtsL、FtsB和FtsQ[6]。这些蛋白质没有明确的催化结构域,它们可能起着结构作用,并以某种方式调节晚期细胞分裂蛋白向Z环的募集。SepF在包皮分枝杆菌和枯草芽孢杆菌中的研究表明SepF在细菌细胞分裂过程中起着重要作用,了解这一仅限于病原体且宿主中不存在的过程,可能会为开发潜在的新抗菌药物选择合理的靶点,为破坏蛋白质—蛋白质相互作用的新药物的研发提供理论支持。
淋巴细胞表面受体能够与Mtb的抗原表位结合从而发挥免疫作用,从而为疫苗开发的理论依据。通过生物信息学分析发现SepF蛋白含有大量抗原表位,为新型抗结核药物提供了理论依据。

