专利中药复方治疗肝纤维化的用药规律及机制研究
韦柳婷, 高松林, 吴凡, 王燕凤, 何广英, 胡振斌
(1.广西中医药大学第一临床医学院, 南宁 530000; 2.广西中医药大学第一附属医院, 南宁 530000)
肝纤维化(hepatic fibrosis, HF)是病毒感染、遗传、脂肪过度沉积和药物性损伤等各种因素导致的慢性肝损伤以及细胞外基质(extracellular matrix, ECM)过度沉积引起的病理变化,可进一步发展至肝硬化、肝衰竭、肝癌等严重肝病[1]。近年来,中国慢性肝病患者逐年增加,给医疗卫生带来了沉重的经济负担,其中肝纤维化的发病率约占全部肝病的15%~20%[2]。目前,临床上治疗肝纤维化尚无特异性药物,主要针对病因治疗,如改变生活方式、戒酒和使用抗病毒药物等,但是对于晚期肝纤维化患者疗效欠佳,而且无法从根本上逆转肝纤维化[3]。肝移植作为终末期肝纤维化的最终和唯一的治疗选择,受到供体短缺的限制,因此对于抗肝纤维化药物的研发迫在眉睫。
在中医古籍中无肝纤维化的病名记载,根据胁部肿块、胁肋疼痛等临床表现,可将其纳入“积聚”、“胁痛”和“肝着”等范畴。中医药在防治肝纤维化方面具有明确的疗效,如扶肝化纤汤、安络化纤丸[4-5]。中药专利复方是具有治疗依据的有效验方,也是新药的重要来源,揭示专利复方治疗肝纤维化的用药规律和相关机制意义重大。数据挖掘联合网络药理学方法能够系统地阐述中药复方的用药及配伍规律和作用机制,是目前研究的热点[6-7]。现通过对治疗肝纤维化的中药专利复方进行数据挖掘,探索其中的用药规律,运用网络药理学方法探讨核心高频药对治疗肝纤维化的机制,以期为肝纤维化的新药研发和临床用药提供借鉴。
1 材料与方法
1.1 数据来源
在国家知识产权局中国专利公布公告网(http://epub.cnipa.gov.cn/)的高级查询中的名称栏目以“肝纤维化”为检索词搜索相关的发明公布和发明授权,检索建库至2023年3月10日所有治疗肝纤维化的中药专利复方。
1.2 纳入和排除标准
1.2.1 纳入标准
专利名称中明确指出具有治疗肝纤维化作用的中药专利复方。
1.2.2 排除标准
①仅含有单味中药的处方;②组方重复或不明确且不能在中国知网专利数据库补全的处方;③外用、保健品、饮品或食品类专利处方;④包含中药单体、西药的复方。
1.3 数据规范及数据表建立
将符合纳入标准的专利复方根据《中药学》[8]规范中药名称,《中药学》中未收录的则参照药智网(https://db.yaozh.com/)或保留原名。如春砂仁、荆三棱、内蒙古紫草不考虑产地的影响分别录用为砂仁、三棱、紫草,醋柴胡、醋鳖甲和炒白术均不考虑炮制的影响分别录入为柴胡、鳖甲和白术,地鳖虫、兰草、苏条参不考虑别名的影响分别录入为土鳖虫、佩兰和党参。
1.4 数据导入与核对
将整理后的中药录入Excel表并导入中医传承计算平台3.0(TCMICS V3.0)的“数据管理”模块,由专人进行核查,防止出现遗漏、录错、重复等情况。
1.5 统计分析
通过TCMICS V3.0“方剂分析”版块对中药进行频次统计、关联规则及聚类分析,运用Excel表格对高频药物的性味归经和功效进行统计分析。
1.6 网络药理学分析
在TCMSP数据库(https://tcmspw.com/tcmsp.php)中以口服利用度≥30%且类药性≥0.18为条件筛选出核心高频药对的有效成分及靶点,并以“hepatic fibrosis”为关键词在GeneCards(https://www.genecards.org/)、OMIM(https://omim.org/)和TTD(https://db.idrblab.net/ttd/)数据库筛选出肝纤维化的靶点相映射并取交集,作为核心高频药对治疗肝纤维化的潜在靶点。通过Cytoscape3.9.1软件构建“中药-活性成分-靶点”网络并进行拓扑分析。将交集靶点导入STRING(https://string-db.org/)数据库中,构建蛋白质相互作用(proteinprotein interaction,PPI)网络并筛选出关键靶点,应用R语言进行基因本体(gene ontology, GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG)通路富集分析。通过Pub Chem(https://pubchem.ncbi.nlm.nih.gov/)、PDB(https://www.pdbus.org/)数据库下载核心活性化学成分、关键靶点的结构,结合Chem3D软件、PyMol软件、AutoDockTools1.5.6软件进行预处理,运用AutoDockVina1.1.2软件进行分子对接。
2 结果
经过初步检索和去重后,共得到357个专利复方,再经过纳入和排除筛选,最终获得147个治疗肝纤维化的专利复方。
2.1 中药频次统计
147个专利复方涉及431种中药,共1 386频次。使用次数不低于8次(5.44%~42.18%)的中药有42味,共计750频次,约占总频次的54.11%,可见其为高频药物,如表1所示。
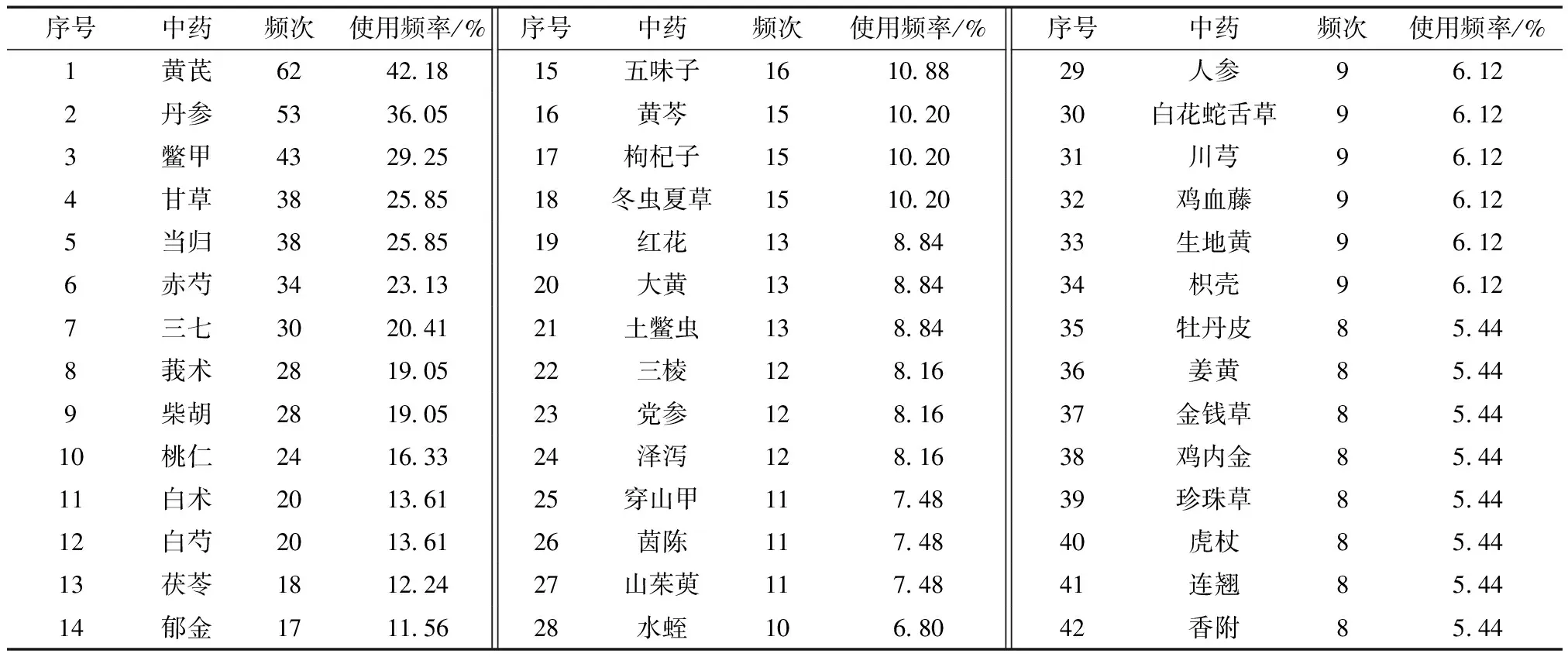
表1 使用频率≥5%的中药Table 1 Traditional Chinese medicines with frequency≥5%
2.2 高频药物功效统计
根据《中药学》[8]对高频药物进行功效分类统计,结果可分为10类,用药次数最多的是补虚药,其中黄芪、甘草、白术、党参和人参为补气药,补血药有白芍和当归,补阴药有鳖甲和枸杞子,冬虫夏草为补阳药;其次为丹参、莪术、桃仁等活血化瘀类药物,如表2所示。

表2 高频中药功效分类统计Table 2 Efficacy classification statistics of high-frequency drugs
2.3 高频药物四气、五味、归经统计(使用频率大于5%的药物)
专利复方中高频中药的药性以微寒、温、平性药为主,无热性药;药味以苦、甘和辛味为主;主归肝、脾两经,心经、肺经次之(图1)。

数值为中药频次
2.4 高频药物关联规则
运用TCMICS V3.0的“方剂分析”板块对药物进行关联规则分析,设置支持度≥17和置信度≥0.9得到高频药物组合,其中“黄芪-丹参”“黄芪-当归”和“黄芪-鳖甲”出现频率均超过15%(表3),核心组方为黄芪、丹参、当归、鳖甲、赤芍、桃仁、莪术、柴胡和甘草,网络如图2所示。将置信度调整为≥0.7,得到“丹参,当归→黄芪”的置信度为0.85,“丹参→黄芪”的置信度为0.72,说明其药物关联情况紧密(表4)。

图2 核心药物复杂网络图

表3 高频药物组合Table 3 Combinations of high-frequency drugs

表4 药物关联规则Table 4 Drug association rules
2.5 药物聚类分析
对147个专利复方中431味中药进行聚类分析,在TCMICS V3.0设置聚类个数为4,结果如表5所示。

表5 药物聚类分析Table 5 Drug cluster analysis
2.6 基于网络药理学分析核心高频药对黄芪-丹参治疗肝纤维化的机制
2.6.1 黄芪-丹参活性化学成分和靶点筛选
通过TCMSP数据库得到丹参65个、黄芪20个活性化学成分,去重后共得到76个活性化学成分,经UniProt数据库校正后最终获得215个靶点。
2.6.2 肝纤维化相关靶点及交集靶点的筛选
在GeneCards(Relevance score>1)、OMIM和TTD数据库中共获得5 222个肝纤维化靶点基因。通过R语言4.2.2的VennDiagram数据包得到179个“方药-疾病”交集靶点(图3)。
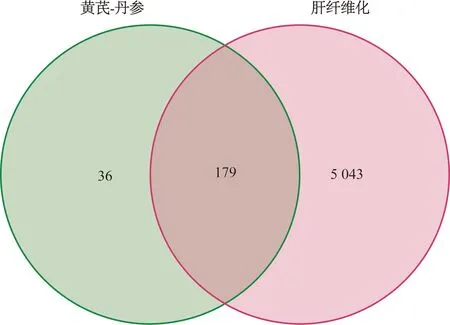
图3 药物与疾病共同作用靶点韦恩图
2.6.3 中药-活性成分-疾病靶点网络构建和关键活性成分分析
使用Cytoscape3.9.1软件对179个交集靶点进行中药-化合物-疾病靶点图的构建(图4)。利用Cytoscape3.9.1软件的“Network analyzer”功能,根据度值筛选排名前4名的活性成分,分别是槲皮素、木犀草素、山奈酚和丹参酮IIA(表6)。

天蓝色长方形节点代表潜在靶点;红色和绿色圆圈分别代表丹参和黄芪的有效成分

表6 度值前4的活性成分Table 6 Active ingredients in the top 4 of the degree
2.6.4 PPI网络的构建及核心靶点的筛选
在STRING数据库中以“Homo sapiens”“highest confidence>0.95”“hide disconnected nodes in the network”为条件对179个交集靶点进行PPI网络构建(图5)。通过Cytoscape3.9.1软件分析中心性(degree centrality, DC)、介度中心性(betweenness centrality, BC)、特征向量中心性(eigenvector centrality, EC)、接近中心性(closeness centrality, CC)、网络中心性(network centrality,NC)和局部平均连通性(local average connectivity-based method,LAC)拓扑参数,以6个数值均大于其中位数的节点为条件并进行2次筛选,得到骨髓细胞瘤病毒癌基因(myelocytomatosis viral oncogene,MYC)、转录激活因子3(signal transducer and activator of transcription 3, STAT3)、丝氨酸/苏氨酸激酶1(serine/threonine kinase 1, AKT1)、雌激素受体1(estrogen receptor 1, ESR1)、FOS原癌基因(Fos proto-oncogene,FOS)、缺氧诱导因子1亚基α(hypoxia-inducible factor 1 alpha, HIF-1α)、肿瘤蛋白p53(tumor protein p53, TP53)、丝裂原活化蛋白激酶14(mitogen-activated protein kinase14, MAPK14)等核心靶点(图6)。

图5 PPI网络模型

图6 PPI网络拓扑分析核心靶点
2.6.5 GO功能富集分析
GO富集分析得到2 568个生物过程、99个细胞组成和219个分子功能,分别取前10个进行条形图展示(图7)。在生物过程中靶点富集在对外源性刺激、化学应激和氧化应激的反应等方面;细胞组成主要涉及膜筏、膜微区和质膜穴样内陷等;在分子功能中核受体活性和配体激活的转录因子活性富集程度最高。

q是P校正后的结果
2.6.6 KEGG富集分析
KEGG富集分析得到175条通路(P<0.05)如图8所示,主要涉及磷脂酰肌醇3-激酶(phosphati-dylinositol-3-kinase, PI3K)-蛋白激酶B(protein kinase B,Akt)、糖尿病并发症中晚期糖基化终产物及其受体(advanced glycation end products-receptor for advanced glycation end products, AGE-RAGE)、肿瘤坏死因子(tumor necrosis factor, TNF)、白细胞介素(interleukin, IL)-17、低氧诱导因子-1(hypoxia-inducible factor-1, HIF-1)、辅助性T细胞17(helper T cells 17, Th17)细胞分化信号通路等。
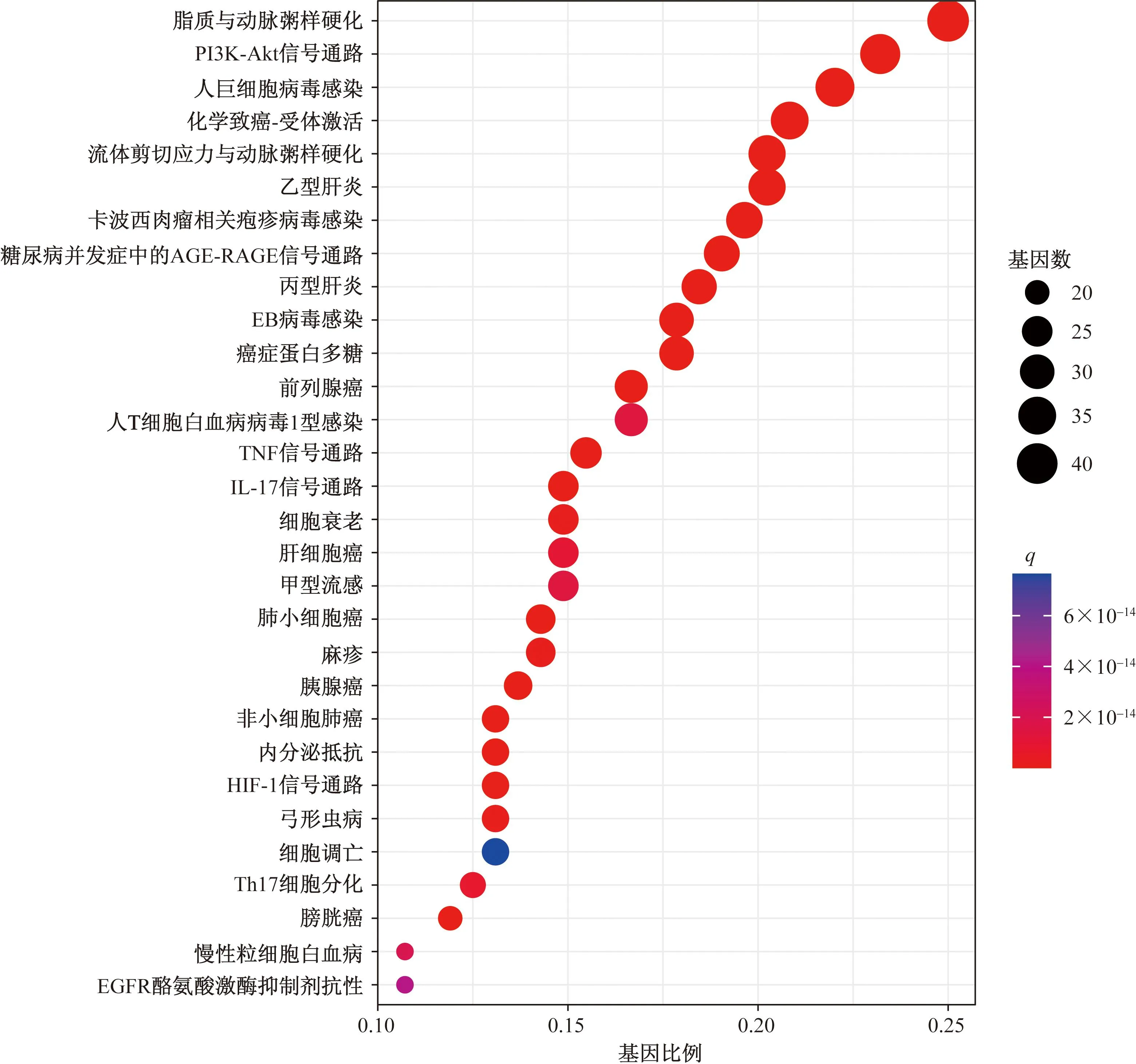
q为P校正后的结果
2.6.7 核心活性化学成分与关键靶点的分子对接
将2.6.3节度值排名前4的活性化学成分(槲皮素、木犀草素、山奈酚、丹参酮IIA)与2.6.4节度值排名较前的核心靶点(MYC、STAT3、AKT1、ESR1、FOS、HIF1A、TP53、MAPK14)进行分子对接,结果显示对接的最低结合能均≤-20.93 kJ/mol,具有较好的结合活性(表7)。其中丹参酮IIA-ESR1、丹参酮IIA-FOS和木犀草素-STAT3的最低结合能均≤-37.68 kJ/mol,PyMol软件展示如图9所示。

图9 部分活性成分和关键靶点分子对接图

表7 分子对接结果Table 7 Molecular docking results
3 讨论
3.1 用药频次分析
用药频次结果显示黄芪、丹参、鳖甲和当归等使用频次较高。黄芪,味甘入脾,擅长补气升清,能通行表里、脏腑、三焦诸气,气行则血行,在治疗肝纤维化的专利复方中使用频率高达42.18%,与肝纤维化气虚血瘀的病机密切相关[9]。黄芪有效成分黄芪甲苷可通过调节N-钙黏蛋白、E-钙黏蛋白、转化生长因子-β1(transforming growth factor-β1, TGF-β1)等蛋白的表达,减少ECM沉积而起到抗肝纤维化的作用[10]。黄芪总皂苷对肝纤维化有显著的干预作用,可能是通过下调赖氨酰氧化酶样蛋白1的表达,抑制胆管反应来实现的[11]。丹参作用平和,具有活血止痛、祛瘀生新等功效。丹参多酚酸盐能够抑制TGF-β1/母体抗生物皮肤生长因子同源物(small mothers against decapentaplegic, Smad)、PI3K/AKT/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)和神经源性基因位点切口同源物蛋白1(neurogenic locus notch homolog protein 1, Notch1)/发状分裂相关增强子1(hairy and enhancer of split1, Hes1)信号通路,减少ECM的合成和纤维组织生成及过量沉积,减轻肝纤维化[12-13]。丹参素能够通过抗氧化应激和炎症反应来发挥抗肝纤维化效果,可能与核因子E2相关因子2(nuclear factor erythroid 2-related factor 2, Nrf2)/血红素加氧酶-1(heme oxygenase-1, HO-1)核因子-κB(nuclear factor-κB, NF-κB)/抑制子κBα(inhibitor of NF-κB, IκBα)信号通路有关[14]。鳖甲咸寒质重,入肝肾经,擅于软坚散结,常用于治疗癥瘕积聚,胁下痞硬成块等疾病。以鳖甲为主要成分的中药制剂在治疗肝纤维化方面具有较好的效果,如复方鳖甲软肝片、鳖甲煎丸和鳖甲育肝颗粒等[15-17]。鳖甲提取物可以抑制肝星状细胞(hepatic stellate cells, HSC)的活化增殖和ECM合成来防治肝纤维化[18]。当归质地甘温而润,善于补血活血化瘀,被誉为活血行瘀之要药。欧当归内酯A可能通过抑制脂质过氧化、修复内皮细胞损伤和降低一氧化氮的释放水平来改善肝纤维化[19]。
3.2 高频药物功效、性味归经分析
按功效分析,抗肝纤维化的高频中药可分为10类,其中以补虚类、活血化瘀类和清热类为主,由此可反向推测出肝纤维化的病机以虚为主,与瘀、热等因素密切相关。高频药物中使用频次最高的为补虚药(272次),且补虚药中又以补气和补血药为主,如黄芪、甘草、白术、白芍和当归等,表明了治疗肝纤维化的核心在于补益,尤重补益气血。在药物性味归经方面,高频中药药性以微寒、温和平性为主,药味以苦、甘和辛味为主,主归肝脾两经,心经、肺经次之,由此可知肝纤维化病机与五脏相关,肝脾尤甚,治疗时应注重寒温并用、辛开苦降、肝脾同调。
3.3 组合频次及关联规则分析
药物关联规则显示复方中药常用的药对有黄芪-丹参、黄芪-当归、黄芪-鳖甲等,高频角药有黄芪-丹参-当归。这些药对与角药多为补气药与补血、活血化瘀药相结合,均为临床上常用于治疗肝纤维化的药对。“黄芪-丹参”药对具有益气健脾、活血祛瘀止痛功效,研究表明,两种药物均可通过促进胶原降解、清除氧自由基来发挥抗纤维化作用,且合用效果优于单药作用[20]。“黄芪-当归”药对可气血双补、活血止痛,共同作用于p38丝裂原活化蛋白激酶(mitogenactivatedproteinkinases,p38MAPK)磷酸化通路,通过减少炎症反应来防治肝纤维化[21]。“黄芪-鳖甲”药对既能滋补肝阴以柔肝体、补脾益气以治其本,又能软坚散结以治标。“黄芪-丹参-当归”角药中当归为补血圣药,黄芪善于补益脾气,两药合用以补气生血,如当归补血汤、黄芪地黄丸等,丹参入肝经血分,既能活血止痛,又可祛瘀生新而不伤正,与归芪相合共奏补气养血、活血消癥、祛瘀生新之效。
3.4 药物聚类分析
聚类分析将147首方大致分为4类,第一类核心组合以鳖甲、当归、皂角刺、老鹳草、三七、黄芪为基础,此组合蕴含当归补血汤之意,当归补血活血,黄芪健脾益气,鳖甲、皂角刺、老鹳草散结通络,三七化瘀不伤正,诸药合用,共奏益气补血,化瘀散结功效;第二类组合为黄芪、丹参、当归、柴胡、甘草、黄芩,为逍遥散类方。方中柴胡疏肝解郁,当归补血活血,二药合用可补肝体而助肝用,黄芪、丹参补气活血,黄芩清热解毒,甘草调和诸药,发挥补气活血、疏肝清热功效;第三类组合含鳖甲、红花、黄芪、丹参、牛膝、三七,黄芪、牛膝益气活血、补益肝脾肾三脏,红花、丹参、三七活血散瘀,鳖甲软坚散结,全方益气活血,软坚散结,可用于气虚血瘀型肝纤维化;第四类组合为补阳还五汤化裁,有黄芪、丹参、鳖甲、甘草、赤芍、当归,方中黄芪、当归补气活血,赤芍、丹参清热活血祛瘀,鳖甲软坚散结,甘草与诸药调和,重在补益气血,活血化瘀,兼以清热散结,适用于气虚血瘀型肝纤维化兼见热症。
3.5 高频药对黄芪-丹参治疗肝纤维化的机制分析
拓扑分析得出黄芪-丹参可能是通过槲皮素、木犀草素、山奈酚和丹参酮IIA等活性成分治疗肝纤维化。槲皮素是一种具有抗炎和抗氧化功能的多酚类黄酮,其改善肝纤维化和护肝的机制可能与抑制Wnt信号通路相关[22]。木犀草素是一种常见的膳食黄酮类化合物,不仅可以通过减少细胞外基质积聚和组织蛋白酶基因表达来预防纤维化,还能够增强肝脏抗氧化系统、清除活化的HSC和抑制HSC活化,显著改善肝纤维化[23]。山奈酚具有抗炎、抗菌和抗氧化活性,可以通过调控微小核糖核酸-26b-5p(miR-26b-5p)/锯齿状1(Jagged 1, Jag1)轴和神经源性基因位点切口同源物蛋白(neurogenic locus notch homolog protein, Notch)通路抑制HSC的异常活化发挥抗肝纤维化作用[24]。丹参酮IIA能够抗炎、抗氧化、抗肿瘤和抗血管生成,Xu等[25]研究发现,通过调节TGF-β1/Smad信号通路发挥改善非酒精性脂肪性肝炎相关纤维化的疗效。
PPI网络预测的关键靶点包含MYC、STAT3、AKT1、ESR1、FOS、HIF1A、TP53、MAPK14等。转录因子MYC的激活被确定为纤维化的下游驱动因素,内皮细胞GATA结合蛋白4(GATAbindprotein, GATA4)通过在染色质水平上抑制MYC激活和促纤维化血管分泌信号传导来保护窦周肝纤维化[26]。细胞质信号转录因子STAT3在肝脏中的作用具有争议性,在调节细胞存活和增殖等方面具有积极作用,然而,当其持续激活时,促炎作用会导致肝纤维化的发生和发展,在许多肝纤维化组织中可检测到STAT3的激活[27]。AKT1可通过调节磷酸肌醇依赖性激酶-1、mTOR复合物2和PI3K等信号通路的表达,促进炎性、增殖性和纤维化基因表达上调,诱导肝纤维化的发生[28]。肝细胞和HSC中磷酸化STAT3的表达水平与重度小叶炎症、气球样变和晚期纤维化相关,而弥漫性表达的ESR1与轻度纤维化相关[29]。肝窦内皮细胞降解ECM的能力与分泌型基质金属蛋白酶的表达有关,尤其是受转录因子c-FOS调控的基质金属蛋白酶9[30]。HIF1A是HIF1的一个调节亚基,是在缺氧应激中发挥关键作用的转录因子,研究发现HIF-1α可以上调HSC中IL-6的表达加重肝纤维化[31]。p53基因(TP53)是维持细胞稳态的重要调节因子,p53对肝损伤的不同阶段影响不同,在p53激活的初始阶段具有抗炎和抗纤维化作用,在慢性肝损伤的情况下,p53的激活和衰老会促进HSC的积累,导致肝脏疾病的发展[32]。在非酒精性脂肪性肝炎模型中,抑制MAPK14的表达能改善肝损伤和肝纤维化[33]。
KEGG通路富集分析发现黄芪-丹参主要通过PI3K-Akt、AGE-RAGE、TNF、IL-17、HIF-1、Th17细胞分化等信号通路治疗肝纤维化。PI3K-Akt信号通路广泛参与多种生物过程,也是影响肝纤维化、肝癌形成的重要一环,阻断PI3K-Akt信号传导可以改善肝纤维化,甚至是减少肝癌的发生[34]。AGE-RAGE是一组由蛋白质和脂质的非酶糖化和氧化形成的不可逆反应衍生物,能够激活下游信号级联(包括NF-κB、TGF-β1和活性氧)诱导氧化应激的产生,导致HSC活化,从而促进相关肝纤维化的发生发展[35]。在病毒感染、化学药物等因素刺激下,大量TNF-α释放出来,参与肝组织炎症反应,同时导致大量ECM的合成与沉积,最终形成肝纤维化[36]。HIF-1可能通过介导肝脏炎症促进非酒精性脂肪性肝病小鼠模型肝纤维化的发展[37]。Zhou等[38]、孙磊等[39]研究发现,下调Th17、IL-17A表达,可抑制日本血吸虫感染导致的肝纤维化。
4 结论
从数据挖掘层面探讨中药专利复方治疗肝纤维化的常用药物及配伍规律,可为临床上优化处方和新药研发提供思路。通过网络药理学方法预测核心高频药对“黄芪-丹参”治疗肝纤维化的潜在机制,发现黄芪-丹参通过多成分、多靶点调控PI3K-Akt、AGE-RAGE、TNF和IL-17等通路来治疗肝纤维化,为进一步的基础研究提供了方向。

