超声波辅助提取广陈皮黄酮的工艺优化及其抗氧化活性的研究
唐婷范 徐紫薇 李霞清 田玉红 李雪松 程昊

DOI:10.3969/j.issn.1000-9973.2024.03.003
引文格式:唐婷范,徐紫薇,李霞清,等.超聲波辅助提取广陈皮黄酮的工艺优化及其抗氧化活性的研究[J].中国调味品,2024,49(3):15-19.
TANG T F, XU Z W, LI X Q, et al. Optimization of ultrasonic-assisted extraction process of flavonoids from Cantonese tangerine peel and study on their antioxidant activity[J].China Condiment,2024,49(3):15-19.
摘要:以广东新会生产的广陈皮作为原材料,利用超声波辅助提取,采用正交试验法优化广陈皮黄酮的提取工艺,并进行抗氧化活性的测定。以芦丁为参照品,采用紫外可见光分光光度法建立了测定广陈皮中黄酮含量的定量分析方法。采取正交试验法,在单因素试验的基础上,分析了乙醇浓度、超声时间、超声功率、固液比这4个因素的交互作用,得到最佳条件并且进行验证。最后采用清除DPPH自由基和清除羟自由基的方法研究广陈皮黄酮的抗氧化能力。得出结论:当乙醇浓度为60%、超声时间为45 min、超声功率为300 W、固液比为1∶50时,广陈皮黄酮提取率可达到1.86%。随着黄酮浓度的增大,DPPH自由基和羟自由基的清除率越高,证明了广陈皮黄酮的抗氧化能力较高,是一种强抗氧化剂。
关键词:广陈皮;黄酮;超声波辅助提取;正交试验法;抗氧化
中图分类号:TS201.1 文献标志码:A 文章编号:1000-9973(2024)03-0015-05
Optimization of Ultrasonic-Assisted Extraction Process of Flavonoids from
Cantonese Tangerine Peel and Study on Their Antioxidant Activity
TANG Ting-fan, XU Zi-wei, LI Xia-qing, TIAN Yu-hong, LI Xue-song, CHENG Hao*
(Guangxi Key Laboratory of Green Processing of Sugar Resources, College of Biological and Chemical
Engineering, Guangxi University of Science and Technology, Liuzhou 545006, China)
Abstract: With Cantonese tangerine peel produced in Xinhui, Guangdong as the raw material, the ultrasonic-assisted extraction process of flavonoids from Cantonese tangerine peel is optimized by orthogonal test method, and the antioxidant activity is determined.With rutin as the reference, a quantitative analysis method for the determination of flavonoid content in Cantonese tangerine peel is established by ultraviolet and visible spectrophotometry. Based on single factor test, orthogonal test method is used to analyze the interaction of ethanol concentration, ultrasonic time, ultrasonic power and solid-liquid ratio, so as to obtain the best conditions and verify them. Finally, the antioxidant capacity of flavonoids from Cantonese tangerine peel is studied by the method of scavenging DPPH free radicals and hydroxyl free radicals. It is concluded that when the ethanol concentration is 60%, the ultrasonic time is 45 min, the ultrasonic power is 300 W and the solid-liquid ratio is 1∶50, the extraction rate of flavonoids from Cantonese tangerine peel could reach 1.86%.With the increase of flavonoid concentration, the scavenging rates of DPPH and hydroxyl free radicals are higher, indicating that the flavonoids from Cantonese tangerine peel have higher antioxidant capacity and they are a strong antioxidant.
Key words: Cantonese tangerine peel; flavonoids; ultrasonic-assisted extraction; orthogonal test method; antioxidation
收稿日期:2023-09-22
基金项目:广西自然科学基金面上项目(2021GXNSFAA220067,2022GXNSFAA035490)
作者简介:唐婷范(1988—),女,高级实验师,博士,研究方向:天然产物化工。
*通信作者:程昊(1980—),男,副研究员,硕士,研究方向:应用化学。
陈皮为芸香科柑橘属及其变种栽培的干燥成熟果皮,具有浓烈的味道,微苦,具有止咳化痰、调节脾肺、理气等功效,是一味很好的中药,还是一种香料、调味品[1]。中药中的陈皮可以分为“陈皮”和“广陈皮”,广陈皮主要产于广东省,以茶枝柑主产地——新会生产的新会陈皮为主,属广陈皮中的上品[2]。成熟干燥的广陈皮中主要含有黄酮类、柠檬苦素类、挥发油、生物碱类等活性物质[3-4]。
黄酮类化合物指具有C6-C3-C6碳骨架结构的一类化合物,是一种强抗氧化剂,具有抗炎、抗氧化、抑菌、抗癌等作用[5-7],而多项研究也证明了广陈皮中所含有的如橙皮苷、橘皮素、川陈皮素等黄酮类化合物具有调节肠胃消化[8-9]、保心肝[10]、抗炎[11-12]、止咳化痰[13]等功效。陈皮中黄酮化合物的提取方法较多,近几年来,超声波辅助提取法和微波辅助提取法因表现出相较于传统的乙醇回流法和浸渍法更高的提取率及更短的提取时间而逐渐成为热点[14-17],值得进一步探索。为了充分利用柑橘资源,提升其药用价值,本试验利用超声波辅助法有效提取了广陈皮中所含有的多种黄酮类物质,并对其抗氧化活性进行了研究。
1 材料与方法
1.1 材料与仪器
广陈皮:广东省江门市新会区;芦丁(98%):上海麦克林生化科技有限公司;亚硝酸钠、水杨酸(均为分析纯):天津市大茂化学试剂厂;氢氧化钠、抗坏血酸(均为分析纯):西陇科学股份有限公司;硝酸铝(分析纯):广州化学试剂厂;硫酸亚铁、无水乙醇(均为分析纯):广东台山市粤侨化工厂;双氧水(分析纯):广东省台山市化学制药厂;1,1-二苯基-2-苦基肼自由基(DPPH·)(分析纯):WaKo公司。
AR124CN型电子分析天平 上海奥豪斯仪器有限公司;DF-101S型集热式恒温磁力加热搅拌器 巩义市京华仪器有限责任公司;BPG-9240A型精密鼓风烘箱 上海一恒科学仪器有限公司;T500型电子天平 常熟市双杰测试仪器厂;DXF-200C/D型密封性摇摆式粉碎机 广州大祥电子机械设备有限公司;SHB-ⅢS型循环水式多用真空泵 郑州长城科工贸有限公司;RE52-99型旋转蒸发器 上海亚荣生化仪器厂;Alpha 1-4 LD Plus型真空冷冻干燥机 德国Christ公司;DW-86W100J型医用低温保存箱 青岛海尔特种电器有限公司。
1.2 试验方法
1.2.1 广陈皮的粉碎
将干燥的广陈皮置于50 ℃干燥箱中继续烘干,避免温度过高导致广陈皮焦糖化,烘干后粉碎,直至粉碎完全。用袋子装好,避免其受潮。
1.2.2 芦丁标准曲线的绘制
准确称量经过120 ℃干燥处理的芦丁标准品(98%)108 mg,精准量取80.0 mL 60%乙醇,使其溶解,冷却至室温,并用60%的乙醇定容至100 mL,充分混匀得到浓度为1.08 mg/mL的标准储备液。分别准确吸取标準储备液0.00,0.40,0.80,1.20,1.60,2.00,2.40 mL于7个50 mL容量瓶中,加入20.0 mL 30%乙醇和2.0 mL 5% NaNO2溶液,充分混合摇匀,静置6 min,然后加入2.0 mL 10% Al(NO3)3溶液,再次摇匀,继续静置6 min,再加入20.0 mL 1 mol/L NaOH溶液,加水稀释至刻度,摇匀,静置10~15 min,在500 nm波长处采用紫外分光光度计测定吸光度,并将结果绘制成标准曲线[18]。
1.2.3 单因素对广陈皮黄酮提取的影响
1.2.3.1 乙醇浓度对总黄酮提取的影响
将5份1.0 g的广陈皮粉末分别混合在20.0 mL不同浓度(40%、50%、60%、70%、80%)的乙醇中,静置20 min,于50 ℃以350 W的功率超声提取30 min,抽滤。剩余滤渣重复上述步骤,合并两次滤液,得原溶液。按亚硝酸钠-硝酸铝显色方法的步骤显色,在500 nm波长处采用紫外分光光度计测定吸光度,并将所得数据整理后绘制成标准曲线。
1.2.3.2 超声时间对总黄酮提取的影响
将5份1.0 g的广陈皮粉末混合在20.0 mL 60%的乙醇中,静置20 min,于50 ℃以350 W的功率超声提取不同时间(15,30,45,60,75 min),抽滤。剩余滤渣重复上述步骤,合并两次滤液,得原溶液。按亚硝酸钠-硝酸铝显色方法的步骤显色,在500 nm波长处采用紫外分光光度计测定吸光度,并将所得数据整理后绘制成标准曲线。
1.2.3.3 超声功率对总黄酮提取的影响
将5份1.0 g的广陈皮粉末混合在20.0 mL 60%的乙醇中,静置20 min,于50 ℃以不同功率(250,300,350,400,450 W)进行超声提取,持续时间为30 min,抽滤。剩余滤渣重复上述步骤,合并两次滤液,得原溶液。按亚硝酸钠-硝酸铝显色方法的步骤显色,在500 nm波长处采用紫外分光光度计测定吸光度,并将所得数据整理后绘制成标准曲线。
1.2.3.4 固液比對总黄酮提取的影响
将5份1.0 g的广陈皮粉末分别混合在不同量(30.0,40.0,50.0,60.0,70.0 mL)的60%乙醇中,静置20 min,于50 ℃以350 W的功率超声提取30 min,抽滤。剩余滤渣重复上述步骤,合并两次滤液,得原溶液。按亚硝酸钠-硝酸铝显色方法的步骤显色,在500 nm波长处采用紫外分光光度计测定吸光度,并将所得数据整理后绘制成标准曲线。
1.2.4 正交试验法优化广陈皮黄酮提取工艺
在单因素试验的基础上,采用正交试验法验证广陈皮黄酮的最优提取工艺,在最优工艺的基础上提取更多的黄酮以用于抗氧化活性的测定。将得到的黄酮置于-80 ℃医用低温保存箱中冷冻30 min后,再放入干燥机中干燥24 h。
1.2.5 广陈皮黄酮的抗氧化活性研究
1.2.5.1 DPPH自由基清除法[19]
用蒸馏水配制浓度分别为0.5,1.0,1.5,2.0,2.5 mg/mL的总黄酮溶液,用蒸馏水配制相应浓度的VC溶液,分别取4.0 mL于离心试管中,另加入4.0 mL 0.2 mmol/L DPPH溶液,充分振荡摇匀,在室温下避光反应30 min,并测所得反应样液在517 nm处的吸光度A1;然后以4.0 mL无水乙醇代替上述步骤中的4.0 mL DPPH溶液,测定吸光度A2;最后以4.0 mL无水乙醇代替第一步中的4.0 mL样品溶液,测定吸光度A0,DPPH自由基清除率的计算公式如下:
SDPPH·(%)=1-A1-A2A0×100%。(1)
1.2.5.2 羟自由基清除法
参考吕平等[20]的羟自由基清除方法,用蒸馏水配制浓度分别为0.5,1.0,1.5,2.0,2.5 mg/mL的总黄酮溶液,用蒸馏水配制相应浓度的VC溶液,分别取2 mL于离心管中,分别加入2.0 mL 9 mmol/L硫酸亚铁溶液、2.0 mL 9 mmol/L水杨酸-乙醇溶液、2.0 mL 8.8 mmol/L过氧化氢溶液,摇匀,于37 ℃水浴锅中恒温加热30 min,在517 nm处测其吸光度A1。用蒸馏水代替样品,加同样试剂,测其吸光度,记为A0;用无水乙醇代替水杨酸-乙醇溶液,加同样试剂,测其吸光度,记为A2。羟自由基清除率的计算公式如下:
S·OH(%)=A0-(A1-A2)A0×100%。(2)
2 结果与分析
2.1 芦丁标准曲线
根据所得试验数据,以芦丁的质量浓度(mg/mL)作为横坐标,测定所得吸光度作为纵坐标,绘制芦丁的标准曲线,见图1。
建立芦丁的标准曲线,其回归方程为Y=10.900 3X+0.015 75,相关系数R2=0.999 85。由此可见,芦丁浓度在0~0.051 84 mg/mL范围内表现出良好的线性关系,可用于测定广陈皮中黄酮的含量。
2.2 单因素对广陈皮黄酮提取的影响
2.2.1 乙醇浓度对广陈皮黄酮提取的影响
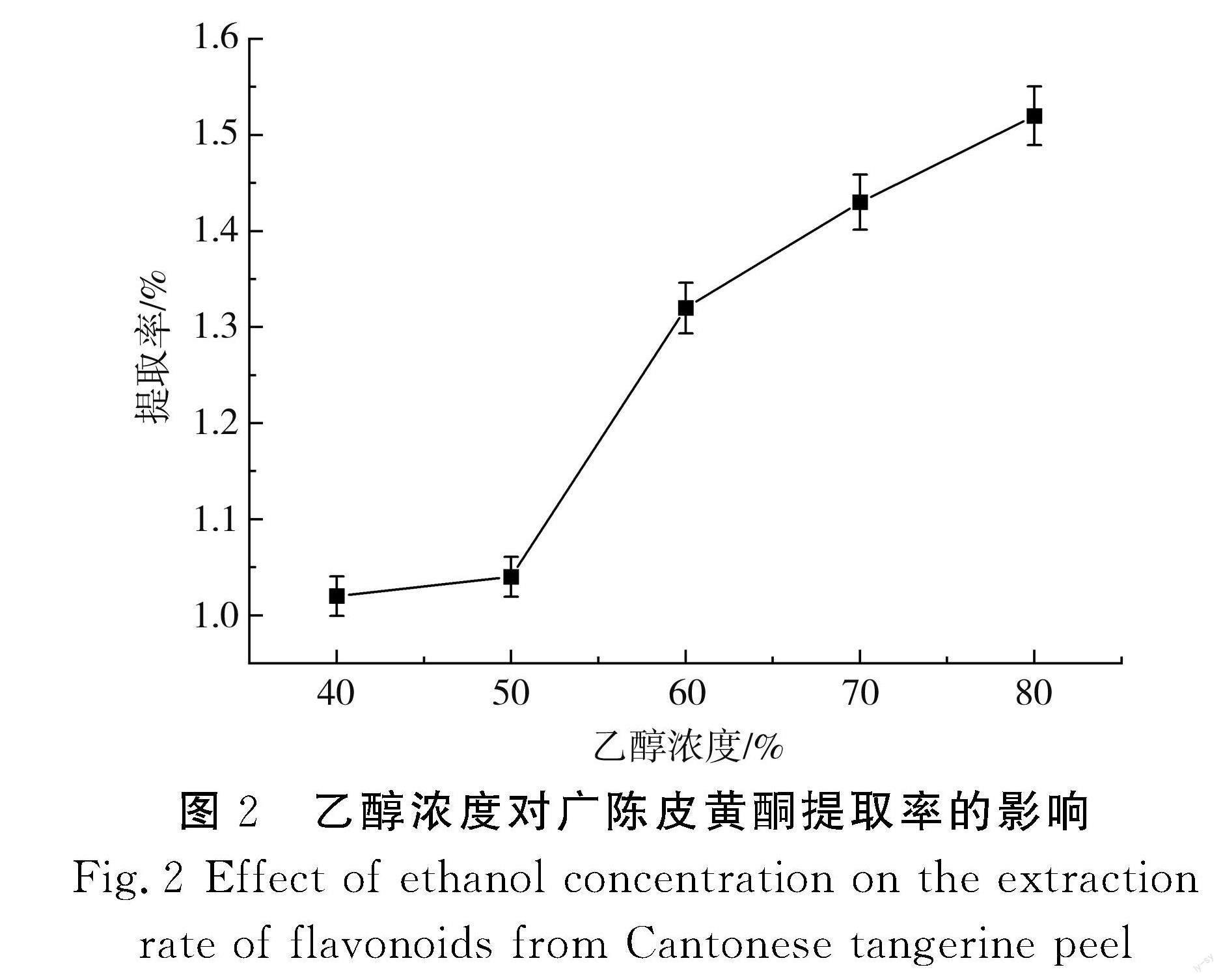
以乙醇浓度为横坐标、提取率为纵坐标,得出乙醇浓度与广陈皮黄酮提取率的关系,见图2。
由图2可知,随着乙醇浓度的不断增加,广陈皮黄酮的提取率也随之上升,乙醇浓度在50%~60%时上升的趋势最明显,乙醇浓度在40%~50%时上升趋势最缓慢,在乙醇浓度为80%时提取率最高,为1.52%。乙醇具有较好的溶剂性质,其浓度越高,越能够充分地提取广陈皮中的黄酮类化合物。
2.2.2 超声时间对广陈皮黄酮提取的影响
以超声时间为横坐标、提取率为纵坐标,得出超声时间与广陈皮黄酮提取率的关系,见图3。
由图3可知,随着超声时间的增加,广陈皮中的黄酮逐渐浸出到溶液中,其提取率呈缓慢上升的趋势,在超声时间为60 min时广陈皮黄酮提取率最高,可达到1.29%。在60 min后黄酮类化合物内部结构可能因超声时间过长及随之造成的温度升高而遭到破坏或发生降解,导致提取率急剧下降。
2.2.3 超声功率对广陈皮黄酮提取的影响
以超声功率为横坐标、提取率为纵坐标,得出超声功率与广陈皮黄酮提取率的关系,见图4。
由图4可知,广陈皮黄酮提取率随着超声功率的增大先上升后下降,较高的超声功率可促进黄酮物质的进一步释放,在超声功率为300 W时,广陈皮黄酮的提取率可达到1.36%。而当超声功率超过300 W时,提取率呈现出大幅度下降的趋势,分析原因可能是过高的超声功率对广陈皮黄酮类化合物的内部结构造成了一定的破坏,影响了其内部的稳定性,导致黄酮提取率下降。
2.2.4 固液比对广陈皮黄酮提取的影响
以固液比为横坐标、提取率为纵坐标,得出固液比与广陈皮黄酮提取率的关系,见图5。
由图5可知,随着固液比的增加,广陈皮黄酮的提取率呈现出先稳步上升后相对稳定再急剧下降的趋势,当固液比为1∶40时,提取率最高,为1.39%。当固液比为1∶50~1∶60时提取率下降的速度很快,分析原因可能是乙醇溶液过多,而广陈皮的称取量相对较少,固液比增加,广陈皮黄酮提取率因溶液中浓度差的限制而下降。
2.3 正交试验法优化提取广陈皮黄酮
根据单因素试验结果,选出最优条件以及其相邻的优条件进行正交试验,从而进一步优化工艺。采用L9(34)正交试验,选择单因素试验中所确定的超声时间(A)、乙醇浓度(B)、超声功率(C)和固液比(D)4个因素,每个因素根据单因素试验得到的结果选择3个水平,见表1。
根据表1中的因素水平,对单因素间的交互影响进行考察,精准称量广陈皮1.0 g,分别进行正交优化试验,得到总黄酮的提取率,结果见表2。
由表2可知,影响提取率的因素主次顺序为乙醇浓度>超声功率>超声时间>固液比,乙醇浓度对广陈皮黄酮提取率的影响最大,其次是超声功率,再次是超声时间,固液比的影响最小。正交试验法得出的最优方案为A2B1C2D3,即超声时间为45 min,乙醇浓度为60%,超声功率为300 W,固液比为1∶50。最后以正交试验所得最优方案进行3组平行试验,提取广陈皮中的黄酮物质,平均得率为1.86%。
2.4 广陈皮黄酮的抗氧化活性研究
2.4.1 广陈皮黄酮对DPPH自由基的清除率
通过试验,采用紫外可见光分光光度法对广陈皮黄酮清除DPPH自由基的能力进行测定,以浓度为横坐标(样品和抗坏血酸二者浓度相同)、DPPH自由基清除率为纵坐标,得到浓度与DPPH自由基清除率的相关关系,见图6。
由图6可知,随着抗坏血酸和广陈皮黄酮样品溶液浓度的增加,DPPH自由基清除率也随之上升。且广陈皮黄酮样品溶液的清除率均在80%以上,表现出良好的抗氧化能力。样品与抗坏血酸的曲线存在交点,其交点浓度为1.84 mg/mL,提取率为82.64%。在浓度为0.5~1.84 mg/mL时,样品表现出比抗坏血酸强的抗氧化能力。而在整体试验浓度范围内,样品溶液对DPPH自由基的清除率最高为82.93%。
2.4.2 广陈皮黄酮对羟自由基的清除率
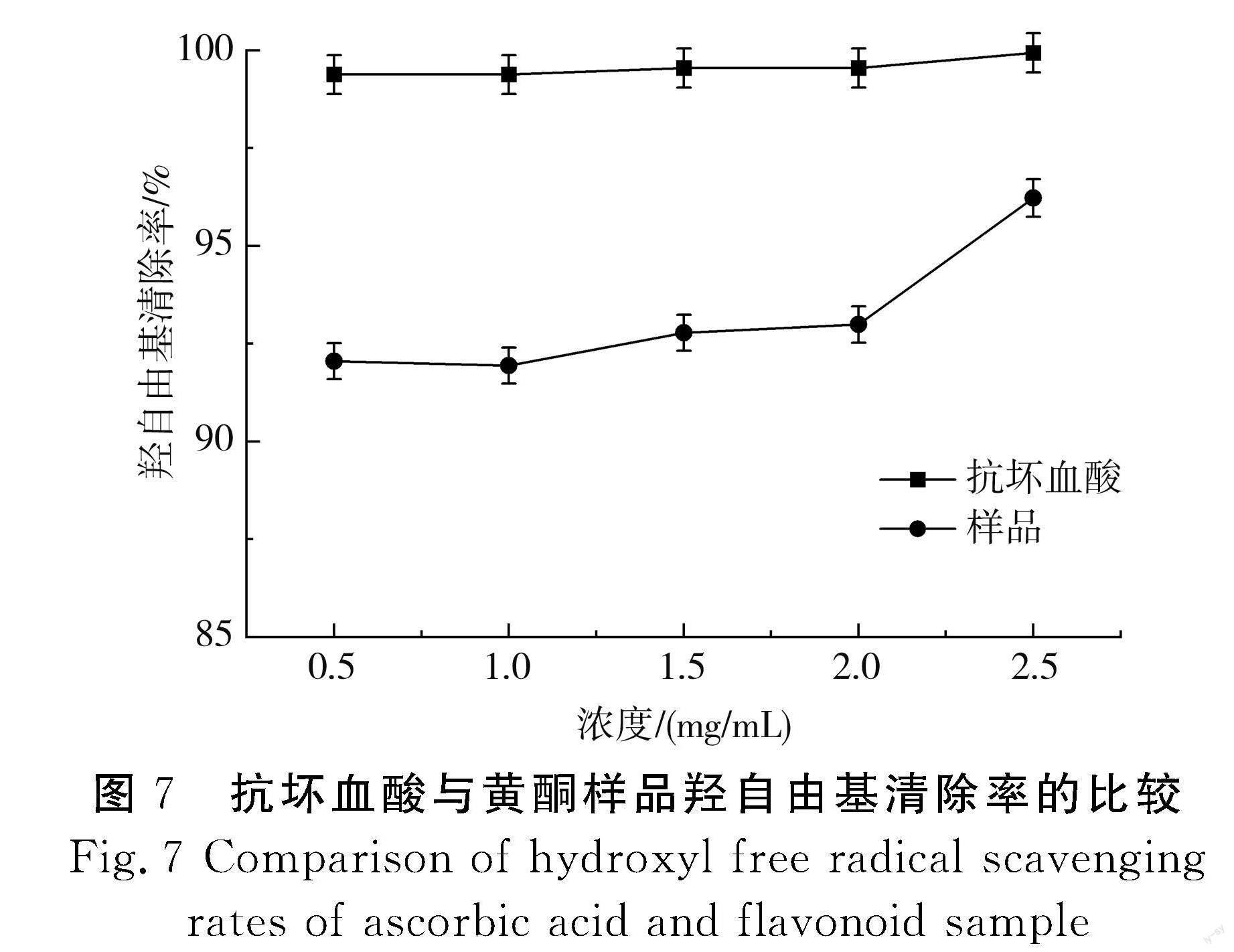
通过试验,采用紫外可见光分光光度法对广陈皮黄酮清除羟自由基的能力进行测定,以浓度为横坐标(样品和抗坏血酸二者浓度相同)、羟自由基清除率为纵坐标,得到浓度与羟自由基清除率的相关关系,见图7。
由图7可知,随着抗坏血酸和广陈皮黄酮样品溶液浓度的增加,羟自由基清除率也逐渐上升。同时可看出广陈皮黄酮样品溶液对羟自由基的清除率均可以达到91%以上,具有较高的抗氧化能力。
3 结论
本试验运用亚硝酸钠-硝酸铝显色法,以芦丁为参照品,绘制芦丁标准曲线,从而对广陈皮中黄酮含量进行了定量分析测定。通过改变单因素(超声时间、乙醇浓度、超声功率、固液比)得到最优条件,并采用正交试验法选择最优方案。最后用抗坏血酸标准品作为对照组,以清除DPPH自由基和羟自由基能力来测定广陈皮黄酮的抗氧化能力。得出结论:采用紫外可见光分光光度法测定广陈皮黄酮含量是可行的,并且在最优方案下黄酮提取率平均值为1.86%。广陈皮中黄酮对DPPH自由基的清除率可达到80%以上,对羟自由基的清除率高达91%以上,均证明广陈皮黄酮具有良好的抗氧化能力。
广陈皮所含活性物质丰富,有良好的药理作用,具有广阔的应用前景,加强对其活性物质的进一步探究,对柑橘产业经济效益的提高以及柑橘副产物资源的充分利用具有深远意义。
参考文献:
[1]傅曼琴,肖更生,吴继军,等.广陈皮促消化功能物质基础的研究[J].中国食品学报,2018,18(1):56-64.
[2]梅全喜,曾聪彦,田素英,等.陈皮、广陈皮、新会陈皮炮制历史沿革及现代研究进展[J].中药材,2019(12):2993-2997.
[3]付彬,沈婉莹,周梦舟,等.柑橘皮发酵汁抗氧化活性和挥发性风味物质分析[J].中国调味品,2019,44(8):71-75.
[4]YU X, SUN S, GUO Y Y, et al. Citri Reticulatae Pericarpium (Chenpi): botany, ethnopharmacology, phytochemistry, and pharmacology of a frequently used traditional Chinese medicine[J].Journal of Ethnopharmacology,2018,220:265-282.
[5]YUAN Q, HE Y, XIANG P Y, et al. Effects of simulated saliva-gastrointestinal digestion on the physicochemical properties and bioactivities of okra polysaccharides[J].Carbohydrate Polymers,2020,238:116183.
[6]WANG Y, LIU X J, CHEN J B, et al.Citrus flavonoids and their antioxidant evaluation[J].Critical Reviews in Food Science and Nutrition,2021,62(2):15783.
[7]唐婷范,朱家庆,周萌琳,等.葛藤茎挥发油成分分析及葛根总黄酮提取工艺研究[J].中国调味品,2022,47(6):182-187.
[8]梁天一,楊娟,董浩,等.基于GC-IMS技术鉴别不同年份新会陈皮中的挥发性风味物质[J].中国调味品,2020,45(4):168-173.
[9]李皓翔,梅全喜,赵志敏,等.陈皮广陈皮及新会陈皮的化学成分药理作用和综合利用研究概况[J].时珍国医国药,2019,30(6):1460-1463.
[10]俞静静,苏洁,吕圭源.陈皮抗心脑血管疾病相关药理研究进展[J].中草药,2016,47(17):3127-3132.
[11]WEN X, ZHAO H, WANG L W, et al. Nobiletin attenuates DSS-induced intestinal barrier damage through the HNF4α-claudin-7 signaling pathway[J].Journal of Agricultural and Food Chemistry,2020,68(16):4641-4649.
[12]LIU Z B, GUO S G, DONG Q R, et al. Nobiletin suppresses IL-21/IL-21 receptor-mediated inflammatory response in MH7A fibroblast-like synoviocytes (FLS): an implication in rheumatoid arthritis[J].European Journal of Pharmacology,2020,875:172939.
[13]李俊健,林锦铭,高杰贤,等.陈皮挥发油提取、成分分析及应用的研究进展[J].中国调味品,2021,46(8):169-173.
[14]陈克莉,陈道鸽,张玉宾,等.橙皮苷提取方法的研究进展[J].食品工业,2016,37(12):204-207.
[15]罗琥捷,杨宜婷,黄寿根,等.超声提取法与索氏提取法提取陈皮黄酮类有效成分的分析比较[J].中药材,2016,39(2):371-374.
[16]逄显娟,李杰,段冷昕,等.陈皮中橙皮苷的溶剂热法提取工艺及检测方法的研究[J].食品工业科技,2016,37(18):267-270,276.
[17]WU Y, HU C M, CHEN X X, et al. The study on extraction technology of flavonoids from Tribute Citru peel[J].IOP Conference Series: Earth and Environmental Science,2020,565(1):12056.
[18]唐婷范,邓起东,李晓慧,等.毛冬青叶中总黄酮提取工艺及其抗氧化性能研究[J].食品研究与开发,2018,39(21):77-82.
[19]AMAROWICZ R, PEGG R B, RAHIMI-MOGHADDAM P, et al. Free-radical scavenging capacity and antioxidant activity of selected plant species from the Canadian prairies[J].Food Chemistry,2004,84(4):551-562.
[20]呂平,潘思轶.陈皮与普洱茶总黄酮的协同抗氧化作用研究[J].食品研究与开发,2020,41(3):59-64.

