响应面法优化芡实粉复合酶酶解工艺及多糖抗氧化性研究
陈坤林 李祥 何思思 康芳芳 胡宇轩 史静怡 沈勇根

DOI:10.3969/j.issn.1000-9973.2024.03.004
引文格式:陈坤林,李祥,何思思,等.响应面法优化芡实粉复合酶酶解工艺及多糖抗氧化性研究[J].中国调味品,2024,49(3):20-27.
CHEN K L, LI X, HE S S, et al.Optimization of compound enzymatic hydrolysis process of Euryale ferox powder by response surface methodology and study on antioxidant activity of polysaccharides[J].China Condiment,2024,49(3):20-27.
摘要:为确定复合酶法酶解芡实粉的最佳工艺及芡实多糖的抗氧化活性,以优质产地的芡实粉为原料,通过单因素试验、Box-Behnken试验设计及响应面分析研究复合酶添加量、pH、酶解温度、酶解时间对水解程度(dextrose equivalent,DE值)的影響;并通过测定酶解后芡实多糖对DPPH自由基的清除能力评价其抗氧化活性。结果表明,复合酶法酶解芡实粉的最佳工艺参数为复合酶(普鲁兰酶∶α-淀粉酶)的质量比5∶6、酶添加量0.3%(以原料质量为基准)、pH 6.5、酶解温度56 ℃、酶解时间45 min。该条件下生产的芡实粉基料水解度可达20.25%,且酶解后芡实多糖具有一定的抗氧化活性。该研究结果为芡实相关产品的开发利用提供了理论依据及方法基础。
关键词:芡实粉;复合酶酶解;响应面法;酶解工艺;抗氧化性;DE值
中图分类号:TS210.1 文献标志码:A 文章编号:1000-9973(2024)03-0020-08
Optimization of Compound Enzymatic Hydrolysis Process of Euryale ferox
Powder by Response Surface Methodology and Study on Antioxidant
Activity of Polysaccharides
CHEN Kun-lin1,2, LI Xiang1, HE Si-si1, KANG Fang-fang1,
HU Yu-xuan1, SHI Jing-yi1, SHEN Yong-gen1*
(1.School of Food Science and Engineering, Jiangxi Agricultural University, Nanchang 330045, China;
2.Seed Service Center, Agriculture and Rural Bureau of Nanjing County, Zhangzhou City,
Zhangzhou 363600, China)
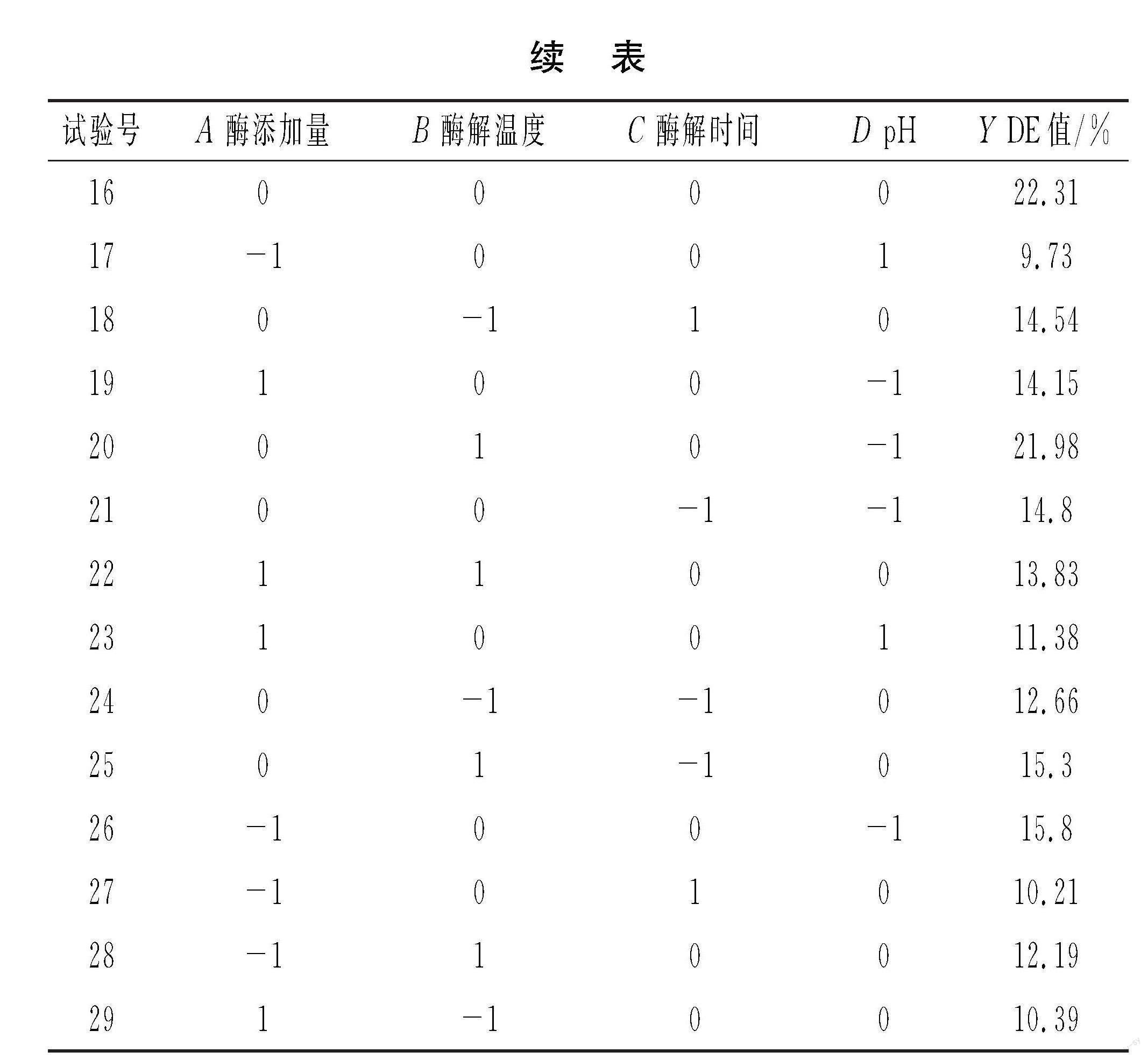
Abstract: To determine the optimal compound enzymatic hydrolysis process of Euryale ferox powder and the antioxidant activity of Euryale ferox polysaccharides, with Euryale ferox powder from high-quality places of origin as the raw material, the effects of the addition amount of compound enzymes, pH, enzymatic hydrolysis temperature and enzymatic hydrolysis time on the hydrolysis degree (dextrose equivalent, DE value) are studied through single factor test, Box-Behnken test design and response surface analysis. After enzymatic hydrolysis, the antioxidant activity of Euryale ferox polysaccharides is evaluated by measuring their DPPH free radical scavenging capacity. The results show that the optimal process parameters for enzymatic hydrolysis of Euryale ferox powder using compound enzymes method are as follows: the mass ratio of compound enzymes (pullulanase∶α-amylase) is 5∶6, the addition amount of enzymes is 0.3% (based on the mass of raw materials), pH is 6.5, enzymatic hydrolysis
收稿日期:2023-09-04
基金项目:江西省研究生创新专项资金项目(YC2021-S369);芡实相关地方标准的起草(2021JXAUHX08);江西主栽食用菌贮藏保鲜及加工技术研究(JXXTCX2018-03-04)
作者简介:陈坤林(1999—),男,硕士,研究方向:果蔬贮藏与加工。
*通信作者:沈勇根(1971—),男,教授,硕士,研究方向:果蔬贮藏与加工。
temperature is 56 ℃ and enzymatic hydrolysis time is 45 min. Under these conditions, the hydrolysis degree of Euryale ferox powder basic material can reach 20.25%, and after enzymatic hydrolysis, Euryale ferox polysaccharides have certain antioxidant activity. The research results have provided theoretical and methodological basis for the development and utilization of products related to Euryale ferox.
Key words: Euryale ferox powder; compound enzymatic hydrolysis; response surface methodology; enzymatic hydrolysis process; antioxidant activity; DE value
芡实(Euryale ferox)俗称鸡头米、鸡头子,为睡莲科(Nymphaeaceae)芡属(Euryale Salisb.ex DC.)水生草本植物,在植物学上被称为欧洲黑麦草、狐狸坚果[1-3]。芡实含大量淀粉、多糖、脂肪油及钙、磷、铁、核黄素、维生素C等,氨基酸种类齐全[4-5]。芡实粉具有降低体内自由基数量和细胞分裂时染色体损伤的作用,能够防止氧化损伤,从而延长细胞寿命,具有抗衰老、抗氧化、抗疲劳等功效[6-8]。芡实粉还具有改善食品品质的作用,如在面包中加入芡实粉可以减少面包中快消化淀粉(RDS)含量,提升慢消化淀粉(SDS)和抗性淀粉(RS)含量,有利于维持血糖的稳定,适合糖尿病患者、肥胖症患者和中老年人等特殊人群食用[9]。
在21世纪初期,我国芡实种植面积约为10 000 hm2,平均每公顷干芡米产量为330~350 kg。近年来,随着芡实品种的引进和不断改良,我国芡实的栽培面积和产量逐步上升[10]。目前国内芡实粉加工技术基本采用普通粉碎技术结合其他生产工艺生产干制品和初加工产品,而深加工产品较少,产品的附加值较低,严重限制了芡实的大规模生产加工[11]。并且由于芡实中特殊的淀粉结构,初加工后的芡实粉冲调性能不佳,出现分层、结块现象,食用后不易消化[12];高温高压的加工过程会破环芡实粉自身的营养成分,极大地限制了芡实产品的发展。因此,通过适宜的处理方式改善芡实粉的品质和性能尤为重要。同时,目前国内对于芡实多糖的研究大多集中在提取方法及其抗氧化性,但对于加工处理后芡实的抗氧化性鲜有报道。
本研究选择江西余干优质芡实粉为原料,使用α-淀粉酶和普鲁蘭酶双酶法对芡实粉进行水解,在单因素试验的基础上,通过Box-Behnken试验设计及响应面法对芡实粉的酶解工艺进行优化,并测定芡实多糖的抗氧化活性。本研究旨在改善芡实粉的品质,增强芡实粉单位体积的能量,并通过试验验证,经过酶解后的芡实多糖具有抗氧化活性,从而实现对芡实的综合开发利用。
1 材料与方法
1.1 材料与仪器
芡实:由江西明湖农业发展有限公司提供;α-淀粉酶、纤维素酶、果胶酶、普鲁兰酶:南宁庞博生物工程有限公司;葡聚糖苷酶:邢台万达生物工程有限公司;1,1-二苯基-2-三硝基苯肼(DPPH):合肥千盛生物科技有限公司;甲醛、乙醇、氢氧化钠、氯化氢:均为国产分析纯。
Q500B高速粉碎机 永康市铂欧五金制品有限公司;GL-20A型冷冻高速离心机 上海市菲恰尔分析仪器有限公司;101-1BS电热鼓风干燥机 上海一恒科学仪器有限公司;JYC-1102C立式单开门恒温摇床 上海锦玟仪器设备有限公司;HH-4数显恒温水浴锅 深圳市国华电器有限公司;BS210S电子分析天平 上海浦春计量仪器有限公司;SHP-250型智能生物培养箱 上海鸿都电子科技有限公司;WFJ-2100型可见分光光度计 上海尤尼柯仪器有限公司。
1.2 试验方法
1.2.1 芡实粉制备和酶解工艺
具体工艺流程:优质芡实(干品)→挑选→反复清洗去杂质→蒸煮(150 ℃,30 min)→匀浆处理→按料液比1∶10(g/mL)加水→添加复合酶酶解、调节pH→置于智能生化培养箱中充分酶解(调控温度、时间)→沸水浴灭酶15 min→烘箱干燥(75 ℃,6 h)→粉碎过筛(80目)→芡实粉基料。
1.2.2 水解度的测定
DE值也称为葡萄糖值,代表糖化液中还原糖(以葡萄糖计算)占干物质的百分比,工业上表示为淀粉的水解程度或糖化程度[13]。 DE值越高,则淀粉的水解程度越完全,糖浆质量也越高[14]。本试验采用DNS法测定还原糖含量,准确称取1.0 g样品稀释50倍,使样品中的还原糖浓度为0.1~1.0 mg/mL。取1 mL稀释溶液于25 mL试管中,加入1.5 mL二硝基水杨酸试剂,在540 nm波长处测得吸光度A,参照标准曲线中还原糖含量,求得DE值(X)[15],公式如下:
X=m1×V×NVS×m×1 000×100%。
式中:m1为从标准曲线查得的葡萄糖质量,mg;V为样品提取液的总体积,mL;N为样品提取液的稀释倍数;VS为测定时所取样品提取液的体积,mL;m为样品的质量,g;1 000为换算系数。
1.2.3 不同种类酶对芡实水解度的影响
基于卢美娟等[16]的试验研究以及实际生产用酶,选取α-淀粉酶、纤维素酶、果胶酶、普鲁兰酶和葡聚糖苷酶5种酶,在酶添加量0.3%、酶解温度55 ℃、酶解时间50 min、pH 6的条件下,测定其水解后的DE值,从中筛选出2种最适的酶,进行下一步复合酶质量比的确定。
1.2.4 复合酶质量比对芡实水解度的影响
在酶添加量0.3%、酶解温度55 ℃、酶解时间50 min、pH 6的条件下,测定在不同复合酶的质量比下水解后的DE值,其中芡实与水的比例为1∶10(g/mL),筛选出最优的复合酶质量比。
1.2.5 酶解芡实粉生产工艺优化单因素试验
以芡实粉的DE值为指标,固定酶解温度为55 ℃、酶解时间为50 min、pH为6,分析酶添加量(0.1%、0.2%、0.3%、0.4%、0.5%)对芡实粉水解度的影响;固定酶添加量为0.3%、酶解时间为50 min、pH为6,分析酶解温度(40,45,50,55,60 ℃)对芡实粉水解度的影响;固定酶添加量为0.3%、酶解温度为55 ℃、pH为6,分析酶解时间(30,40,50,60,70 min)对芡实粉水解度的影响;固定酶添加量为0.3%、酶解温度为55 ℃、酶解时间为50 min,分析pH(4,5,6,7,8)对芡实粉水解度的影响。
1.2.6 响应面法优化酶解芡实粉生产工艺
通过Box-Behnken试验设计确定最佳芡实粉复合酶酶解工艺参数。以单因素试验为基础,以酶添加量(A)、酶解温度(B)、酶解时间(C)、pH(D)为影响因素,以DE值为响应值,设计四因素三水平响应面试验,见表1。
1.2.7 DPPH自由基清除率的测定
当芡实与水的比例为1∶10 (g/mL)、复合酶(普鲁兰酶∶α-淀粉酶)的质量比为5∶6时,以原料质量为基准,设置酶添加量为0.3%、pH为6.5、酶解温度为56 ℃,酶解45 min后提取酶解液,并将酶解液中提取的多糖[17]配制成0.2,0.4,0.6,0.8,1.0 mg/mL的芡实多糖溶液,分别先加入0.1 mL芡实酶解液,再加入3.9 mL 0.04 mmol/L的DPPH-乙醇溶液。充分混合后在37 ℃下水浴加热并且在避光条件下存放1 h。最后测定每个样品在517 nm波长处的吸光度,平行测定3次。
DPPH自由基清除率(%)=1-AiA0×100%。
式中:Ai为测定样品管的吸光度;A0为以乙醇作为空白对照管的吸光度。
1.3 数据处理
使用Design Expert 11.0进行Box-Behnken试验设计和响应面试验数据的优化,使用SPSS 20.0进行数据分析,整理分析后通过Origin 2019进行图形的绘制。
2 結果与分析
2.1 不同种类酶对芡实水解度的影响
注:不同小写字母表示有显著性差异(P<0.05),下图同。
由图1可知,α-淀粉酶和普鲁兰酶对芡实DE值的影响程度比纤维素酶、果胶酶和葡聚糖苷酶高,芡实淀粉分子结构中,直链淀粉和支链淀粉的质量分数分别为18.37%~23.06%和37.66%~48.30%,支链淀粉与直链淀粉的比值为1.63~2.55[18]。普鲁兰酶作用于支链分子的α-1,6糖苷键,酶解后产支链淀粉的分支数显著降低,同时产生大量的短直链分子[19-20];α-淀粉酶可以从淀粉分子内部切开α-1,4糖苷键,生成糊精和还原糖[21]。普鲁兰酶与α-淀粉酶对芡实粉的酶解效果明显,酶解后的DE值比其他酶类酶解的DE值高。因此选取α-淀粉酶和普鲁兰酶进行复合配比,研究复合酶对芡实DE值的影响。
2.2 不同复合酶质量比对芡实水解度的影响
在复合酶适宜的条件下酶解植物淀粉底物,植物淀粉被复合酶通过各自的作用机制酶解[22]。由图2可知,随着普鲁兰酶比例的下降及α-淀粉酶比例的上升,复合酶对芡实的酶解效果呈现先上升后下降的趋势。其中,复合酶质量比达到5∶6时,复合酶对芡实酶解效果的影响最大,DE值达到16.62%;当超过这一比例时,DE值开始呈现下降趋势。这可能是因为当普鲁兰酶含量过多时,普鲁兰酶的各亚位点区域关键的底物结合位点分别与α-淀粉酶的相对应酶切结合点相结合,从而阻碍酶与底物分子的结合[23],抑制α-淀粉酶的活性,导致芡实短直链分子释放减少,DE值降低;当α-淀粉酶含量增多时,会抑制普鲁兰酶的活性,从而影响酶解效率,使得DE值降低。因此,当普鲁兰酶与α-淀粉酶的比例达到5∶6时,能得到较好的酶解效果。
2.3 酶解芡实粉生产工艺优化单因素试验
2.3.1 酶添加量对DE值的影响
由图3可知,随着酶添加量的增加,DE值呈现先上升后下降的趋势,当酶添加量达到0.3%时,DE值为19.04%,此后再增大酶添加量,DE值呈缓慢下降的趋势。这是因为在底物一定的条件下,增加酶的使用量可以有效提高反应速率。而当底物不断被酶分解后,底物浓度降低,酶解速率增长较慢[24]。当达到某一个平衡点时,酶的浓度达到饱和状态,反应速率达到平衡状态,此时DE值处于较高水平。李杨等[25]研究复合酶水解玉米粉工艺优化时,发现随着酶用量的增加,DE值先上升后下降,与本试验结果基本相同。因此,酶的最适添加量为0.3%。
2.3.2 酶解温度对DE值的影响
由图4可知,随着酶解温度的升高,DE值变化明显。当酶解温度为30~50 ℃时,DE值随着温度的升高而增大,在50 ℃时达到最大,为16.38%。当酶解温度超过50 ℃后,随着温度的继续升高,DE值明显下降。原因在于温度能明显影响酶的活性和酶解效率,最适温度范围决定了酶的活性形式和可逆失活形式之间的平衡,在最适温度范围内,逐渐升高温度,反应能量增加,单位时间内的有效碰撞数增加,反应速度加快[26-27]。且酶的本质是蛋白质,当温度过高或者过低时,酶活性降低或失活且酶的结构性质发生改变,反应速率降低,酶解不充分。因此,当酶解温度处于50 ℃左右时,能够有效提高复合酶的酶解效率。丁霄霄等[28]在利用复合酶提取灵芝多糖时,发现在30~50 ℃的酶解温度下,多糖的提取率逐渐上升,而高于50 ℃时多糖的提取率下降,分析可能是温度过高导致酶变性并失活,与本试验结果相似。综上,选择酶解温度为50 ℃较适宜。
2.3.3 酶解时间对DE值的影响
由图5可知,随着酶解时间的增加,DE值出现明显的上升趋势,当酶解时间达到50 min时,DE值达到最大值,为15.53%,此时为反应初期,增加酶解时间能够促进酶与底物充分反应;但此后再延长酶解时间,反而使得DE值下降。可能是由于当反应达到最大时,酶解底物消耗充分并且一部分酶的活性逐渐降低,反应产物对酶活性有一定的抑制作用,这也说明酶解时间越长,复合酶酶解底物的效率不一定越高。裴若楠等[29]通过响应面试验,在利用复合酶对石花菜粗多糖提取工艺优化的单因素试验中发现:在采用复合酶酶解石花菜的前120 min,多糖提取率逐渐增加,但当酶解时间延长至120 min后,多糖提取率不升反降,推测可能是在酶解120 min时多糖得到最大程度的溶出,而酶解时间过长,底物充分消耗且酶活性下降,致使多糖提取率下降。因此,选择酶解时间为50 min较适宜。
2.3.4 酶解pH对DE值的影响
由图6可知,随着pH的增大,DE值呈先上升后下降的趋势,当pH达到6时,DE值达16.21%,此后再增大pH值,DE值大幅度降低。普鲁兰酶和α-淀粉酶属于温和酶类,当pH过低或过高时,等电点偏离,影响复合酶的酶活性和底物的空间结构,从而影响DE值[30]。蒋德旗等[31]通過响应面法进行金果榄多糖提取工艺优化及抗氧化活性研究时,发现当pH为3~5时,金果榄多糖得率逐渐升高,当pH高于5时,金果榄多糖得率逐渐降低,分析原因可能是pH值过高或过低会影响酶活性,与本试验结果相似。综上,选择酶解pH为6较适宜。
2.4 Box-Behnken试验设计结果
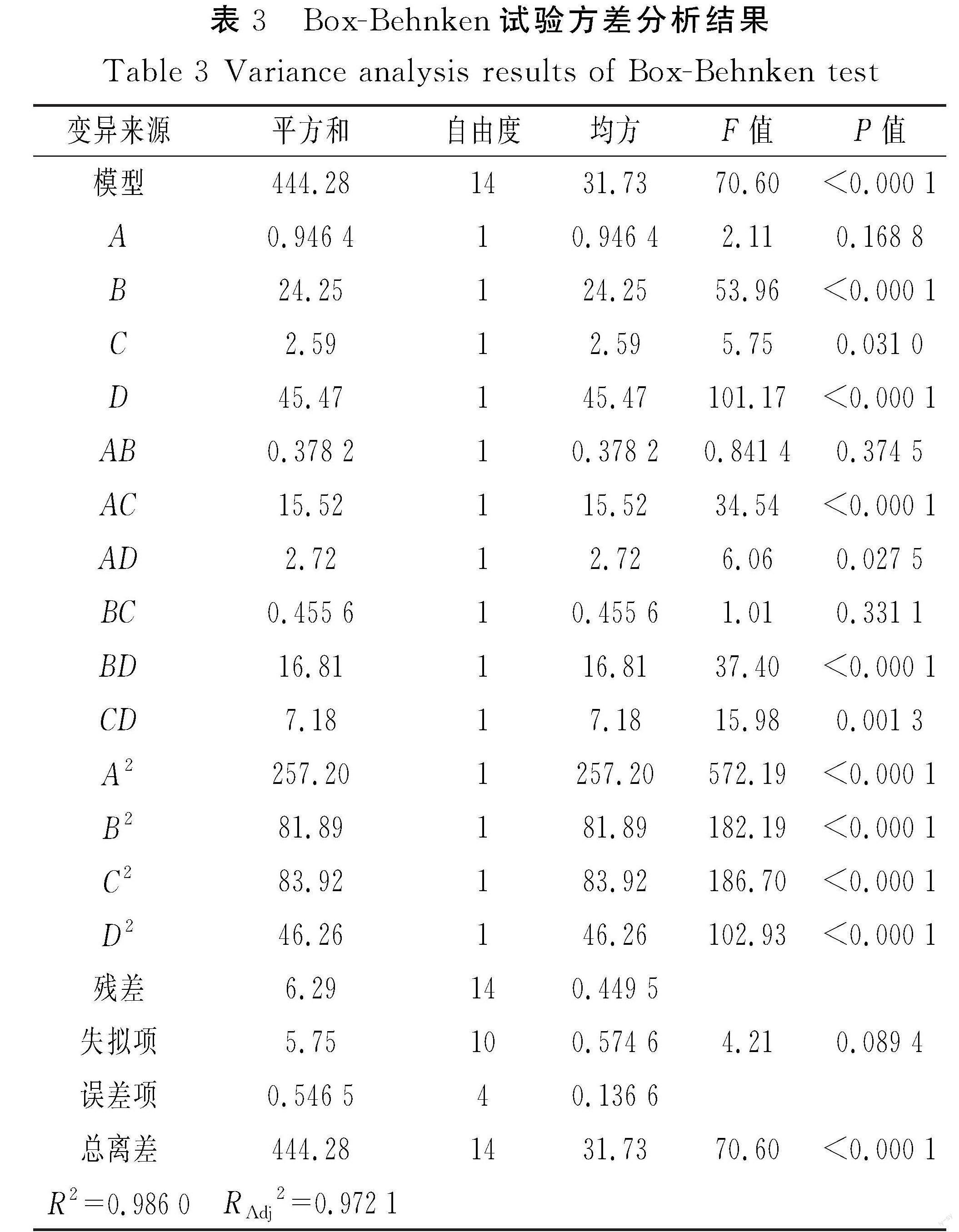
根据单因素试验结果,以芡实酶解后的DE值作为响应值[32],考察酶添加量(A)、酶解温度(B)、酶解时间(C)、pH(D)4个因素对水解程度DE值(Y)的影响,得出最优的试验方案。Box-Behnken试验方案与结果见表2,方差分析结果见表3。
运用响应面软件对试验结果进行分析,经回归拟合分析,得到芡实酶解DE值回归方程:Y=21.79+0.28A+1.42B+0.46C-1.95D+0.31AB+1.97AC+0.42AD-0.33BC-0.55BD-2.04CD-2.61A2-1.90B2-4.82C2-1.83D2。
由表3可知,二次多项回归模型的P<0.01,结果显著,失拟项的P=0.089 4>0.05,结果不显著,表明试验结果与模型结果差异性小,拟合度高。回归模型的R2=0.986 0,RAdj2=0.972 1,说明模型的拟合程度优良,预测值与试验值高度相关。残差是由随机误差引起的,故可以用该模型进行理论分析和预测。一次项B、D,二次项A2、B2、C2、D2,交互项 AC、BD、CD影响极显著(P<0.01),一次项C、交互项 AD影响显著(P<0.05),一次项A,交互项 AB、BC影响不显著。由此可得出,影响DE值的因素主次顺序为pH>酶解温度>酶解时间>酶添加量。
2.5 各因素交互作用和响应面分析
由Design-Expert 12.0软件对试验结果进行响应面图的绘制,通过3D响应面图能较直观地反映出各因素之间的交互作用对复合酶酶解芡实粉DE值的影响。响应面和等高线分析结果见图7。
响应曲面越陡峭,颜色越深,表明该因素对酶解后DE值的影响越大。在三维曲面图中,坡面陡峭程度越大,表明两因素的交互作用越强;在等高线图中,等高线越密集且呈椭圆形时交互作用越强。因此,各因素对复合酶酶解芡实DE值的影响程度为pH>酶解温度>酶解时间>酶添加量。
2.6 最佳工艺条件的确定及验证试验
采用Design-Expert 12.0软件,得出最佳工艺参数为pH 6.59、酶添加量0.34%、酶解温度56.50 ℃、酶解时间45.18 min。该条件下DE预测值为20.64%。对优化后的参数进行验证试验,为便于操作,将工艺参数调整为pH 6.5、酶添加量0.3%、酶解温度56 ℃、酶解时间45 min,在该条件下重复试验3次,测得酶解后的DE平均值为20.25%,与模型预测值无明显差异,说明该模型优化得到的芡实粉复合酶酶解工艺参数可靠。
2.7 抗氧化性结果分析
选择普鲁兰酶和α-淀粉酶在最佳酶解条件下对熟化后的芡实进行酶解,获得芡实多糖,芡实多糖的DPPH自由基清除能力见图8。
由图8可知,随着芡实多糖浓度的增加,DPPH自由基清除率呈增大趋势。在0.2~0.4 mg/mL浓度范围内,DPPH自由基清除率快速增加。然而,在0.4~1.0 mg/mL浓度范围内,可能是由于酶解后芡实多糖的浓度升高,分散性降低,抑制了电子的转移,使清除率的增长速率上升缓慢[30]。当浓度为1 mg/mL时,DPPH自由基清除率达到了61.43%,说明酶解后的芡实多糖具有良好的抗氧化活性。
3 结论
通过复合酶酶解技术酶解优质产地的芡实粉,以单因素试验为基础,进行Box-Behnken试验设计及响应面分析,从而获得最优工艺参数:在复合酶(普鲁兰酶∶α-淀粉酶)的质量比为5∶6、酶添加量为0.3%(以原料质量为基准)、pH为6.5、酶解温度为56 ℃、酶解时间为45 min的条件下,生产的芡实粉基料水解度可达20.25%,说明复合酶酶解技术有效增强了单位体积的能量;体外抗氧化活性试验表明,酶解后芡实多糖能显著清除DPPH自由基,具有一定的抗氧化活性。酶解后的芡实多糖有更好的抗氧化活性,可以广泛用于食品添加剂及保健食品中[33],该研究也为芡实多糖的生产制备与医药应用提供了相关的理论和数据依据[34]。
参考文献:
[1]DUTTA R N, JHA S N, JHA U N. Plant contents and quality of makhana (Euryale ferox)[J].Plant and Soil,1986,96(3):429-432.
[2]李湘利,刘静,燕伟,等.芡实多糖的抗氧化性及抑菌特性[J].食品与发酵工业,2014,40(11):104-108.
[3]李军明.芡实的营养价值及保健功能[J].中国食物与营养,2011,17(10):71-73.
[4]东方,王鑫,王伟伟,等.芡实多糖闪式提取工艺优化及抗氧化活性研究[J].食品科技,2020,45(12):174-181.
[5]朱煜冬,张汆,戚良号,等.芡实超微粉的小鼠体内延缓衰老功效[J].中国老年学杂志,2019,39(15):3732-3735.
[6]LEE S E, JU E M, KIM J H.Antioxidant activity of extracts from Euryale ferox seed[J].Experimental & Molecular Medicine,2002,34(2):100-106.
[7]WU C Y, CHEN R, WANG X S, et al. Antioxidant and anti-fatigue activities of phenolic extract from the seed coat of Euryale ferox Salisb. and identification of three phenolic compounds by LC-ESI-MS/MS[J].Molecules,2013,18(9):11003-11021.
[8]申雪敏,张国良,廖树红,等.芡实栽培技术研究进展[J].长江蔬菜,2021(2):44-49.
[9]陈岑,杨雯,蔡国子,等.芡实粉对面包品质及淀粉消化性的影响[J].食品科技,2018,43(12):179-185.
[10]马超,吴茂玉,朱风涛,等.我国芡实生产加工现状及发展对策[J].中国果菜,2009(8):44-45.
[11]ZHANG J. Design of the gordon euryale seed automatic shelling machine[J].Journal of Physics:Conference Series,2019, 1423:12053.
[12]陈坤林,张文莉,吴少福,等.响应面法优化挤压膨化芡实工艺及结构表征分析[J].中国调味品,2022,47(10):22-28.
[13]孔玉萍,夏怀翔.DE值检测方法的探讨[J].当代化工研究,2017(3):27-28.
[14]吴敏莲,梁洁洁,梁丽月.DE值测定结果准确性的关键影响因素探讨[J].食品安全导刊,2022(4):102-105.
[15]中华人民共和国农业部.水果及制品可溶性糖的测定 3,5-二硝基水杨酸比色法:NY/T 2742—2015[S].北京:中国标准出版社,2015.
[16]卢美娟,邵京,张红星,等.超声波复合酶法提取芡实多糖的工艺研究[J].安徽农业科学,2015,43(34):161-163.
[17]牛睿,韩宁娟,闫霞.芡实多糖的提取及含量测定[J].现代交际(学术版),2017(9):192.
[18]薛峰,孙锦杨,刘琪,等.芡实精深加工研究进展[J].食品工业科技,2016,37(11):390-394.
[19]HII S L, TAN J S, LING T C, et al. Pullulanase: role in starch hydrolysis and potential industrial applications[J].Enzyme Research,2012,2012:921362.
[20]莫琰,杨尚威,赵灿,等.普鲁兰酶酶解对葛根淀粉理化特性的影响[J].食品工业科技,2022,43(13):79-85.
[21]蒋黎明,陶阳,韩永斌,等.中强电场对α-淀粉酶水解玉米淀粉的影响[J].食品工业科技,2022,43(1):80-86.
[22]HAISSIG B E, ICKSON R E. Starch measurement in plant tissue using enzymatic hydrolysis[J].Physiologia Plantarum,1979,47(2):151-157.
[23]刘新育,谢夏,朱东东,等.木聚糖酶与XIP型木聚糖酶抑制蛋白相互作用分子机制的研究进展[J].微生物学通报,2020,47(7):2300-2308.
[24]王子妍,刘颖,贾健辉,等.预糊化-复合酶解法制备婴幼儿留胚米粉及其理化性质研究[J].食品工业科技,2022,43(20):228-234.
[25]李楊,吴慧,马丽媛,等.基于响应曲面法的玉米粉复合酶解工艺优化研究[J].粮食与油脂,2021,34(7):123-127.
[26]DANIEL R M, PETERSON M E, DANSON M J, et al. The molecular basis of the effect of temperature on enzyme activity[J].Biochemical Journal,2010,425(2):353-360.
[27]赵志浩,刘磊,张名位,等.预酶解-挤压膨化对全谷物糙米粉品质特性的影响[J].食品科学,2019,40(1):108-116.
[28]丁霄霄,李凤伟,商曰玲,等.灵芝多糖的复合酶法提取工艺优化[J].食品研究与开发,2020,41(5):34-39.
[29]裴若楠,翟红蕾,戚勃,等.复合酶法提取石花菜粗多糖工艺的响应面优化[J].南方水产科学,2019,15(6):88-95.
[30]付劢,陈继兰,王攀林,等.鸡胚蛋白的酶解工艺优化及抗氧化性研究[J].食品科技,2020,45(9):35-42.
[31]蒋德旗,柒善怀,张兰熙,等.响应面法优化金果榄多糖提取工艺及抗氧化活性研究[J].中国中医药信息杂志,2019,26(4):85-90.
[32]李梦倩,章海风,凌晓冬,等.模糊数学感官评价结合响应面法优化低脂蛋黄酱工艺配方[J].中国调味品,2021,46(8):82-87.
[33]张溢,孙培冬,陈桂冰,等.芡实多糖的提取、抗氧化活性及对质粒DNA氧化损伤防护作用的研究[J].食品工业科技,2015,36(11):122-126.
[34]李湘利,刘静,燕伟,等.芡实多糖的抗氧化性及抑菌特性[J].食品与发酵工业,2014,40(11):104-108.

