LuxS/AI-2群体感应系统在乳酸菌细菌素合成中的作用
满丽莉 向殿军

DOI:10.3969/j.issn.1000-9973.2024.03.036
引文格式:满丽莉,向殿军.LuxS/AI-2群体感应系统在乳酸菌细菌素合成中的作用[J].中国调味品,2024,49(3):214-220.
MAN L L, XIANG D J. Effect of LuxS/AI-2 quorum sensing system in bacteriocin synthesis of lactic acid bacteria[J].China Condiment,2024,49(3):214-220.
摘要:乳酸菌细菌素具有抑菌谱广、稳定性高、安全性高等优势,作为新型生物防腐剂备受青睐,但目前工业化应用的细菌素數量有限,合成量低是其应用受限的重要原因。国内外研究显示与特定的微生物共培养是提高乳酸菌细菌素合成量的有效方法,该过程受到LuxS/AI-2群体感应系统的调控。文章从乳酸菌LuxS/AI-2群体感应系统的组成及LuxS/AI-2群体感应系统在乳酸菌细菌素合成中的作用两个方面进行论述,为乳酸菌细菌素合成量的提高和工业化应用的实现提供了一定的理论依据。
关键词:LuxS/AI-2群体感应系统;乳酸菌;细菌素;合成
中图分类号:TS201.3 文献标志码:A 文章编号:1000-9973(2024)03-0214-07
Effect of LuxS/AI-2 Quorum Sensing System in Bacteriocin Synthesis of Lactic Acid Bacteria
MAN Li-li1, XIANG Dian-jun2*
(1.College of Life Sciences and Food Engineering, Inner Mongolia Minzu University, Tongliao 028042,
China; 2.College of Agriculture, Inner Mongolia Minzu University, Tongliao 028042, China)
Abstract: Bacteriocins of lactic acid bacteria have the advantages of broad antibacterial spectrum, high stability and high safety, making them highly favored as new biological preservatives. However, the amount of bacteriocins used in industrial application currently is limited, and low synthesis amount is an important reason for their limited application. Domestic and foreign studies show that co-culture with specific microorganisms is an effective method to improve the synthesis amount of bacteriocins of lactic acid bacteria, and the process is regulated by LuxS/AI-2 quorum sensing system. In this paper, the composition of LuxS/AI-2 quorum sensing system and the effect of LuxS/AI-2 quorum sensing system in the bacteriocin synthesis of lactic acid bacteria are discussed, which has provided a certain theoretical basis for the improvement of the bacteriocin synthesis amount of lactic acid bacteria and the realization of industrial application.
Key words: LuxS/AI-2 quorum sensing system; lactic acid bacteria; bacteriocin; synthesis
收稿日期:2023-09-27
基金项目:国家自然科学基金资助(32260614);内蒙古自治区自然科学基金资助(2022MS03058,2022MS03057);内蒙古自治区直属高校基本科研业务费项目(GXKY22151)
作者简介:满丽莉(1981—),女,副教授,博士,研究方向:微生物及代谢产物。
*通信作者:向殿军(1978—),男,教授,博士,研究方向:遗传育种。
乳酸菌细菌素为乳酸菌通过核糖体合成机制产生的具有生物活性、杀菌或溶菌作用的前体多肽、多肽或蛋白质[1-3],具备安全、天然、抑菌谱广等众多优势,能产生细菌素的乳酸菌被广泛应用于调味品、酸乳、干酪、发酵香肠、啤酒及水产品中[4-7],作为新型食品防腐剂备受关注,但目前商业化细菌素的种类有限,且细菌素合成量相对较低,提高乳酸菌细菌素合成量已成为研究的热点问题[8-11]。国内外研究显示,与特定微生物共培养是提高乳酸菌细菌素合成量的有效途径,该过程常受到LuxS/AI-2群体感应系统的调控[12]。
群体感应是一种依赖于细胞密度的天然动态调控体系,所有细菌群体感应系统均需满足3个规律:第一是信号分子在细胞内合成后,能分泌到细胞外部并达到阈值后发生反应;第二是在细胞内或细胞膜内外有特定接收信号分子的受体;第三是信号分子被检测到后进行相应基因的表达[13]。LuxS/AI-2群体感应系统又称种群间群体感应系统,普遍存在于G+和G-菌中,主要通过信号分子AI-2和双组分调控系统(TCS)发挥其调控作用[14-16]。典型的TCS包括位于细胞质膜的组氨酸蛋白激酶(HPK)和位于细胞质中的反应调节蛋白(RR)两部分[17]。HPK作为感受器,能监测环境变化(如共培养菌株的存在),RR具有传递来自感受器的信号和调节基因表达的作用,可引发同一个调节子中多个基因的表达[18]。本文论述了乳酸菌LuxS/AI-2群体感应系统的组成及LuxS/AI-2群体感应系统在乳酸菌细菌素合成中的作用,有利于乳酸菌细菌素的商业化应用和食品质量安全的提升。
1 乳酸菌中LuxS/AI-2群体感应系统的组成
1.1 信号分子-AI-2
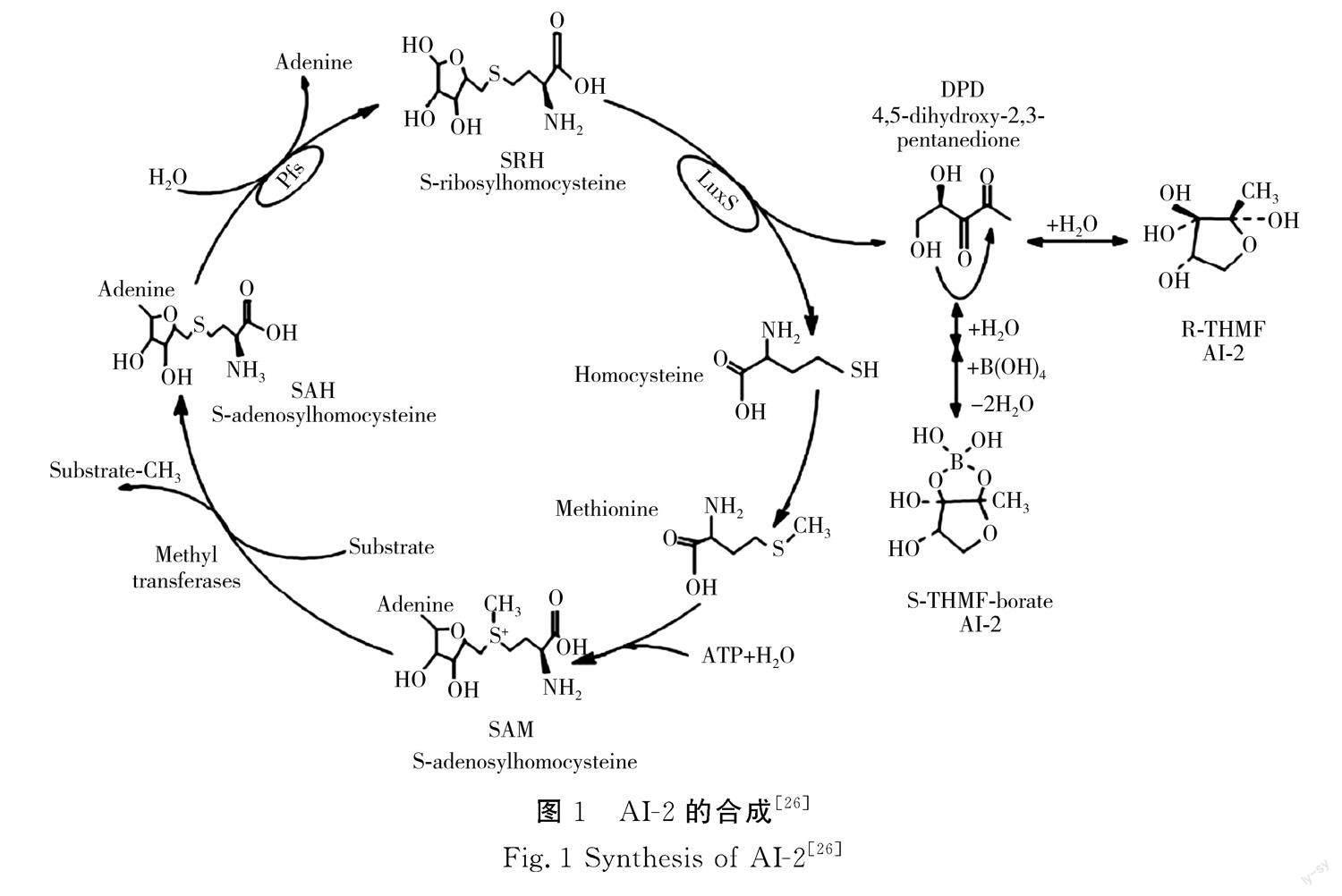
AI-2是活化甲基循环(AMC)的副产物,其保守性较高,可被不同微生物相互识别和传递[19-20]。目前认为AI-2是LuxS/AI-2群体感应系统的通用信号分子,菌体通过信号分子感知外界的各种刺激及竞争压力(包括其他微生物的存在、热胁迫、冷胁迫、酸胁迫等),启动相关基因,调整自身行为[21]。由图1可知,AI-2为呋喃硼酸二酯,其合成途径是通过三步酶催化反应完成的,第一步:S-腺苷甲硫氨酸合酶(MetK)将蛋氨酸(由高半胱氨酸甲基化生成)转化为S-腺苷甲硫氨酸(SAM),SAM作为甲基供体(蛋白质、RNA及DNA的甲基供体)合成S-腺苷高半胱氨酸(SAH);第二步:S-腺苷高半胱氨酸核苷酶(Pfs)将SAH水解为腺嘌呤和S-核糖高半胱氨酸(SRH);第三步:LuxS蛋白(Fe2+依赖性金属酶)将SRH催化为AI-2前体物(4,5-二羟基-2,3-戊二酮),其在硼离子作用下重排为呋喃酮酰硼酸二酯(DPD),DPD通过环化和硼酸盐作用合成AI-2信号分子[22-24]。LuxS蛋白是AI-2合成的关键酶,相关研究显示AI-2合成需依赖于luxS基因的表达和调控,luxS基因的突变会导致LuxS蛋白失活,将无法检测到AI-2的存在[25]。
1.2 乳酸菌中与细菌素合成相关的双组分调控系统
1.2.1 植物乳杆菌中与细菌素合成相关的双组分调控系统
由图2可知,植物乳杆菌中与细菌素合成相关的双组分调控系统主要包括3种类型:第一种类型是PlnB(HPK)、PlnC和PlnD(RR),PlnC能激活转录并合成细菌素,而PlnD呈现负调节作用,植物乳杆菌ST-Ⅲ、C11、J51、WCFS1、ATCC14917、V90、YM-4-3、BFE5092中的雙组分系统就属于此类;第二种类型是PlnB(HPK)和PlnD(RR),植物乳杆菌JDM1中的双组分系统就属于此类;第三种类型是PlNC8HK(HPK)和PlnD(RR),植物乳杆菌PCS20、NC8、LB6、LZ206、J23、LPT70/3、KLDS1.0391、5-2、163、UL4中的双组分系统就属于此类[27-30]。不同植物乳杆菌的细菌素合成量存在差异,控制其合成的双组分调控系统亦存在异同,明确植物乳杆菌中与细菌素合成相关的双组分调控系统类型,有助于更好地提高细菌素合成量。
1.2.2 清酒乳杆菌中与细菌素合成相关的双组分调控系统
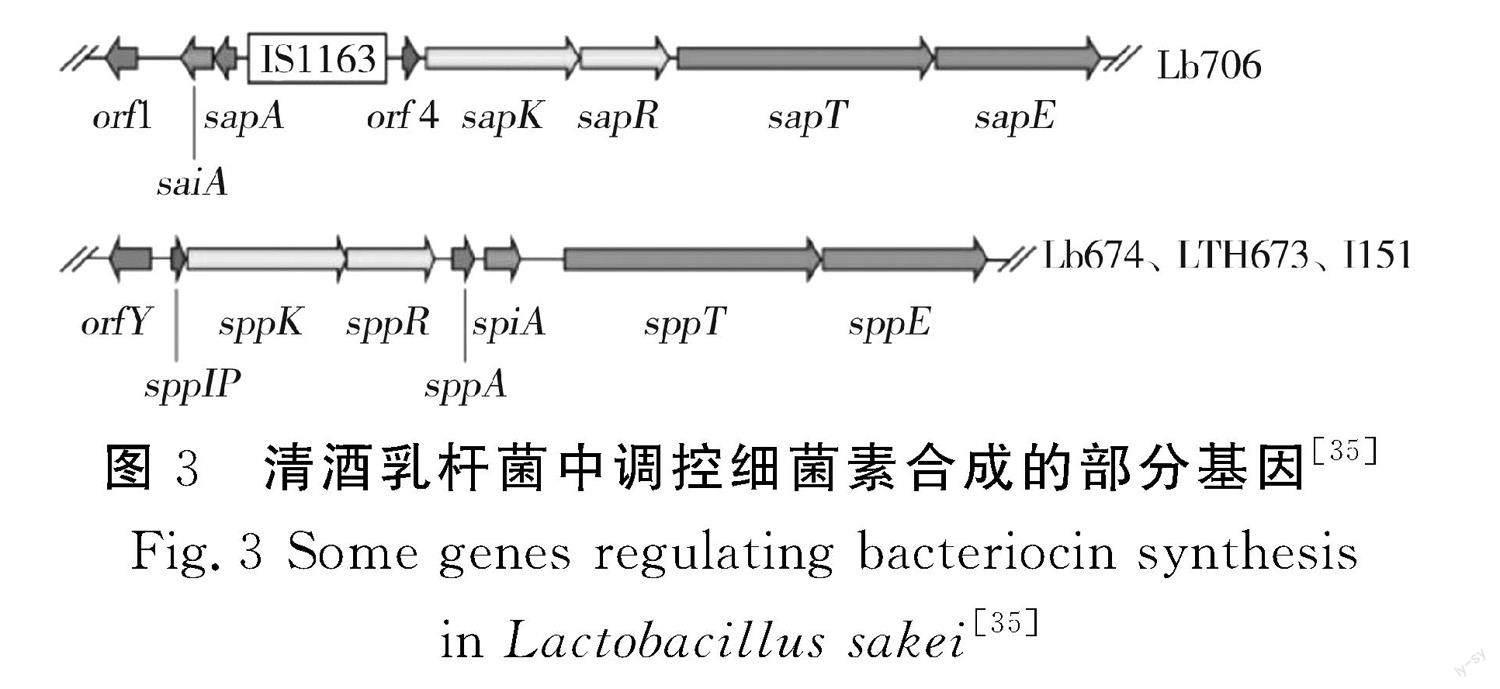
由图3可知,清酒乳杆菌 Lb674、LTH673、I151中与Sakacin P合成相关的双组分调控系统为SppK(HPK)和SppR(RR),SppK与植物乳杆菌C11中plantaricin A合成相关的组氨酸蛋白激酶PlnB及反应调节蛋白PlnC、PlnD的相似性分别高达59%、65%、68%。SppK和SppR编码基因的突变会导致Sakacin P无法合成,说明两者是清酒乳杆菌 Lb674、LTH673、I151细菌素合成所必需的[33]。清酒乳杆菌 Lb706中与Sakacin A合成相关的双组分调控系统为SapK(HPK)和SapR(RR),SapK和SapR编码基因的突变会导致Sakacin A合成能力和免疫能力丧失,SapK和SapR调控细菌素Sakacin A合成基因的转录,sapR的转录激活靶点为LIR和RIR [34-35]。
1.2.3 栖鱼肉杆菌中与细菌素合成相关的双组分调控系统
由图4可知,栖鱼肉杆菌LV17B中与Carnobacteriocin B2和Carnobacteriocin BM1合成相关的双组分调控系统为CbnK(HPK)和CbnR(RR),cbnR基因的移码突变会导致细菌素无法正常合成。栖鱼肉杆菌LV17A中与Carnobacteriocin A合成相关的双组分调控系统为CbaK(HPK)和CbaR(RR),CbaK(HPK)和CbaR(RR)分别是栖鱼肉杆菌LV17B中的CbnK(HPK)和CbnR(RR)的同源物,缺失分析显示CbaK和CbaR是该菌株细菌素合成所必需的[34]。
1.2.4 乳酸乳球菌中与细菌素合成相关的双组分调控系统
由图5可知,乳酸乳球菌Nisin的合成受双组分信号转导系统NisK(HPK)和NisR(RR)的调控,当nisK或nisR缺失时,Nisin将无法正常合成,说明两者是Nisin合成所必需的[36]。在乳酸乳球菌乳酸亚种A164中引入多拷贝基因使nisRK过表达,Nisin合成量较野生型菌株提高1.56倍[37]。
1.2.5 嗜酸乳杆菌中与细菌素合成相关的双组分调控系统
嗜酸乳杆菌为应用广泛的商业化菌株,其可分泌细菌素Lactacin B、Lactacin F等。通过与其他微生物的双组分调控系统进行比对,预测嗜酸乳杆菌中双组分调控系统的功能,由于嗜酸乳杆菌中双组分系统YP194634/YP194633和YP193512/YP193513与唾液乳杆菌UCC118中调节Ⅱ型细菌素ABP-118分泌的双组分调控系统AbpK/AbpR具有较高的相似性,所以预测嗜酸乳杆菌中双组分系统YP194634/YP194633和YP193512/YP193513涉及细菌素合成的调控[38]。
1.2.6 约氏乳杆菌中与细菌素合成相关的双组分调控系统
通过与其他微生物的双组分调控系统进行比对,预测约氏乳杆菌中双组分调控系统的功能,约氏乳杆菌中双组分调控系统NP964617/NP964619、NP964473/NP964474均与唾液乳杆菌UCC118中调节Ⅱ型细菌素ABP-118分泌的双组分调控系统AbpK/AbpR具有较高的相似性,预测约氏乳杆菌中双组分调控系统NP964617/NP964619和NP964473/NP964474涉及细菌素合成的调控[39]。
1.2.7 副干酪乳杆菌中与细菌素合成相关的双组分调控系统
副干酪乳杆菌 HD1.7中与细菌素合成相关的双组分调控系统是PrcK和PrcR,PrcK与功能已被证实(负责细菌素合成的调控)的低GC革兰氏阳性菌群体感应系统的HPK家族中HPK10亚家族的相似度较高,PrcK的N末端由6个跨膜区域(α螺旋)构成,此为HPK10亚族特有的拓扑学结构[40]。PrcR包括REC区域(信号接收区)、LytTR区域(LytTrDNA结合区域)、LytT区域3个保守区域,PrcR与干酪乳杆菌ATCC 334的反应调节蛋白的相似度达到100%,属于LytR/AlgR家族,负责细菌素合成的调控[41]。
1.2.8 其他乳酸菌中與细菌素合成相关的双组分调控系统
由图6可知,格氏乳杆菌EV1461中与细菌素Gassericin E合成相关的双组分调控系统是GaeK(HPK)和GaeR(RR)。GaeK与格氏乳杆菌LA158中调控细菌素Gassericin T合成的组氨酸蛋白激酶的相似度高达99%。GaeR与格氏乳杆菌LA158、JV-V03和K7中调控细菌素Gassericin合成的反应调节蛋白具有高度的相似性[42]。格氏乳杆菌LM19中与细菌素Gassericin M合成相关的双组分调控系统是GamK(HPK)和GamR(RR)[43]。
由图7可知,屎肠球菌BZ2、DPC1146中与细菌素合成相关的双组分调控系统是EntK(HPK)和EntR(RR)[35]。
2 LuxS/AI-2群体感应系统在乳酸菌细菌素合成中的作用
2.1 基于LuxS/AI-2群体感应系统调控乳酸菌种间共培养细菌素的合成
目前国内外研究发现乳酸菌与某些革兰氏阳性菌共培养可诱导细菌素的合成,该过程在多数情况下受LuxS/AI-2群体感应系统的调控[44]。Maldonado等[45]研究发现植物乳杆菌NC8单独培养无法合成细菌素,当与唾液乳杆菌NCFB 2747、乳酸乳球菌MG 1363、罗伊氏乳杆菌DSM 20016共培养时能诱导细菌素的合成,尤其是与乳酸乳球菌MG 1363共培养时,植物乳杆菌NC8的细菌素合成量显著提高(2 560 IU/mL)。Man等[46]研究发现植物乳杆菌NMD-17与罗伊氏乳杆菌NMD-86共培养过程中,与其单独培养相比较,植物乳杆菌的细胞密度和AI-2浓度在6~9 h显著增加,实时荧光定量结果显示植物乳杆菌NMD-17中细菌素编码基因plnF和plnE、组氨酸蛋白激酶编码基因plnB和反应调节蛋白编码基因plnD及luxS基因的转录水平显著提高,分别提高了3.87,4.13,1.96,1.81,2.52倍。张筠等[47]研究表明外源添加AI-2可诱导植物乳杆菌KLDS1.0391的细菌素合成,同时植物乳杆菌KLDS 1.0391中细菌素结构基因和群体感应系统编码基因的转录水平显著提高。Jia等[48]应用蛋白组学技术明确luxS基因在植物乳杆菌KLDS1.0391共培养细菌素合成中发挥重要的调控作用,该过程涉及双组分调控系统、氨基酸代谢、碳水化合物代谢及脂肪酸合成与代谢 [49]。Di Cagno等[50]研究表明与旧金山乳杆菌DPPMA174共培养可诱导植物乳杆菌DC400的细菌素合成量和AI-2活性增加,2-DE及Nano-LC-ESI-MS/MS结果表明共培养后植物乳杆菌DC400中LuxS蛋白的表达量是纯培养时的2~3倍,表明LuxS/AI-2群体感应系统在共培养诱导细菌素过程中发挥调控作用[51]。
Li等[52]研究发现与干酪乳杆菌共培养时,植物乳杆菌AB-1的细菌素合成量及luxS基因的表达量均显著提高,结果表明该过程可能受到LuxS/AI-2群体感应系统的调控。张腾[53]研究发现与乳酸乳球菌、屎肠球菌、植物乳杆菌、发酵乳杆菌、乳酸片球菌共培养时,均可诱导植物乳杆菌HE-1的细菌素合成,植物乳杆菌HE-1与屎肠球菌HE-521共培养时抑菌活性最大(17.84 mm),同时细菌素合成与AI-2信号分子产生的时间与数量之间存在相关关系。Man等[54-55]研究表明与瑞士乳杆菌KLDS1.9207共培养后,能够显著提高植物乳杆菌KLDS1.0391的细菌素合成量,共培养过程中抑菌活性与植物乳杆菌KLDS1.0391的菌体密度和AI-2浓度呈现正相关性,实时荧光定量PCR结果显示plNC8HK、plnD、luxS基因的表达水平显著上调,分别是纯培养的1.88,1.51,2.14倍,基因突变结果表明双组分调控系统是该菌株细菌素合成所必需的,luxS基因在共培养细菌素合成中发挥重要调节作用。
2.2 基于LuxS/AI-2群体感应系统调控乳酸菌与其他种属菌株共培养细菌素的合成
枯草芽孢杆菌与副干酪乳杆菌HD1.7按1∶1、3∶1、5∶1、5∶2的初始比例共培养时,枯草芽孢杆菌可诱导副干酪乳杆菌HD1.7细菌素Paracin1.7的合成,同时LuxS/AI-2群体感应系统相关基因luxS、prcK(组氨酸蛋白激酶编码基因)和prcR(反应调节蛋白编码基因)表达量显著上调[56]。嗜酸乳杆菌 NCFM与单核增生李斯特氏菌EGD-e共培养后,两者为竞争关系,嗜酸乳杆菌NCFM对单核增生李斯特氏菌EGD-e呈现明显的抑制作用,表明可能与抑菌物质的合成有关,同时嗜酸乳杆菌NCFM共培养后luxS基因表达量显著高于纯培养[57]。
2.3 LuxS/AI-2群体感应系统对乳酸菌细菌素合成的调控机制
由图8可知,某些共培养微生物被认为是乳酸菌一种外部刺激物,乳酸菌可通过种群间群体感应系统调控自身行为,适应共培养环境,产生大量细菌素。首先乳酸菌本身的细胞密度增加,随之而来的是AI-2在细胞内的合成量不断增加,细胞内合成的AI-2经主动或被动方式转运到细胞外部,并在外部环境中不断积累,当浓度达到阈值时,会引发组氨酸蛋白激酶磷酸化,磷酸化后的组氨酸蛋白激酶将磷酸基团转运给反应调节蛋白,导致其发生磷酸化,进而激活细菌素合成相关转录因子,最终影响细菌素合成相关基因的表达[55,58]。
3 结论
乳酸菌细菌素可作为食品添加剂、新型防腐剂应用于发酵香菇调味食品、酸奶味香精基料、水产品等诸多领域中[59-61],但合成量过低限制了乳酸菌细菌素的工业化应用。提高乳酸菌细菌素合成量的常用方法有菌株选育、发酵条件优化、诱变育种、异源表达,但存在增幅过低、表达产物活性低、安全性低等问题。基于LuxS/AI-2群体感应系統提高细菌素合成量,充分考虑到乳酸菌的来源、本身特征和代谢,安全性更高,从转录水平上实现其调控过程,是最经济的调控乳酸菌细菌素合成量的方式。迄今为止,虽然研究者已经对luxS基因和AI-2在共培养细菌素合成中的作用有了初步的研究与认识,但尚未全面地阐释清晰。群体感应系统在不同的环境变化和外部刺激下会呈现不同的反应,基于新方法和新技术(代谢组学、蛋白组学、基因组学)实现群体感应系统的正向调控,深入挖掘调控机制,有利于充分发挥乳酸菌细菌素对人体健康和食品安全的推动作用。
参考文献:
[1]刘国荣,任桂美,李雪,等.动物双歧杆菌细菌素bifidocin A群体感应合成调控行为分析[J].食品科学,2018,39(12):161-166.
[2]徐栋,王晓琪,王月姣,等.植物乳杆菌LZ222细菌素的分离纯化及其特性[J].中国食品学报,2018,18(12):157-161.
[3]SHARMA B R, HALAMI P M, TAMANG J P. Novel pathways in bacteriocin synthesis by lactic acid bacteria with special reference to ethnic fermented foods[J].Food Science and Biotechnology,2021,31:1-16.
[4]赵志平,张钰麟,康馨樾,等.防腐剂对常温贮藏冷吃兔中兔肉品质的影响[J].中国调味品,2021,46(12):27-30.
[5]龚福明,何彩梅,吴桂容,等.乳酸菌降解发酵蔬菜中亚硝酸盐的研究现状[J].中国调味品,2022,47(10):201-205.
[6]张杰,王成,郑建强,等.复配防腐剂延长肉粉肠货架期的研究[J].中国调味品,2022,47(10):131-136.
[7]张益卓,赵长青,赵兴秀,等.乳酸链球菌素在延长猪肉干保藏期中的应用[J].中国调味品,2022,47(3):44-48.
[8]DE GIANI A, BOVIO F, FORCELLA M, et al. Identification of a bacteriocin-like compound from Lactobacillus plantarum with antimicrobial activity and effects on normal and cancerogenic human intestinal cells[J].AMB Express,2019,9:88-98.
[9]ANGELESCU I R, GROSU-TUDOR S S, COJOC L R, et al. Isolation, characterization, and mode of action of a class Ⅲ bacteriocin produced by Lactobacillus helveticus 34.9[J].World Journal of Microbiology and Biotechnology,2022,38(12):220.
[10]PIAZENTIN A C M, MENDONA C M N, VALLEJO M, et al. Bacteriocin-like inhibitory substances production by Enterococcus faecium 135 in co-culture with Ligilactobacillus salivarius and Limosilactobacillus reuteri[J].Brazilian Journal of Microbiology,2022,53:131-141.
[11]REFAY R M, ABUSHADY H M, AMER S A, et al. Determination of bacteriocin-encoding genes of lactic acid bacteria isolated from traditional dairy products of Luxor province, Egypt[J].Future Journal of Pharmaceutical Sciences,2020,6(1):1-14.
[12]MALDONADO A, RUIZ-BARBA J L, JIMNEZ-DAZ R. Production of plantaricin NC8 by Lactobacillus plantarum NC8 is induced in the presence of different types of gram-positive bacteria[J].Archives of Microbiology,2004,181(1):8-16.
[13]李海涛.群体感应(QS)信号分子分泌菌的生长动力学特性及其对芘生物降解的促进作用[D].西安:西安建筑科技大学,2020.
[14]逄晓阳,朱青,芦晶,等.乳酸菌群体感应系统研究进展[J].生物加工过程,2020,18(2):141-149.
[15]ROJO-BEZARES B, SENZ Y, NAVARRO L, et al. Coculture-inducible bacteriocin activity of Lactobacillus plantarum strain J23 isolated from grape must[J].Food Microbiology,2007,24(5):482-491.
[16]JIANG L, LUO Y, CAO X, et al. LuxS quorum sensing system mediating Lactobacillus plantarum probiotic characteristics[J].Archives of Microbiology,2021,203(7):4141-4148.
[17]KAREB O, ADER M. Quorum sensing circuits in the communicating mechanisms of bacteria and its implication in the biosynthesis of bacteriocins by lactic acid bacteria: a review[J].Probiotics and Antimicrobial Proteins,2020,12(1):5-17.
[18]杨郁荭,王辉.双组分调节系统对乳酸菌产细菌素过程的影响[J].中国乳品工业,2011,39(6):51-54.
[19]黎凡.动态调控策略在代谢工程中的应用研究进展[D].杭州:浙江工商大学,2020.
[20]魏华.基于群体感应的苯胺生物降解作用研究[D].武汉:武汉理工大学,2021.
[21]于政,申晓林,孙新晓,等.动态调控策略在代谢工程中的应用研究进展[J].合成生物学,2020(4):440-453.
[22]林才云,姚琳,李风铃,等.LuxS/AI-2群体感应系统及其对细菌致病性和耐药性的调控[J].食品安全质量检测学报,2019,18(10):5983-5389.
[23]FEDERLE M J, BASSLER B L. Interspecies communication in bacteria[J].The Journal of Clinical Investigation,2003,112(9):1291-1299.
[24]DI CAGNO R, DE ANGELIS M, CALASSO M, et al. Proteomics of the bacterial cross-talk by quorum sensing[J].Journal of Proteomics,2011,74(1):19-34.
[25]賈芳芳,孟祥晨.乳酸菌中共培养诱导细菌素产生机制的研究进展[J].食品安全质量检测学报,2017,8(4):1298-1304.
[26]林才云,姚琳,李风铃,等.LuxS/AI-2群体感应系统及其对细菌致病性和耐药性的调控[J].食品安全质量检测学报,2019,18(10):5983-5389.
[27]TAI H F, FOO H L, RAHIM R A, et al. Molecular characterisation of new organisation of plnEF and plw loci of bacteriocin genes harbour concomitantly in Lactobacillus plantarum I-UL4[J].Microbial Cell Factories,2015,14(1):89.
[28]SAENZ Y, ROJO-BEZARES B, NAVARRO L, et al. Genetic diversity of the pln locus among oenological Lactobacillus plantarum strains[J].International Journal of Food Microbiology,2009,134(3):176-183.
[29]LUAN J J, ZHANG Z H, LI X R, et al. Genetic analysis of plantaricin locus in Lactobacillus plantarum subsp. plantarum YM-4-3[J].Journal of Kunming University of Science and Technology,2013,38(4):75-81.
[30]周幸,阿热爱·巴合提,李平兰.微生物群体感应系统与食品防腐保鲜[J].生物加工过程,2020,18(2):184-192.
[31]陆兆新,孟凡强.植物乳杆菌素合成及其调控机制的研究进展[J].南京农业大学学报,2018,41(5):784-792.
[32]QUADRI L E N. Regulation of class II bacteriocin production by cell-cell signaling[J].Journal of Microbiology,2003,41(3):175-182.
[33]HHNE K, AXELSSON L, HOLCK A, et al. Analysis of the sakacin P gene cluster from Lactobacillus sake Lb674 and its expression in sakacin-negative Lb. sake strains[J].Microbiology,1996,142(6):1437-1448.
[34]QUADRI L E N. Regulation of antimicrobial peptide production by autoinducer-mediated quorum sensing in lactic acid bacteria[J].Antonie Van Leeuwenhoek,2002,82:133-145.
[35]满丽莉,孟祥晨,王辉,等.群体感应系统在乳酸菌产细菌素中的作用[J].食品科学,2011,32(13):360-364.
[36]MIERAU I, KLEEREBEZEM M. 10 years of the nisin-controlled gene expression system (NICE) in Lactococcus lactis[J].Applied Microbiology and Biotechnology,2005,68(6):705-717.
[37]CHEIGH C I, PARK H, CHOI H J, et al. Enhanced nisin production by increasing genes involved in nisin Z biosynthesis in Lactococcus lactis subsp. lactis A164[J].Biotechnology Letters,2005,27(3):155-160.
[38]AZCARATE-PERIL M A, MCAULIFFE O, ALTERMANN E, et al. Microarray analysis of a two-component regulatory system involved in acid resistance and proteolytic activity in Lactobacillus acidophilus[J].Applied and Environmental Microbiology,2005,71(10):5794-5804.
[39]崔艷华,曲晓军.乳酸菌的群体交流[J].生命化学,2009,29(3):447-450.
[40]王洋,葛菁萍,由田,等.副干酪乳杆菌prcA基因克隆及生物信息学分析[J].中国农学通报,2014,30(18):259-263.
[41]赵晓龙.L. paracasei HD1.7 prcR定点突变及pMG36e对该菌的转化[D].哈尔滨:黑龙江大学,2008.
[42]MALDONADO-BARRAGN A, CABALLERO-GUERRERO B, MARTN V, et al. Purification and genetic characterization of gassericin E, a novel co-culture inducible bacteriocin from Lactobacillus gasseri EV1461 isolated from the vagina of a healthy woman[J].BMC microbiology,2016,16:1-13.
[43]GARCIA-GUTIERREZ E, O'CONNOR P M, COLQUHOUN I J, et al. Production of multiple bacteriocins, including the novel bacteriocin gassericin M, by Lactobacillus gasseri LM19, a strain isolated from human milk[J].Applied Microbiology and Biotechnology,2020,104(9):3869-3884.
[44]CHANOS P, MYGIND T. Co-culture-inducible bacteriocin production in lactic acid bacteria[J].Applied Microbiology and Biotechnology,2016,100(10):4297-4308.
[45]MALDONADO A, JIMNEZ-DAZ R, RUIZ-BARBA J L. Induction of plantaricin production in Lactobacillus plantarum NC8 after coculture with specific gram-positive bacteria is mediated by an autoinduction mechanism[J].Journal of Bacteriology,2004,186(5):1556-1564.
[46]MAN L L, XIANG D J. LuxS-mediated quorum sensing system in Lactobacillus plantarum NMD-17 from koumiss:induction of plantaricin MX in co-cultivation with certain lactic acid bacteria[J].Folia Microbiologica,2021,66:855-871.
[47]张筠,杨杰,孟祥晨,等.AI-2的体外合成及其对植物乳杆菌KLDS1.0391细菌素合成的影响[J].食品工业科技,2015,36(23):199-203.
[48]JIA F F, PANG X H, ZHU D Q, et al. Role of the luxS gene in bacteriocin biosynthesis by Lactobacillus plantarum KLDS1.0391: a proteomic analysis[J].Scientific Reports,2017(7):13871.
[49]孔令誉,夏超然,沈淇元,等.乳酸菌合成细菌素的细胞通讯机制研究进展[J].中国食品学报,2022,22(12):360-372.
[50]DI CAGNO R, DE ANGELIS M, CODA R, et al. Molecular adaptation of sourdough Lactobacillus plantarum DC400 under co-cultivation with other lactobacilli[J].Research in Microbiology,2009,160:358-366.
[51]黄雨霞,武瑞赟,李平兰.群体感应系统调控乳酸菌细菌素合成的研究进展[J].生物加工过程,2019,17(3):251-256.
[52]LI J P, YANG X Y, SHI G C, et al. Cooperation of lactic acid bacteria regulated by the AI-2/LuxS system involve in the biopreservation of refrigerated shrimp[J].Food Research International,2019,120:679-687.
[53]張腾.植物乳杆菌HE-1在共培养中产抑菌物质与LuxS/AI-2群体感应现象关系的研究[D].呼和浩特:内蒙古农业大学,2014.
[54]MAN L L, MENG X C, ZHAO R H. Induction of plantaricin MG under co-culture with certain lactic acid bacterial strains and identification of LuxS mediated quorum sensing system in Lactobacillus plantarum KLDS1.0391[J].Food Control,2012,23(2):462-469.
[55]MAN L L, MENG X C, ZHAO R H, et al. The role of plNC8HK-plnD genes in bacteriocin production in Lactobacillus plantarum KLDS1.0391[J].International Dairy Journal,2014,34(2):267-274.
[56]岳元春.副干酪乳杆菌HD1.7与芽孢杆菌属共培养协同合作策略的研究[D].哈尔滨:黑龙江大学,2017.
[57]张腾,贺银凤.基于LuxS的群体感应系统在乳酸菌共培养中的研究[J].食品与发酵工业,2012,38(8):119-124.
[58]宋晓东.植物乳杆菌种间群体感应信号分子合成关键基因luxS的功能研究[D].昆明:昆明理工大学,2017.
[59]贾亚娟,李波,席越阳,等.乳酸菌发酵香菇调味食品的研制开发[J].中国调味品,2022,47(9):126-130.
[60]徐永霞,白旭婷,赵洪雷,等.植物乳杆菌在水产品中的应用研究进展[J].中国调味品,2022,47(2):195-199.
[61]任文彬,李玉坤,汪薇,等.干酪乳杆菌发酵制备酸奶味香精基料的研究[J].中国调味品,2021,46(9):166-170.

