原花青素对大豆分离蛋白凝胶流变特性及抗氧化活性的影响
李婧御 李元鑫 刘冉 孙永旺 郭尚敬 穆洪静 赵庆奎


DOI:10.3969/j.issn.1000-9973.2024.03.013
引文格式:李婧御,李元鑫,刘冉,等.原花青素对大豆分离蛋白凝胶流变特性及抗氧化活性的影响[J].中国调味品,2024,49(3):81-86.
LI J Y, LI Y X, LIU R, et al.Effect of oligomeric proanthocyanidins on rheological properties and antioxidant activity of soybean protein isolate gels[J].China Condiment,2024,49(3):81-86.
摘要:利用植物多酚原花青素(oligomeric proanthocyanidins,OPC)与大豆分离蛋白(soybean protein isolate,SPI)的相互作用,采用葡萄糖酸内酯诱导结合超声波处理制备OPC-SPI凝胶,旨在改善SPI凝胶性能。研究不同浓度OPC(0.1%、0.3%、0.5%)对SPI凝胶流变特性和抗氧化活性的影响。结果表明,随着OPC浓度的增加,包埋率增加,荷载量减小,最大荷载量达到35.575 3 μg/mg。隨着OPC浓度的增加,OPC-SPI凝胶的弹性模量和黏性模量增加,损耗因子随之降低,对频率的依赖性降低;但对凝胶的黏度无显著差异。OPC-SPI对1,1-二苯基-2-三硝基苯肼(DPPH)自由基、2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)自由基以及羟自由基的清除能力优于SPI。OPC能够有效增强SPI的凝胶黏弹性和抗氧化活性,为进一步开发新型抗氧化复合SPI凝胶提供了理论依据。
关键词:原花青素;大豆分离蛋白;流变特性;抗氧化活性
中图分类号:TS201.1 文献标志码:A 文章编号:1000-9973(2024)03-0081-06
Effect of Oligomeric Proanthocyanidins on Rheological Properties
and Antioxidant Activity of Soybean Protein Isolate Gels
LI Jing-yu1, LI Yuan-xin1, LIU Ran1*, SUN Yong-wang1,
GUO Shang-jing1, MU Hong-jing2, ZHAO Qing-kui2
(1.School of Agricultural Science and Engineering, Liaocheng University, Liaocheng 252000,
China; 2.Shandong Guohong Biotechnology Co., Ltd., Liaocheng 252000, China)
Abstract: The OPC-SPI gels are prepared using the interaction of oligomeric proanthocyanidins (OPC) and soybean protein isolate (SPI) by gluconolactone induction combined with ultrasonic treatment, in order to improve the properties of SPI gels. The effects of different concentrations of OPC (0.1%, 0.3%, 0.5%) on the rheological properties and antioxidant activity of SPI gels are investigated. The results show that the encapsulation rate increases and the load decreases with the increase of OPC concentration, reaching a maximum load of 35.575 3 μg/mg. With the increase of OPC concentration, the elastic modulus and viscous modulus of OPC-SPI gels increase, the loss factor decreases, and the dependence on frequency decreases. However, there is no significant difference in the viscosity of gels. The scavenging capacity of OPC-SPI on 1,1-diphenyl-2-trinitrophenylhydrazine (DPPH) free radicals, 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonate) (ABTS) free radicals and hydroxyl free radicals is better than that of SPI. OPC can effectively enhance the
gel viscoelasticity and antioxidant activity of SPI, which has provided a theoretical basis for the further development of new antioxidant composite SPI gels.
Key words:oligomeric proanthocyanidins(OPC);soybean protein isolate(SPI);rheological properties; antioxidant activity
收稿日期:2023-08-16
基金項目:博士启动基金项目(318051603);山东省农业科技园区产业提升工程项目(2019YQ035);国家自然科学基金青年基金项目(32101788); 聊城大学博士科研启动基金项目(318052021)
作者简介:李婧御(2000—),女,硕士研究生,研究方向:作物遗传育种。
*通信作者:刘冉(1989—),女,讲师,博士,研究方向:食品化学与营养。
原花青素(oligomeric proanthocyanidins,OPC) 是一种纯天然的自由基抗氧化剂,具有良好的抗氧化能力[1]; 组成成分为不同的儿茶素或表儿茶素。OPC含有大量的酚羟基,可以清除自由基,并以邻苯二酚基团螯合金属离子,因此比维生素 C、维生素 E有更好的防护作用,防止氧化应激损伤[2]。OPC能发挥抗氧化、抗肥胖、抗糖尿病、抗癌等药理作用[3],因此被广泛应用于食品中。但OPC易受温度、光照的影响,稳定性较差[4],加工过程和贮藏过程中以及在严重的胃肠道环境中难以维持活性[5]。目前有多种增强其稳定性的方式。Sheng等[6]利用海藻酸钠和不同纤维素衍生物对葡萄籽原花青素提取物进行包埋,被包埋的原花青素降解较少。Huang等[7]通过制备京尼平交联的碱性可溶性多糖-乳清蛋白复合物(G-AWC),以稳定的W/O/W乳状液对葡萄籽原花青素进行包埋和传递,增强了葡萄籽原花青素的稳定性和生物可及性。
大豆分离蛋白(soybean protein isolate,SPI) 作为大豆油工业加工过程中的副产品,因其含有丰富的氨基酸、营养价值高、功能特性理想和价格低廉而在食品工业中得到广泛应用[8]。SPI作为一种优质的植物蛋白资源,其应用与其营养特性和功能特性密切相关[9]。凝胶性是SPI的重要性能之一,依赖蛋白质分子聚集成三维网状结构,具有较高的黏度、可塑性和弹性[10]。但是SPI凝胶的形成具有需要高温变性、凝胶浓度高、凝胶强度低等缺点[11]。如果将蛋白质和多酚类物质混合使用,不仅可以展示每种食品分子成分的特性优势,而且可以克服使用单一食品分子基础材料时的缺点,如成本高和品质差;利用多酚的特点,与蛋白质结合形成多酚-蛋白质复合物,可以增强两者的功能和生物利用度。比如,将热改性的β-乳球蛋白(β-lactoglobulin,β-LG)与表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)结合,形成稳定的共组装纳米颗粒(Eβ-NPs)。Eβ-NPs抑制了人类恶性黑色素瘤细胞A375和人类食道癌细胞TE-1的增殖,其活性分别比EGCG高69.0%和63.7%[12]。现阶段,SPI成为构建蛋白和多酚复合凝胶的重要组分。Ao等[13]根据虚拟挑选和试验研究表征了大豆蛋白分离物与食品多酚的相互作用,发现氢键和疏水相参与大豆蛋白-多酚结合的主导相互作用。在Han等[14]的研究中,SPI的功能特性和儿茶素(catechin,C)的稳定性可以通过两者之间的共价相互作用得到改善。目前,关于OPC与SPI相互作用以改善凝胶和功能特性的研究较少。
因而,本研究以OPC和SPI复合体系为研究对象,探究了OPC的添加对SPI复合凝胶体系流变特性和抗氧化能力的影响。通过剪切速率扫描实验和频率扫描实验分析OPC对SPI凝胶流变性能的影响;通过体外自由基清除实验分析OPC对SPI凝胶抗氧化性的影响,以达到制备一种具有抗氧化性能的SPI凝胶制品的目的。
1 材料与方法
1.1 试验材料
SPI:山东国宏生物科技有限公司;葡萄糖酸内酯(国产分析纯);原花青素(葡萄籽提取物):山东金胜生物科技有限公司;乙醇(无水乙醇);盐酸(国产分析纯);香草醛(国产分析纯);1,1-二苯基-2-三硝基苯肼(DPPH)试剂:成都艾科达化学试剂有限公司;FeSO4溶液、H2O2:析标生物科技(福建省)有限公司;水杨酸(国产分析纯);2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)试剂:山东西亚化学有限公司;黄原胶:鄂尔多斯市中轩生化股份有限公司;6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox):合肥博美生物科技有限责任公司;过硫酸钾(K2S2O8 ):厦门海标科技有限公司。
1.2 试验仪器
JY92-ⅡN超声波细胞粉碎机 南京舜玛仪器设备有限公司;ZNCL-BS智能加热磁力搅拌器(140 mm×140 mm) 上海越众仪器设备有限公司;SB-2000 水浴锅 北京市长风仪器仪表公司;电子天平 上海舜宇恒平科学仪器有限公司;UV-2700 紫外可见分光光度计 上海美析仪器有限公司;DHR-1旋转流变仪 美国 TA公司。
1.3 试验方法
1.3.1 OPC-SPI分散液的制备
准确称取OPC 0.05,0.15,0.25 g和SPI 5 g,溶解于蒸馏水中,磁力搅拌均匀,并放置在4 ℃冰箱中充分水化。使SPI的最终浓度为10%,OPC分别设置不同浓度0.1%、0.3%、0.5%,以不添加OPC组为空白对照。
1.3.2 OPC-SPI复合凝胶的制备
参考刘冉等[15]的方法,将上述制备的OPC-SPI溶液在600 W功率下超声处理,单次超声工作时间4 s,工作间歇2 s,超声总工作时间持续10 min。超声完成后,撇除凝胶表面的气泡。加入葡萄糖酸内酯,使其浓度达到0.1%,用玻璃棒搅拌均匀后于室温下放置1~2 h后,封好保鲜膜放入冰箱中,24 h即可成胶。
1.3.3 OPC标准曲线的测定
参考梅瀚等[16]的实验方法,精确配制1 mg/mL的OPC标准品溶液,并稀释成0.1,0.2,0.3,0.4,0.5,0.6 mg/mL,取1 mL标准品溶液于试管中與5 mL香草醛-盐酸显色剂反应30 min,测定在500 nm最大吸收波长处的吸光度,根据其与浓度的关系得到标准曲线y=0.65x+0.413(R2=0.994 2)。
1.3.4 SPI凝胶包埋OPC的包埋率及荷载量的测定
用无水乙醇冲洗包埋OPC的SPI凝胶表面,将冲洗掉的液体稀释并定容至100 mL,取1 mL标准品溶液于试管中,与5 mL香草醛-盐酸显色剂反应30 min,测定在500 nm波长处的吸光度,将吸光度带入OPC标准曲线计算OPC浓度并根据公式(1)、(2)计算OPC的包埋率和荷载量。
包埋率(%)=(1-mM)×100%。(1)
荷载量(μg/mg)=M-mW。(2)
式中:m为洗脱液中OPC的含量,g;M为凝胶中OPC的总量,g;W为SPI的含量,g。
1.3.5 流变特性试验
将试样放置在直径为40 mm的流变仪平板上,并将平板间隔设定为1.0 mm。用刮板从平板上取下多余的试样,并在其表面涂硅油避免水分挥发。检测前,将试样均衡5 min,清除试样中增加的剩余应力,并保证温度稳定。流变性测试报告包含应变扫描、频率扫描、剪切速率扫描,所有样品测试3次,其中应变扫描是为了确定样品的线性黏弹区。
1.3.5.1 频率扫描试验
频率扫描主要参数:应变2%(线性黏弹性区域内),温度25 ℃,频率 0.1~10 Hz。精确测量弹性模量(elastic modulus,G′)、黏性模量(viscous modulus,G″)和损耗因子(tanδ)随频率变化的变化。G′、G″和角频率变化的趋势可以采用 Power-Law流变模型进行拟合[17]。
幂律方程:G′=K′·ωn′;G″=K″·ωn″。(3)
式中:K′和 K″表示幂律常数;n′和n″表示频率指数,可以用来表示模量对频率的依赖程度;ω表示角频率,rad/s。
1.3.5.2 剪切速率扫描试验
选用直径 40 mm 的平板夹具,温度设置为 25 ℃,应变设置为 0.2%,剪切速率测定范围设置为 0.1~100 s-1。测定在不同OPC浓度下样品黏度的变化情况。
1.3.6 DPPH自由基清除能力试验
配制0.2 mmol/L的DPPH 标准溶液:取3种不同浓度的OPC-SPI 复合凝胶和SPI 凝胶各 0.2 g,分别取3次,即每种浓度做3组平行对照,向各样品中分别加入 5 mL 0.2 mmol/L 的 DPPH 溶液,避光处理 30 min 后测定在517 nm波长处的吸光度。再取3种不同浓度的OPC溶液(稀释5 倍)各0.2 mL,分别取3次,即每种浓度做3组平行对照,向各样品中分别加入 5 mL 0.2 mmol/L的DPPH 溶液,避光处理30 min 后测定在 517 nm波长处的吸光度。将Trolox 配成 1,2,4,6,8,10 mmol/L的浓度,取0.2 g加入 5 mL 0.2 mmol/L的DPPH溶液,30 min后在517 nm波长处测定其吸光度。
1.3.7 ABTS自由基清除能力试验
配制0.2 mmol/L的ABTS储备液:取3种不同浓度的OPC-SPI复合凝胶和SPI凝胶各0.03 g,分别取3次,即每种浓度做3组平行对照,向各样品中加入 5 mL ABTS储备液,测定在734 nm 波长处的吸光度。再取3种不同浓度的OPC-SPI分散液(稀释5 倍)和SPI 溶液各0.03 mL,分别取3次,即每种浓度做3组平行对照,向试管中分别加入 5 mL 0.2 mmol/L 的ABTS 溶液,测定在 734 nm 波长处的吸光度。将Trolox 配成 1,2,4,6,8,10 mmol/L的浓度,取0.1 g加入ABTS溶液,6 min后在734 nm波长处测定其吸光度。
1.3.8 羟自由基清除能力试验
参考颜军等[18]的方法,取3种不同浓度的OPC-SPI复合凝胶和SPI凝胶各0.03 g,分别取3次,即每种浓度做3组平行对照,向各样品中加入1.8 mmol/mL FeSO4溶液2 mL,18 mmol/mL水杨酸-乙醇溶液1.5 mL,最后加入H2O2(0.03%) 0.1 mL启动反应,37 ℃保温5 min, 测定510 nm 波长处的吸光度。再取3种不同浓度的OPC-SPI 分散液(稀释5 倍)和SPI 溶液各0.03 mL,分别取3次,即每种浓度做3组平行对照;将Trolox 配成 1,2,4,6,8,10 mmol/L 的浓度,测定方法同上。
1.4 数据处理
全部试验反复 3 次,结果以平均值±标准偏差表示,利用OriginPro 2021软件作图和Minitab 17.0 软件进行单因素方差分析(ANOVA)。
2 结果与分析
2.1 大豆分离蛋白对原花青素的包埋率及荷载量
由表1可知,SPI凝胶对OPC的包埋率高达92.87%,具有很好的包埋效果,随着OPC浓度的增大,OPC在凝胶中的荷载量虽然增加,但包埋率下降。OPC在凝胶中一部分以游离的状态包埋在凝胶的网络结构中;一部分OPC与SPI通过非共价作用(疏水作用和离子键)进行结合转变成OPC-SPI复合物的形态。
2.2 原花青素对大豆分离蛋白凝胶黏弹性的影响
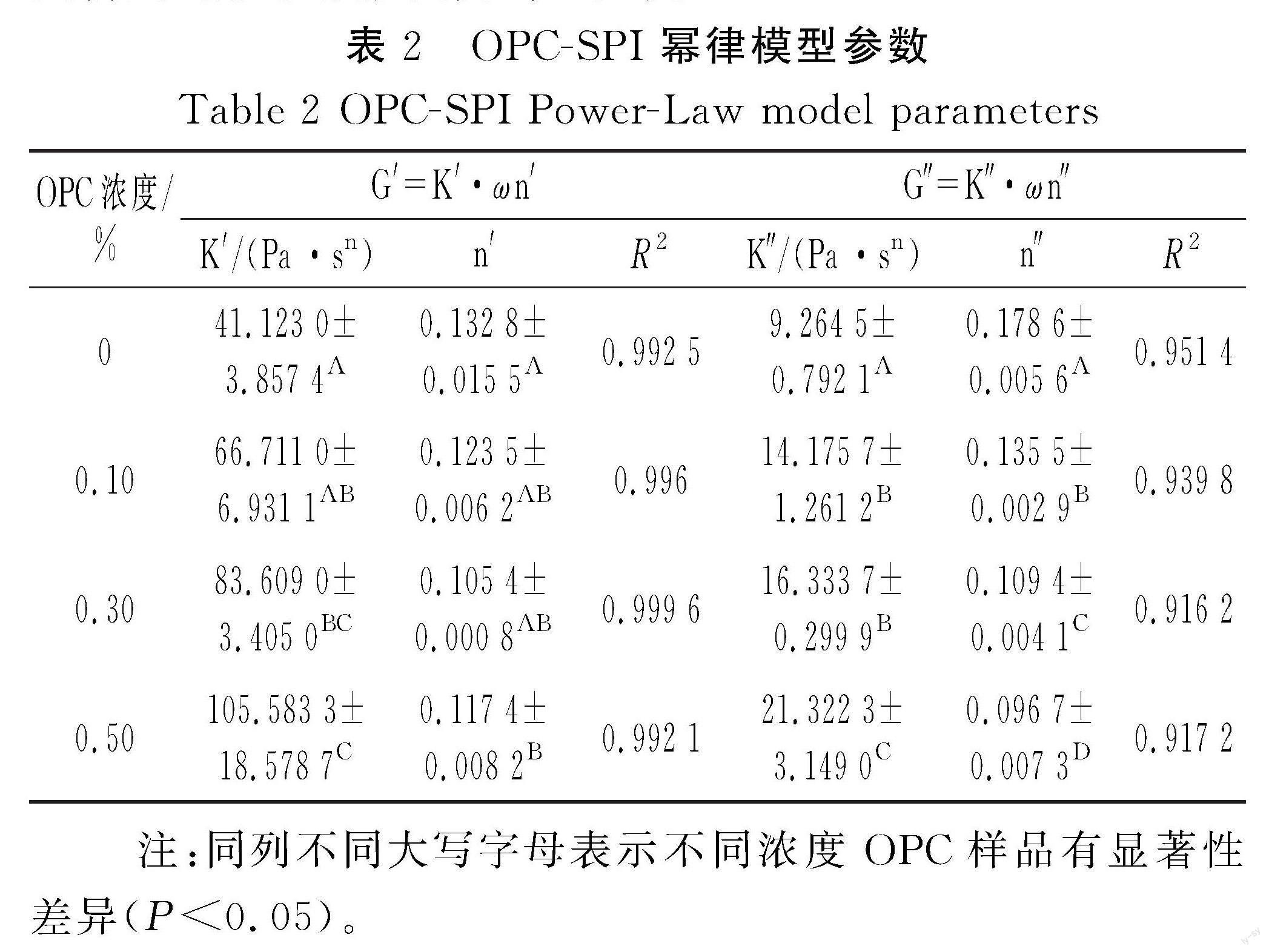
SPI凝胶是典型的生物大分子蛋白凝胶,利用流变仪可以对其凝胶弹性进行检测。弹性模量(elastic modulus,G′)和黏性模量(viscous modulus,G″)是表征流变性能的两个重要指标,G′是体现物质弹性特征的物理量,G″是体现物质黏性特征的物理量[19];G″/G′称为损耗因子,用tanδ表示,tanδ越大,凝胶的流动性越强;tanδ越小,凝胶的固体性能越强[20]。频率扫描可以反映凝胶的黏弹性。由图1可知,SPI和OPC-SPI的G′均大于G″,表明SPI和OPC-SPI都表现出弹性模量大于黏性模量的流变学特征。且随着OPC浓度的增大,模量(G′和G″)增大,tanδ减小,说明OPC提高了SPI的黏弹性。对频率扫描结果通过幂律函数模型进行拟合,见表2。G′和G″作为频率的函数均服从幂律模型,K为稠度系数,随着OPC浓度的增大,K′和K″均增大,说明OPC改善了SPI凝胶的黏弹性;n反映凝胶的频率依赖性,n′和n″均减小,表明OPC的加入降低了SPI凝胶的频率依赖性;n′和n″均小于1,证实了SPI和OPC-SPI为非牛顿假塑性流体。
Zhou等[20]利用茶多酚修饰的鸡蛋清在改善鱼糜凝胶的实验中发现G′总是高于G″,TP的加入使EW的G′和G″不断提高并且降低了tanδ的值,表明了凝胶网络的典型黏弹性固体样行为,TP的加入形成了更强的凝胶,这与本研究的结果一致,OPC通过相互作用促进了SPI蛋白的相互聚集,从而提高了黏弹性。李立敏等[21]研究表明,添加适量的茶多酚能显著改善羊肉肌原纤维蛋白的凝胶性能,凝胶的微观结构致密、间隙小、形状规则、分布均匀。
2.3 原花青素对大豆分离蛋白凝胶黏度的影响
由图2可知,对不同剪切速率下SPI和各浓度OPC-SPI复合凝胶的黏度进行扫描,随着剪切速率的增大,SPI和OPC-SPI均表现出剪切变稀的现象,即随着剪切速率的增大,SPI和OPC-SPI复合凝胶的黏度减小,呈现出典型的非牛顿流体的特征。Feng等[22]通过自由基接枝方法合成了卵清蛋白与(+)-儿茶素、(-)-表没食子素或(-)-表没食子儿茶素没食子酸酯的共轭物,发现与OVA乳化物相比,用共轭物包覆的鱼油乳液表现出的黏度更低,在测试的剪切率范围内,所有乳剂都表现出顯著的剪切稀化行为,这与本文的研究结论相似,但是本研究发现不同浓度的复合凝胶与SPI之间数值差距较小,说明在测试浓度范围内OPC对黏度的影响较小。
2.4 原花青素-大豆分离蛋白复合凝胶抗氧化能力
由图3可知,与SPI凝胶相比,OPC-SPI凝胶的 DPPH自由基清除能力显著提高。SPI凝胶的DPPH自由基清除能力为0.082 9,而0.1% OPC-SPI、0.3% OPC-SPI、0.5% OPC-SPI的DPPH自由基清除能力依次为0.420 1,0.640 6,0.823 3。但将相同浓度的OPC-SPI与游离的OPC相比,DPPH自由基清除能力显著下降。
由图4可知,与SPI凝胶相比,OPC-SPI凝胶的 ABTS自由基清除能力显著提高。SPI凝胶的ABTS自由基清除能力为0.014 8,而0.1% OPC-SPI、0.3% OPC-SPI、0.5% OPC-SPI的ABTS自由基清除能力依次为0.161 8,0.272 8,0.579 6。与游离的OPC相比, ABTS自由基清除能力显著下降。
羟自由基是一种非常活泼的活性氧自由基,羟自由基减少,可以防止动脉硬化,减少糖尿病的发生率,还可以起到抗衰老的作用。当体系内抗氧化剂存在时,会与水杨酸存在竞争关系,进而影响反应物的吸光度。由图5可知,与SPI凝胶相比,OPC-SPI凝胶的羟自由基清除能力显著提高。SPI凝胶的羟自由基清除能力为0.152 1,而0.1% OPC-SPI、0.3% OPC-SPI、0.5% OPC-SPI的羟自由基清除能力依次为0.222 2,0.378 3,0.592 1。与游离的OPC相比,羟自由基清除能力显著下降。
因此可以看出OPC-SPI凝胶的抗氧化活性显著优于SPI凝胶,随着OPC浓度的增大,抗氧化活性逐渐增强,这是由OPC增加引起的。OPC-SPI凝胶与游离的OPC相比,抗氧化活性减弱的原因可能是由两方面引起的:一方面,OPC被包裹在SPI凝胶网状结构内部使得OPC无法释放;另一方面,OPC和SPI之间的相互作用使SPI对自由基的清除具有一定的遮蔽作用。Medina等[23]在研究天然酚类化合物对含铁脂质和水包油乳液中乳铁蛋白抗氧化和促氧化活性的影响时发现EGCG等茶多酚与乳铁蛋白的相互作用可使游离的EGCG在反应系统中的含量下降,从而使其抗氧化能力下降,此研究也证明了这一观点。
3 结论
天然来源的抗氧化剂在食品工业中很受欢迎,其可以抑制氧化降解反应;OPC 是一类具有抗氧化活性的多酚类化合物,广泛应用于食品、药品等行业。本研究通过葡萄糖酸内酯诱导,在 SPI 中添加 OPC,研究其对 SPI 的流变性及抗氧化性的影响。结果表明,OPC-SPI 复合凝胶是一种存在剪切导致变稀特性的非牛顿流体。OPC可以提高 SPI 的黏弹性,降低G′和G″的频率依赖性。通过DPPH、ABTS、羟自由基清除试验评价OPC-SPI的抗氧化活性,随着OPC浓度的增大,OPC-SPI的自由基清除能力增强,说明OPC的加入提高了 SPI 的抗氧化能力。多酚和蛋白质均是食物中两种既具有良好结构功能又具有营养功能的物质。因此,两者是建造具有预期甚至独特纹理的食物凝胶的良好起始材料。本研究结果有助于开发更优质或独特的多酚和蛋白质复合凝胶产品。未来,需要进一步研究OPC和SPI的相互作用,开展深层次三元复合凝胶的相关研究,以期使其成为食品中更好的功能成分。
參考文献:
[1]ZHANG X,SONG X,HU X,et al. Health benefits of proanthocyanidins linking with gastrointestinal modulation: an updated review[J].Food Chemistry,2023,404:134596.
[2]SARKAR P, THIRUMURUGAN K. Modulatory functions of bioactive fruits,vegetables and spices in adipogenesis and angiogenesis[J].Journal of Functional Foods,2019,53:318-336.
[3]TIE S S, SU W T, CHEN Y N, et al. Dual targeting procyanidin nanoparticles with glutathione response for colitis treatment[J].Chemical Engineering Journal,2022,441:136095.
[4]QI Q, CHU M, YU X, et al. Anthocyanins and proanthocyanidins: chemical structures,food sources,bioactivities,and product development[J].Food Reviews International,2023,39(7):4581-4609.
[5]SUN X, WU X, CHEN X, et al. Casein-maltodextrin Maillard conjugates encapsulation enhances the antioxidative potential of proanthocyanidins: an in vitro and in vivo evaluation[J].Food Chemistry,2021,346:128952.
[6]SHENG K, ZHANG G, KONG X, et al. Encapsulation and characterisation of grape seed proanthocyanidin extract using sodium alginate and different cellulose derivatives[J].International Journal of Food Science & Technology,2021,56(12):6420-6430.
[7]HUANG Y, LIN J, TANG X, et al. Grape seed proanthocyanidin-loaded gel-like W/O/W emulsion stabilized by genipin-crosslinked alkaline soluble polysaccharides-whey protein isolate conjugates: fabrication, stability, and in vitro digestion[J].International Journal of Biological Macromolecules,2021,186:759-769.
[8]GUO J, HE Z, WU S, et al. Binding of aroma compounds with soy protein isolate in aqueous model: effect of preheat treatment of soy protein isolate[J].Food Chemistry,2019,290:16-23.
[9]WANG Z, ZENG L, FU L, et al. Effect of ionic strength on heat-induced gelation behavior of soy protein isolates with ultrasound treatment[J].Molecules,2022,27(23):8221.
[10]SU Y, DONG Y, NIU F, et al. Study on the gel properties and secondary structure of soybean protein isolate/egg white composite gels[J].European Food Research and Technology,2014,240(2):367-378.
[11]XIAO Y, LI J, LIU Y, et al.Gel properties and formation mechanism of soy protein isolate gels improved by wheat bran cellulose[J].Food Chemistry,2020,324:126876.
[12]WU M, JIN J, JIN P, et al.Epigallocatechin gallate-β-lactoglobulin nanoparticles improve the antitumor activity of EGCG for inducing cancer cell apoptosis[J].Journal of Functional Foods,2017,39:257-263.
[13]AO L, LIU P, WU A, et al. Characterization of soybean protein isolate-food polyphenol interaction via virtual screening and experimental studies[J].Foods,2021,10(11):2813.
[14]HAN L, PENG X, CHENG Y, et al. Effects of catechin types found in tea polyphenols on the structural and functional properties of soybean protein isolate-catechin covalent complexes[J].LWT-Food Science and Technology,2023,173:114336.
[15]劉冉,曾庆华,王振宇,等.超声波处理对大豆分离蛋白凝胶流变性和凝胶形成的影响[J].食品工业科技,2020,41(21):87-92.
[16]梅瀚,曹金凤,刘世巍,等.超声辅助提取葡萄籽中原花青素工艺及抗氧化活性研究[J].广东化工,2023,50(5):38-41.
[17]ZHAO H, CHEN J, HEMAR Y, et al. Improvement of the rheological and textural properties of calcium sulfate-induced soy protein isolate gels by the incorporation of different polysaccharides[J].Food Chemistry,2020,310:125983.
[18]颜军,苟小军,邹全付,等.分光光度法测定Fenton反应产生的羟基自由基[J].成都大学学报(自然科学版),2009,28(2):91-93,103.
[19]HU Y, LIANG H, XU W, et al. Synergistic effects of small amounts of konjac glucomannan on functional properties of egg white protein[J].Food Hydrocolloids,2016,52:213-220.
[20]ZHOU X, CHEN T, LIN H, et al. Physicochemical properties and microstructure of surimi treated with egg white modified by tea polyphenols[J].Food Hydrocolloids,2019,90:82-89.
[21]李立敏,杨豫菘,成立新,等.茶多酚对羊肉肌原纤维蛋白凝胶特性的影响[J].肉类研究,2020,34(3):8-13.
[22]FENG J, CAI H, WANG H, et al. Improved oxidative stability of fish oil emulsion by grafted ovalbumin-catechin conjugates[J].Food Chemistry,2018,241:60-69.
[23]MEDINA I, TOMBO I, SATUE-GRACIA M T, et al. Effects of natural phenolic compounds on the antioxidant activity of lactoferrin in liposomes and oil-in-water emulsions[J].Journal of Agricultural and Food Chemistry,2002,50(8):2392-2399.

