ATP1B3 在神经胶质瘤中表达及其对细胞增殖和迁移的影响
严其康,扈清云,孙 权,王彩霞,朱金玲
(1.佳木斯大学基础医学院,黑龙江 佳木斯 154007;2.佳木斯大学第一附属医院, 黑龙江 佳木斯 154007)
神经胶质瘤是起源于神经胶质细胞的中枢神经系统肿瘤,是颅内肿瘤中最常见和最致命的类型,生长迅速,具有极强的侵袭性,病人预后差。神经胶质瘤的基础研究和对其治疗手段的探索一直是国内外学者研究的热点和难点问题。Na/K-ATP酶 由 催 化 亚 基α(100~112 kDa),调 节β(45~55 kDa)亚基和γ(FXYD2)(6.5~10 kDa)亚基组成[1]。已经鉴定出β 亚基的3 种不同的同种型:β1(ATP1B1基因),β2(ATP1B2基因)和β3(ATP1B3基因)[2]。3 种β 亚基在细胞中的分布具有组织特异性。已有文献说明,Na/K-ATP 酶β 亚基参与调节细胞粘附功能,特别是在癌症进展期间[3-6]。实验室前期发现CASPR1-ATP1B3 蛋白相互作用影响脑微血管内皮细胞Na/K-ATP 酶的质膜定位,但在胶质瘤细胞中研究极少[7]。 并且有研究表明,ATP1B3基因在胃癌、肝癌中存在高表达,影响其发生发展,而在胶质瘤中未见研究,因此本研究选Na/K-ATP 酶的核心蛋白ATP1B3 作为靶分子研究其在不同组织级别的胶质瘤细胞中的表达水平,探讨ATP1B3基因表达对胶质瘤患者总体生存率的影响及对胶质瘤细胞的增殖、迁移的影响。为寻找神经肿瘤细胞标志物和治疗的分子靶点提供试验和理论依据。
1 材料与方法
1.1 试剂及材料来源
人胶质母细胞瘤(U87MG)及MEM 培养基购自上海酶研生物科技有限公司,胎牛血清购自美国Gibco 公司,胰蛋白酶、青-链霉素溶液、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)、逆转录试剂盒、DAB 显色液均购自上海碧云天生物技术有限公司,荧光定量PCR 试剂盒购自中国Takara 公司,单克隆ATP1B3 抗体(67554-1-lg)及GAPDH 抗体(60004-1-lg)购自中国proteintech 公司,干扰RNA 购自中国吉玛基因公司。2 级、3 级、4 级胶质瘤组织切片来自于佳木斯大学第一附属医院。1 级通常为低级-例如毛细胞星形细胞瘤;2 级为低度恶性肿瘤,如星形胶质瘤或少突胶质细胞瘤浸润;3 级包括间变性星形细胞瘤,间变性室管膜瘤,间变性少突胶质细胞瘤和间变性少星形胶质瘤;4 级通常为胶质母细胞瘤(Glioblastoma multiforme,GBM) 具有内皮细胞增殖或肿瘤坏死。
1.2 方法
1.2.1 在线数据库分析ATP1B3在胶质瘤中的表达,及其与患者生存预后的关系 下载TCGA(https://portal.gdc.cancer.gov)数据库中胶质瘤患者的转录组基因表达数据集、临床数据集并进行整理。然后使用CGGA(http://www.cgga.org.cn/)数据库在线分析ATP1B3在不同级别胶质瘤组织中的表达,进入官网,首页选择“Analyze”;点击mRNA data;在 Distribution 处“gene”框 输 入“ATP1B3”;点击submit。对TCGA 数据库下载的数据进行处理,通过ATP1B3表达水平中位值将胶质瘤患者分为两组,分别为高表达ATP1B3组和低表达ATP1B3组。采用R 包"survival" "survminer"分析ATP1B3基因表达水平与胶质瘤患者生存率的关系,包括患者总生存期(overall Survival, OS),无进展生存期(progression-free survival, PFS), ROC(receiver operating characteristic curve, ROC)生存分析。比较分析ATP1B3表达水平与癌症患者临床特征的相关性,包括分级、年龄和性别等。
1.2.2 免疫组化染色验证ATP1B3在胶质瘤组织切片中的表达 对2 级、3 级、4 级胶质瘤组织进行IHC 染色。常规石蜡切片后60 ℃烤片15 min,进行二甲苯脱蜡与梯度酒精脱水,PBS 缓冲液冲洗,pH值8.0~8.5 的EDTA 抗原修复液100 ℃抗原修复,PBS 缓冲液冲洗,37 ℃过氧化氢甲醇消化内源性过氧化物酶10 min,PBS 缓冲液冲洗,加入5%BSA 封闭液封闭。滴加ATP1B3 抗体(1∶300)4 ℃冰箱内孵育过夜,PBS 缓冲液冲洗,羊抗鼠IgG 聚合物滴定及DAB 显色,苏木素染液衬染,梯度酒精脱水、二甲苯透明、中性树胶封片后在显微镜下观察。
1.2.3 体外细胞培养 将在MEM 完全培养基(10%胎牛血清和1%双抗)中的U87MG 细胞,放入6 孔板中培养,6 孔板置于5%CO2的恒温37 ℃的培养箱中培养细胞。
1.2.4 细胞转染 干扰RNA 序列由吉玛基因公司设计,ATP1B3-Homo-336 序列为,S: CAUUCACGAUGUGGGUUAUTT AS: AUAACCCACAUCGUGAAUGTT;ATP1B3-Homo-530 序列为S:GAAGAACAGAAGAACCUCATT AS:UGAGGUUCUUCUGUUCUUCTT ;ATP1B3- Homo -976 序 列 为 S:GGGACGAGUUAUGUUCAAA TT AS:UUUGAACAUAACUCGUCCCTT;阴性对 照siRNA 序 列 为S:UUCUCCGAACGUGUCACGUTT AS:ACGUGACACGUUCGGAGAATT;将培养细胞分为5 组,即空白对照组、阴性对照组(SI-NC)、si-ATP1B3-336 组、si-ATP1B3-530组、si-ATP1B3-976 组,当6 孔板中细胞密度达到30%~50%时,配制转染体系,加入125 μL OPTIMEM、100pmol si-RNA(阴性对照组加入阴性对照siRNA、si-ATP1B3-336 组 加 入ATP1B3-Homo-336、si-ATP1B3-530 组加入ATP1B3-Homo-530、si-ATP1B3-976 组加入ATP1B3-Homo-976)、4 μL Lipo-8000,混匀,室温下静置20 min。混合后的体系以点滴的方式将转染复合物加入含有U87MG 细胞的6 孔板中,轻轻摇匀后放入细胞培养箱中培养24 h后以备用于RT-PCR 检测,转染细胞培养48 h 后以备Western blot 检测。筛选敲减效率高的siRNA 以被后续实验。
1.2.5 荧光定量PCR 检测转染后细胞ATP1B3基因的mRNA 表达水平 用RNA 抽提试剂盒提取转染后U87MG细胞中总mRNA,分光光度计测定RNA的浓度和纯度,反转录为cDNA,采用实时荧光定量PCR 试 剂 盒 进 行RT-PCR 扩 增,ATP1B3-S:ACGATGTGGGTTATGCTTCAGACTC;ATP1B3-AS:CCTGCATACGAAGTTGGATCAGACC;内参GAPDH 序列为S:UGACCUCAACUACAUGGUUTT;AS:AACCAUGUAGUUGAGGUCATT。7300 检测结果,采用2-ΔΔCt法计算各组细胞ATP1B3基因mRNA 的相对表达量(内参为GAPDH)。
1.2.6 Western blotting 检测转染后ATP1B3 蛋白及相关通路蛋白MTOR、P-MTOR 表达量 收集转染后U87MG 细胞,蛋白裂解液提取总蛋白,通过BCA 法测定提取蛋白质的浓度。取50 μg 蛋白进行SDS-PAGE(12%)电泳分离,湿转法将蛋白转移到PVDF 膜上,5%脱脂牛奶37 ℃封闭1 h,将膜置于相应的ATP1B3鼠单克隆抗体(1∶1 500)、GAPDH 鼠 单 克 隆 抗 体(1∶10 000)中4 ℃过 夜,MTOR、P-MTOR(1∶1 500),TBS-T 洗去未结合的一抗,洗涤3 次,每次10 min。再用辣根过氧化物酶标记的山羊抗小鼠IgG 37 ℃孵育1 h。TBS-T洗去未结合的二抗,洗涤3 次,每次10 min。利用全自动化学发光/荧光图像分析系统观察结果,ImageJ 进行分析。
1.2.7 CCK-8 法检测细胞增殖 收集对照组及si-ATP1B3-336 组细胞接种于96 孔板(3×103个/孔),每组5 个复孔,每孔加入10 μL CCK-8 溶液(按试剂说明书操作),于培养箱内培养1 h,使用酶标仪检测450 nm 波长处的光密度值(OD 值)。在0、24、48 和72 h 连续记录各个孔的数值。细胞增殖越多越快,则颜色越深,OD 值越大。
1.2.8 Transwell 检测细胞迁移能力 收集对照组、si-ATP1B3-336 组细胞加入0.25%胰蛋白酶消化,加入不含血清的MEM 培养液制备单细胞悬液(5×104个/mL),取200 μL 细胞悬液接种于transwell 上室,下室加入600 μL 含有10%胎牛血清的培养液,将小室放入培养箱内培养24 h 后,4%多聚甲醛固定20 min,0.1%结晶紫染液染色10 min,倒置显微镜下观察记录细胞迁移结果。
1.3 统计学处理
TCGA 数据库下载的数据检验结果均通过R4.2.2 程序计算所得,CGGA 数据库在线分析结果有网站内部程序自动生成。实验检测结果采用GraphPad Prism9 软件进行统计学分析,组间比较采用单因素方差分析,P<0.05 为差异具有统计学意义。
2 结果
2.1 在线数据获取和分析结果
从TCGA 数据中获得神经胶质瘤样本共704个,并对ATP1B3高、低表达两组进行独立性检验。CGGA 数据库分析胶质瘤患者癌组织中ATP1B3mRNA 的表达水平,随着胶质瘤级别(2,3,4 级)的升高,ATP1B3的表达水平显著升高,(P<0.001)(图1A)。通过R 软件进行分层分析,结果显示:ATP1B3在胶质瘤患者中的表达水平与年龄和病理分级有关,差异有显著性(P<0.001)(图2A、C),ATP1B3表达水平与性别无关(P>0.05)(图2B)。使用R 语言包计算ATP1B3表达水平对胶质瘤患者总体生存率的影响,绘制生存曲线图,ATP1B3低表达组生存率明显高于ATP1B3高表达组(P<0.001)(图3)。

图1 ATP1B3 在不同级别胶质瘤中的表达Fig 1 ATP1B3 expression in different grades of gliomas

图2 ATP1B3 表达水平与临床特征相关分析Fig 2 Correlation analysis between ATP1B3 expression level and clinical characteristics
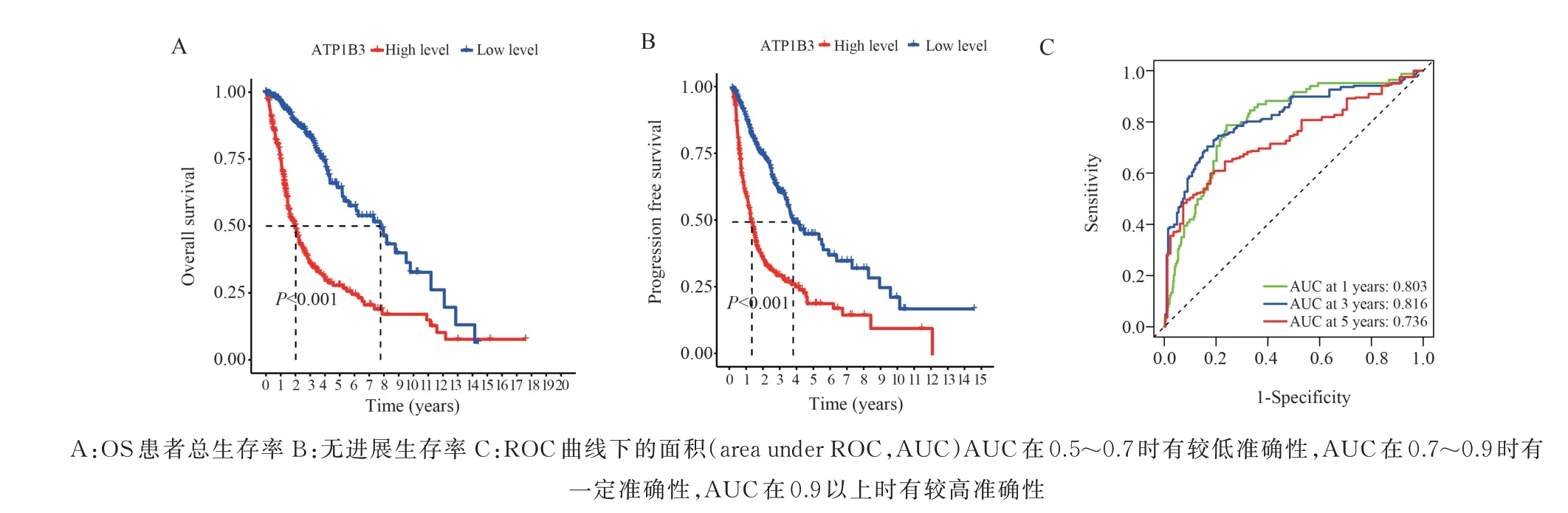
图3 ATP1B3 表达水平与患者生存率Fig 3 ATP1B3 expression level and patient survival rate
2.2 免疫组化检测ATP1B3 在胶质瘤组织切片中的表达结果
免疫组化结果显示,2、3、4 级别胶质瘤组织切片分别呈现淡黄色、黄褐色、棕色,印证了数据库分析结果(图1B)。染色强度评分具体为-(无染色),+(弱染色为淡黄色),++(中等染色为黄褐色),+++(强染色为棕色)。
2.3 SI-ATP1B3-336 干扰效果明显
敲减ATP1B3基因表达,RT-qPCR 检测结果显示,相较于对照组,SI-ATP1B3-336 组mRNA 水平显著降低(F=17.45,P<0.01)(图4A),western blot实验结果进一步证明si-ATP1B3-336 组中ATP1B3的敲减效果(F=30.84,P<0.000 1)(图4B),因此将该干扰序列用于后续研究。
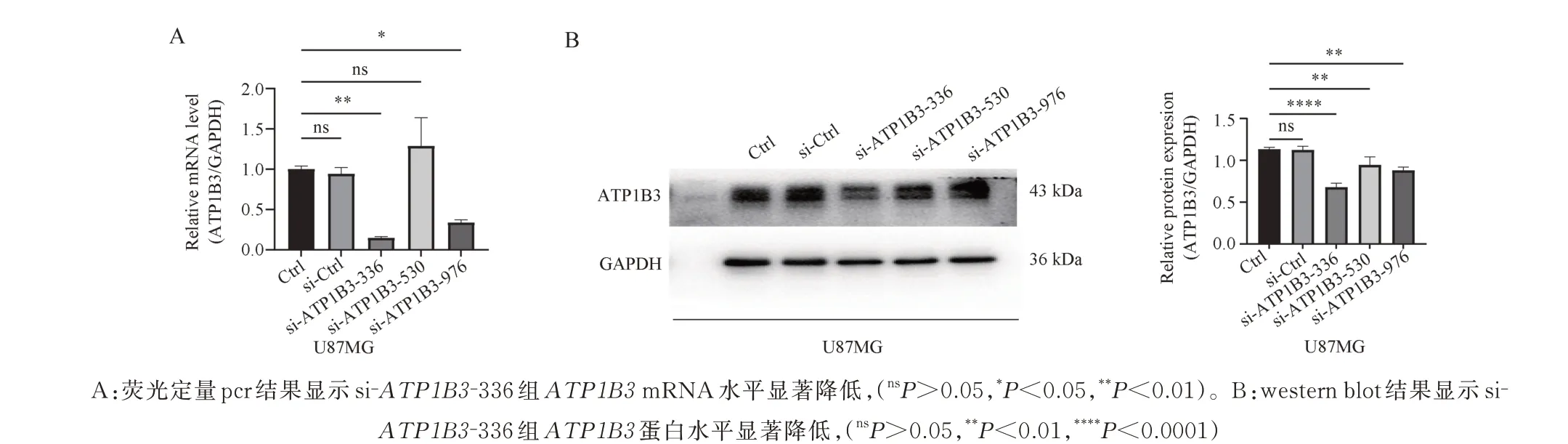
图4 干扰RNA( si-RNA)筛选Fig 4 Interfering RNA (Si-RNA) screening
2.4 敲减ATP1B3 对胶质瘤细胞增殖、迁移的影响
Transwell 迁移实验结果表明,si-ATP1B3-336组迁移细胞数明显减少(t=6.254,P<0.01)细胞迁移能力减弱(图5A)。CCK8 实验结果表明,si-ATP1B3-336 组细胞的增殖能力显著低于对照组(t=9.812,P<0.001)(图5B)。
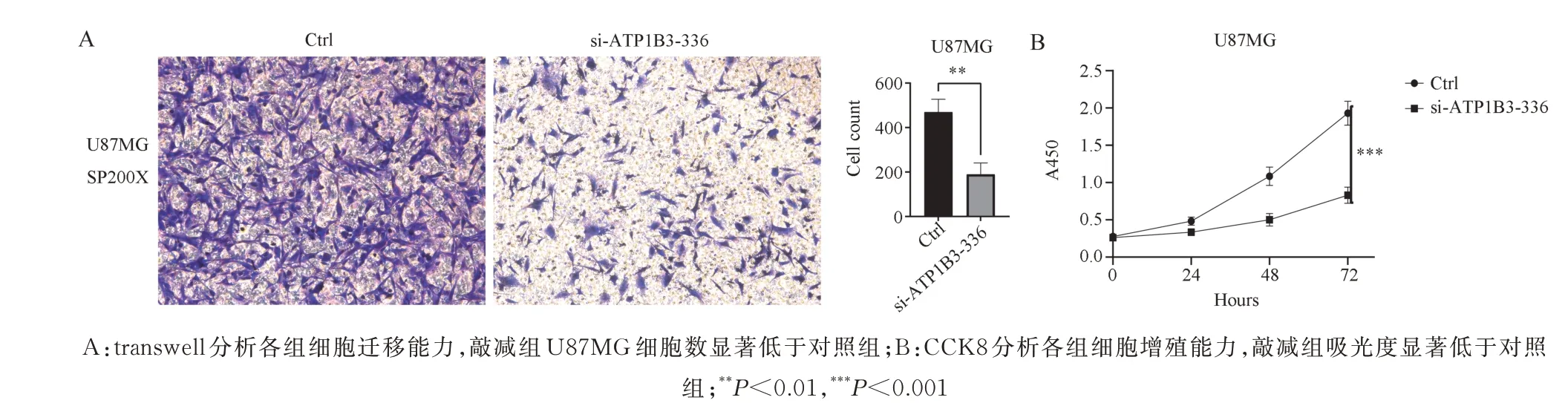
图5 敲减ATP1B3 后 U87MG 细胞增殖、迁移能力Fig 5 Proliferation and migration ability of U87MG cells after knockdown of ATP1B3
2.5 敲减ATP1B3 对MTOR 信号通路蛋白的影响
与对照组相比敲减ATP1B3后,P-MTOR 蛋白表达量显著下降(t=3.909,P<0.05),P-MTOR/MTOR 比值显著降低(t=3.132,P<0.05)(图6),表明ATP1B3可能通过影响细胞生长信号通路从而影响胶质瘤细胞的增殖和迁移。
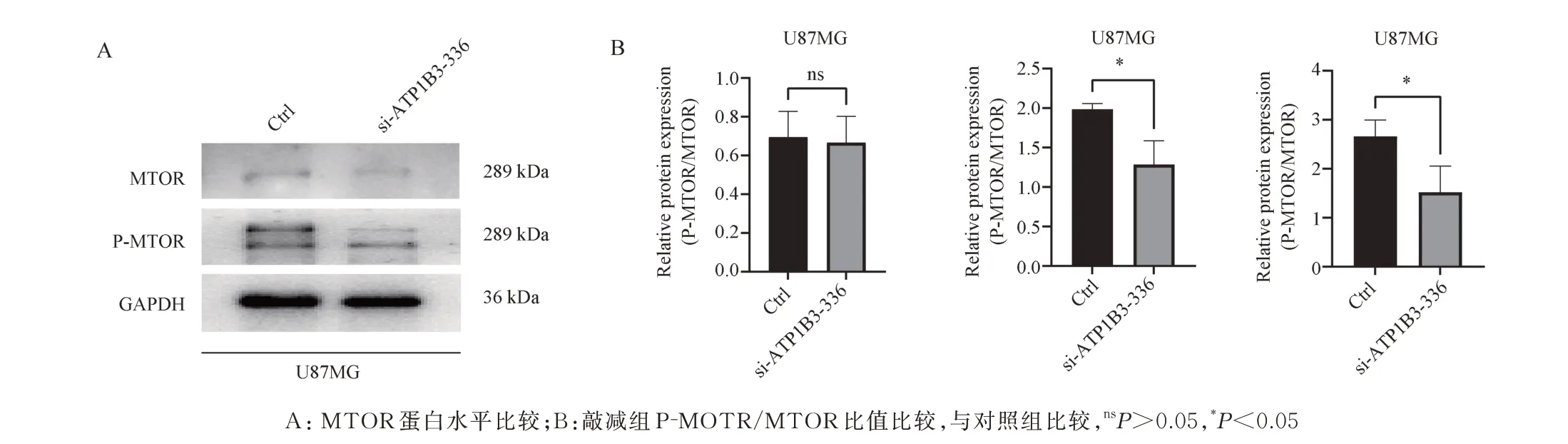
图6 MTOR、P-MTOR 蛋白表达水平Fig 6 MTOR,P-MTOR protein expression levels
3 讨 论
2021 年出版了第五版中枢神经系统肿瘤分类(WHO-CNS5)。WHO-CNS5 将基因、分子及信号通路改变等特征纳入分类系统,并结合病理组织学特征、免疫组化等方法进行整合和分层诊断[8,9]。根据脑胶质细胞瘤的组织结构和细胞特征,在显微镜下观察术中或术后胶质瘤的病理分级。不同级别的胶质瘤治疗方式有所不同,预后和生存情况也大不同。对于低级别胶质瘤采用的是手术为主的治疗。对于高级别胶质瘤,无论术后是否达到了全切都必须进行放疗、化疗等后续的辅助治疗。多形性恶性胶质瘤恶性程度高,GBM 最明显的特征之一就是细胞增殖失控[10],研究发现GBM 呈现表观遗传学和遗传不同亚群的多态性特点,会导致其发生和发展具有不同的机制,并导致治疗的失败[11]。目前越来越多的证据表明,在不同或同一细胞类型中,相同的配体可能有不同的受体,进而诱导不同的反应[12]。动物细胞中质膜的嵌入蛋白,又称Na-K泵,通过水解ATP 转运细胞内外的钠钾离子,维持细胞的电化学梯度[13],并维持离子浓度的平衡。研究表明Na/K-ATP 酶是一种信号转导和转录激活因子[14-17],影响细胞增殖[18],参与细胞运动[19]和细胞凋亡[20]。最近的综述描述了Na/K-ATP 酶参与细胞增殖和肥大,细胞凋亡,细胞粘附,细胞迁移,信号转导通路和钠泵结合药物的相关分子基础[21]。
最近有研究指出胶质瘤在侵入脑实质时,利用离子通道和转运蛋白体维持它们的单一生长和侵袭[22,23],其中包括Na/K-ATP 酶,但其具体机制不详。Li 等[24]研究表明,ATP1B3在胃癌细胞系中的mRNA 和蛋白质水平均升高,并通过PI3K/AKT 信号通路调节胃癌细胞的进展,敲减ATP1B3显著抑制了人胃癌细胞的细胞增殖、集落形成能力、迁移和侵袭能力以及增加细胞凋亡。Lu 等[25]研究发现,ATP1B3在肝癌组织中高表达,敲减ATP1B3抑制肝癌细胞增殖和迁移,促进肝癌细胞凋亡和上皮向间充质转化。
本研究结果显示敲减U87MG 细胞中的ATP1B3后,胶质瘤细胞的增殖、迁移能力显著下降。ATP1B3表达水平随着胶质瘤恶性程度的升高而升高,ATP1B3高表达不利于患者的生存、预后,下调ATP1B3减少了P-MTOR 的表达,推测其可能是通过影响MTOR 信号通路从而影响U87MG 细胞增殖、迁移。综上所述,ATP1B3可能作为神经胶质瘤治疗的潜在靶点,但关于其具体作用机制仍需进一步探究。
作者贡献度说明:
严其康:课题的构思与实验,撰写文章;扈清云、孙权、王彩霞: 实验数据整理,分析;朱金玲:论文指导与修改,经费支持。
所有作者声明不存在利益冲突关系。

