肝细胞癌干性分型及其预后基因GSDMC 的研究
包 凌,龚旋坤,庞 青,陈 晓
(1.蚌埠医学院第一附属医院老年科,安徽 蚌埠 233000;2.蚌埠医学院第一附属医院肝胆外科,安徽 蚌埠 233000)
肝 细 胞 性 肝 癌(hepatocellular carcinoma,HCC),是一种严重危害人类健康的常见恶性肿瘤。肝细胞癌的相对 5 年生存率约为 18%[1]。目前已知肝细胞癌的危险因素有慢性乙型肝炎病毒和丙型肝炎病毒感染、黄曲霉素、酗酒、非酒精性脂肪性肝炎和各种代谢性疾病[2]。不幸的是,由于肿瘤异质性和动态微环境,患者对抗癌治疗反应较差[3-5]。
最近的证据表明,肿瘤异质性是由具有干细胞或干细胞特征的细胞亚群驱动的,称为癌症干细胞(cancer stem cells, CSCs)[6,7]。癌 症 干 细 胞 也 称 为肿瘤起始细胞,具有通过自动修复进行自我更新的能力。肝细胞与干细胞具有相似的特征,如在特定条件下自我更新和无限增殖[8-10]。重要的是,癌症干细胞在肝细胞癌生长,复发和耐药性中起着至关重要的作用[11]。此外,广泛的研究表明,肿瘤微环境(tumor microenvironment, TME)在促进癌细胞的侵袭性和干性方面具有重要作用[12-14]。肿瘤微环境是指肿瘤细胞存在的周围微环境,包括周围的血管、免疫细胞、成纤维细胞、骨髓源性炎性细胞、各种信号分子和细胞外基质。CSCs 可以通过TME调节关键信号通路来诱导非CSC 转化为CSC,这一过程进一步导致肝癌患者预后不良[15]。此外,CSC的内在信号可以重塑TME,导致血管生成,胶原蛋白重塑和PD-1 / PD-L1 介导的免疫逃逸[16]。因此,全面了解高度异质的CSC 及其与TME 的动态相互作用对于探索CSC 靶向治疗策略和提高当前免疫疗法的有效性至关重要。
在这项研究中,利用ssGSEA 算法和26 个公共干性基因集来全面了解HCC 的干性景观。通过无监督聚类确定了两种干性亚型。随后采用加权基因共表达网络分析 (weighted correlation network analysis,WGCNA)来鉴定与干性亚型和预后相关的基因。基于Cox 回归和随机森林生存分析,构建了一个干性风险模型。此外,研究干性风险评分与预后、TME 模式以及化疗和免疫治疗对肝细胞癌的疗效之间的相关性。总体而言,研究结果表明,干性风险评分可以有效预测HCC 患者预后和免疫治疗反应。
1 材料与方法
1.1 材料
1.1.1 细胞株 HCC 细胞系(Huh-7、SUN-449 和SMMC-7721)购自中国科学院上海细胞库,永生化正常肝细胞系LO2 购自上海通培生物科技有限公司。
1.1.2 主要试剂 临床样本收集于蚌埠医学院第一附属医院肝胆外科2019 年1 月~2021 年12 月手术切除的所需样本组织。细胞组织快速裂解液和蛋白酶抑制剂购自雅酶生物技术公司,BCA 蛋白质检测试剂盒、1%青霉素-链霉素购自碧云天生物技术公司,兔多克隆抗体GSDMC 和抗兔IgG 抗体购自Proteintech 公 司,Dulbecco 的 改 良Eale 培 养 基、PMI-1640 培养基购自Gibco 公司,10%胎牛血清购自武汉普诺赛生命科技有限公司,Trizol 购自上海赛默飞世尔科技(中国)有限公司,cDNA 试剂盒购自维诺赞科技有限公司。该研究已获得伦理学的批准蚌埠医学院第一附属医院委员会(2023YJS12 0),并获得了所有患者的个体同意。
1.2 方法
1.2.1 数据准备和预处理 从TCGA(https://tcga-data.nci.nih.gov/tcga/)获 得 了HCC 样 本 数 据集,TCGA 是一个公开可用的数据库,可提供33 种癌症类型的匹配正常样本[17]。数据集包括HCC 样本的临床注释和生存时间。
1.2.2 HCC 干性亚型的共识聚类 为了鉴定HCC中的干性亚型,采用了StemChecker,这是一种基于网络的工具,用于探索基因集中的干性特征[18]。使用StemChecker 检索了26 个干性基因集,并对其进行了预处理以进行后续分析。使用基因集变异分析GSVAR 包[19]进行单样本基因集富集分析,定量评估每个HCC 样本中26 个基因集的干性富集评分。利用K-means 聚类方法进行1 000 次迭代,然后使用ConsensusClusterPlus R 包执行无监督共识聚类,以确保可靠性。
1.2.3 TME 细胞组成和ESTIMATE 评分 采用CIBERSORT 用于 根据基因表 达谱[20]表征复杂组织中的细胞组成,以计算HCC 样品中22 个免疫细胞的浸润分数。此外,使用“estimate”R 包[21]评估了每个HCC 样本的免疫和基质评分。
1.2.4 化疗敏感性和免疫治疗反应 为了预测临床化疗反应,使用“pRRophetic”R 包,它可以预测基线肿瘤基因表达的反应[22]。通过 “pRRophetic”R 包计算半抑制浓度 (half maximal inhibitory concentration, IC50)来评估几种药物(吉西他滨、多柔比星、博来霉素、依托泊苷和米多龙林)的敏感性。为了评估免疫治疗反应,采用TIDE,这是http://tide.dfci.harvard.edu/提供的在线工具,可根据基因表达预测免疫治疗反应。
1.2.5 加权基因共表达网络分析 选择方差最高的前3 000 个基因,使用“WGCNA”R 包构建共表达网络[23]。使用适当的幂(R2=0.9)转换为拓扑矩阵,使用动态树切割方法对模块进行划分,并根据0.25高度的截止值合并类似的模块。使用斯皮尔曼相关系数评估模块与基因表达特征之间的关系。与基因表达特征相关性最高的模块被选为使用“clusterProfiler”R 包进一步进行基因本体论(Gene Ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)。
1.2.6 预后模型的构建 进行Cox 回归分析,从关键模块中识别总生存期相关基因。然后使用这些总生存期相关基因构建随机森林生存模型,以评估每个基因的重要性。根据相对重要性选择前4 个基因进行Cox 回归分析,构建预后模型。
1.2.7 细胞培养和转染 Huh-7 和LO2 细胞在Dulbecco 的 改 良Eale 培 养 基 中 培 养,SUN-449 和SMMC-7721 细胞在添加10%胎牛血清和1%青霉素-链霉素RPMI-1640 培养基中培养,并在37.5 ℃和5%CO2中孵育。当Huh-7 细胞密度在6 孔细胞培养板中达到70%至80%时,在Huh-7 细胞中转染GSDMC 过表达质粒。
1.2.8 RNA 提取和qRT-PCR 使用Trizol 试剂从Huh-7,SUN-449,SMMC-7721 和LO2 中 提 取 总RNA,然后根据制造商的说明使用cDNA 制备试剂盒进行逆转录。然后,使用实时荧光定量PCR 仪进行定量PCR。采用2-ΔΔCt方法计算靶基因的相对表达水平。用于检测GSDMC和GAPDH表达如下:GSDMC前 引 物:5'-TCCATGTGTGGAACGCATTAGC-3',GSDMC后 引 物:5'-CAAACTGACGTAATTTGGTGGC-3';GAPDH前 引 物5'-CAA-TGACCCCTTCATTGACC-3',GAPDH后引物5'-GACAAGCTTCCCGTTC-TCAG-3'。
1.2.9 Western Blot 从配对的HCC 和邻近的正常组织中提取蛋白质。使用BCA 蛋白质检测试剂盒测量蛋白质浓度。 取等量的蛋白样品行SDS-PAGE 电泳,电泳完成后将蛋白转移到聚偏氟乙烯(PVDF)膜上,用无蛋白快速封闭溶液密封30 min。加入一抗并在 4 ℃ 下孵育过夜。 然后用PBST 洗涤膜3 次与二抗稀释室温摇床孵育2 h。ECL-plus 检测 PVDF 膜上的蛋白信号,曝光并显影。
1.2.10 免疫组织化学 将HCC 组织和配对的相邻良性组织样品置于二甲苯中并用梯度级乙醇水合进行脱蜡,然后在柠檬酸盐缓冲液中加热以进行抗原回收。淬灭过氧化物酶活性后,将切片与抗体在4 °C 下孵育过夜。次日将二抗在室温下孵育1 h,然后脱水密封,最后在显微镜下检查。
1.2.11 成球实验 NC-Huh-7 细胞和OE-Huh-7 细胞用胰酶消化成单细胞悬液,用PBS 洗涤,然后用无血清DMEM / F12 悬浮。每个孔用15 000 个细胞处理,最初仅加入1 mL 球形成诱导培养基。将肿瘤细胞接种到6 孔康宁平板中,每2 天加入球形成诱导培养基。第1 天、第3 天、第7 天、第14 天拍摄,14 d 后每孔计数肿瘤球状体(直径>100 mm)。
1.2.12 统计分析 所有统计分析均使用R 软件(版本4.1.0)进行。“ggplot2”R 包(版本:3.3.6)用于图形表示。分别使用“生存”R 包(版本:3.4-0)和“randomForest”R 包(版本:4.7-1.1)进行单变量Cox比例风险回归和随机森林分析。“glmnet”R 包(版本:4.1-4)用于构建预后模型。GraphPad Prism 9.0用于分析统计结果,并使用配对的t检验分析组间的差异。每个测试重复3 次,P<0.05 为差异具有统计学意义。
2 结果
2.1 鉴定HCC 的干性亚型
该研究共纳入了328 个HCC 样本。计算每位患者26 个干性基因集的富集评分,并通过共识聚类分析鉴定出两个不同的干性集群,标记为C1 和C2(图1A,B)。与C2 集群相比,C1 集群中26 个干性基因集的富集得分显著更高(图1C)。
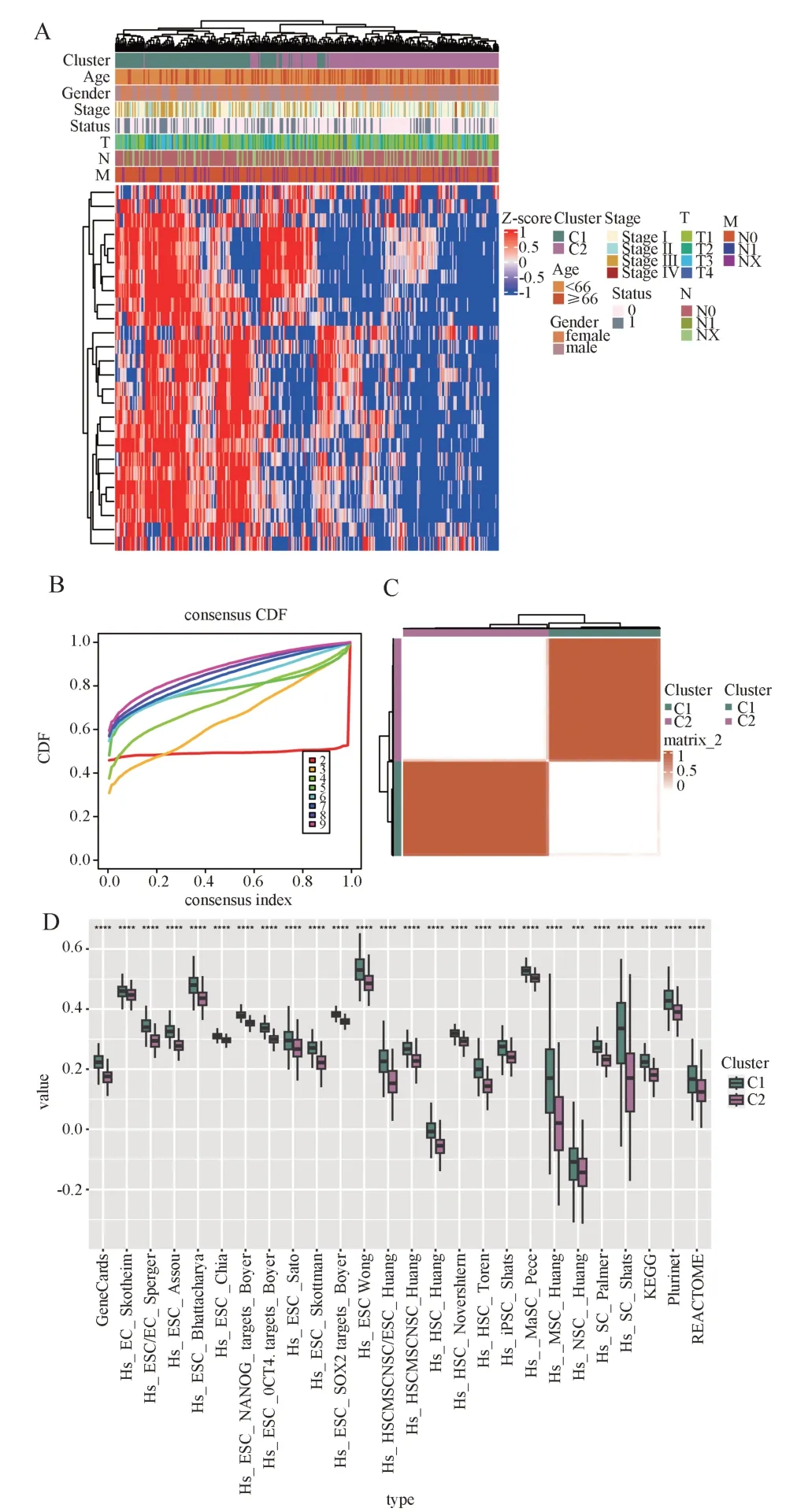
图1 鉴定HCC 的干性亚型Fig 1 Identification of the stemness subtypes of HCC
2.2 C1、C2 生存分析
Kaplan-Meier 生存分析显示,两个集群之间的OS 存在显着差异,C2 患者的OS 优于C1(图2A)。在调整年龄、性别和分期后,这种关系仍然具有统计学意义,C2 患者的风险比低于C1(HR: 0.667 7,95% CI: 0.451 2 to 0.988 0)(图2B)。
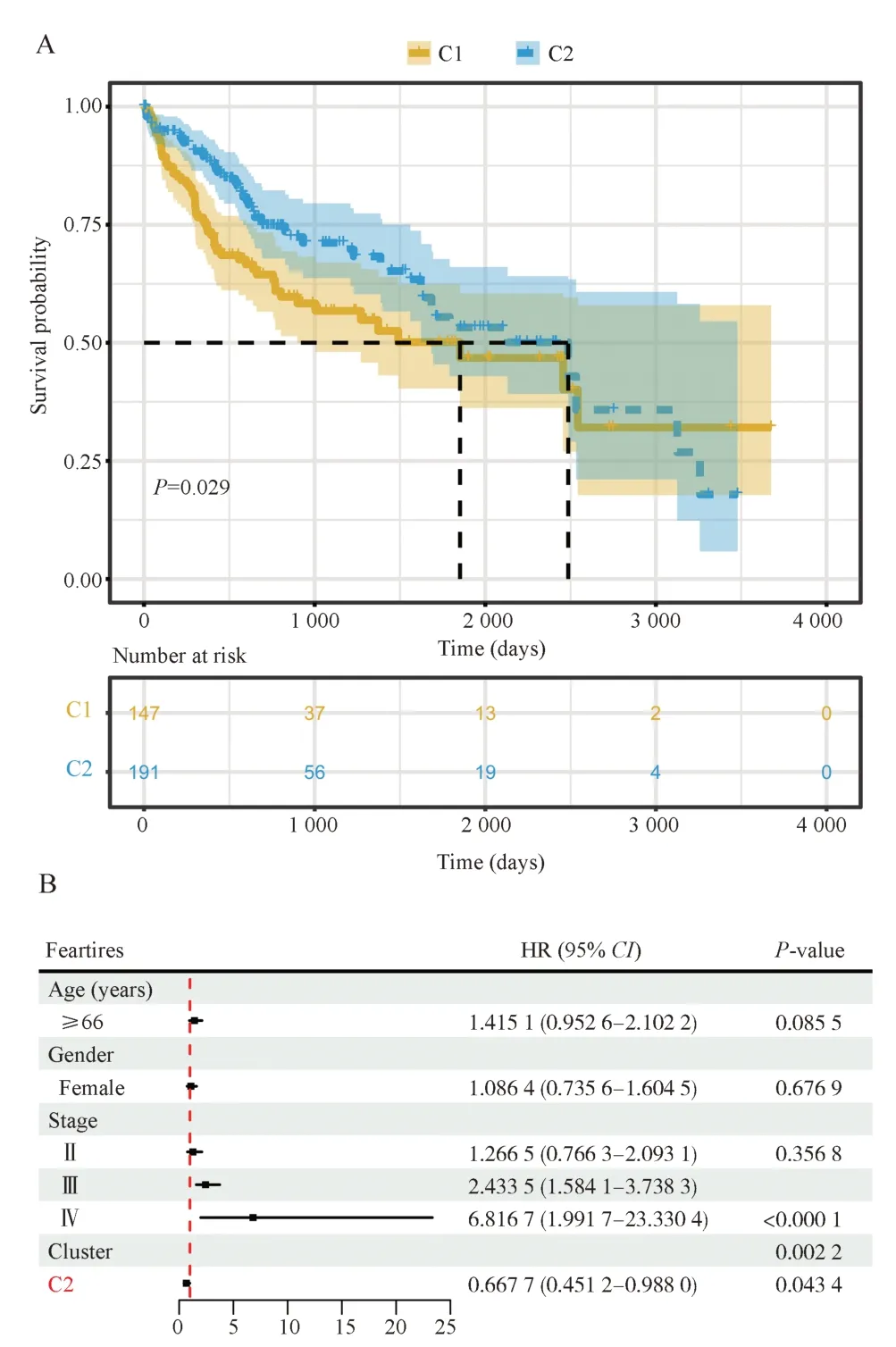
图2 C1、C2 生存分析Fig 2 Survival analysis of C1 and C2
2.3 C1、C2 与TME 和ESTIMATE 分数的相关性及化疗敏感性和免疫治疗反应分析
通过使用CIBERSORT 算法评估22 种免疫细胞类型的浸润水平,进一步评估了TME。5 种免疫细胞(即肥大细胞静息状态、CD4+ T 记忆细胞静息状态、树突状细胞静息状态、调节性T 细胞和肥大细胞活化状态的浸润水平在C1 和C2 之间差异显著。C1 具有较高的浸润水平的CD4+ T 记忆细胞静息状态,树突状细胞静息状态、调节性T 细胞,C2具有较高的浸润水平的肥大细胞静息和活化状态(图3A)。此外,基于ESTIMATE 算法,与C1 相比, C2 的免疫评分,基质评分和ESTIMATE 评分更高。(图3B)。评估C1 和C2 亚型患者对通常用于HCC 治疗的五种化疗药物的敏感性。吉西他滨、多柔比星、博莱霉素、依托泊苷和米哚妥林的半抑制浓度在C2 中显著较高,表明C2 对这些化疗药物的敏感性高于C1(图3C)。此外,该研究使用 TIDE算法评估了C1 和 C2 中患者的免疫治疗反应。与化疗敏感性一致,与C1 相比, C2 免疫治疗反应更好(图3D)。
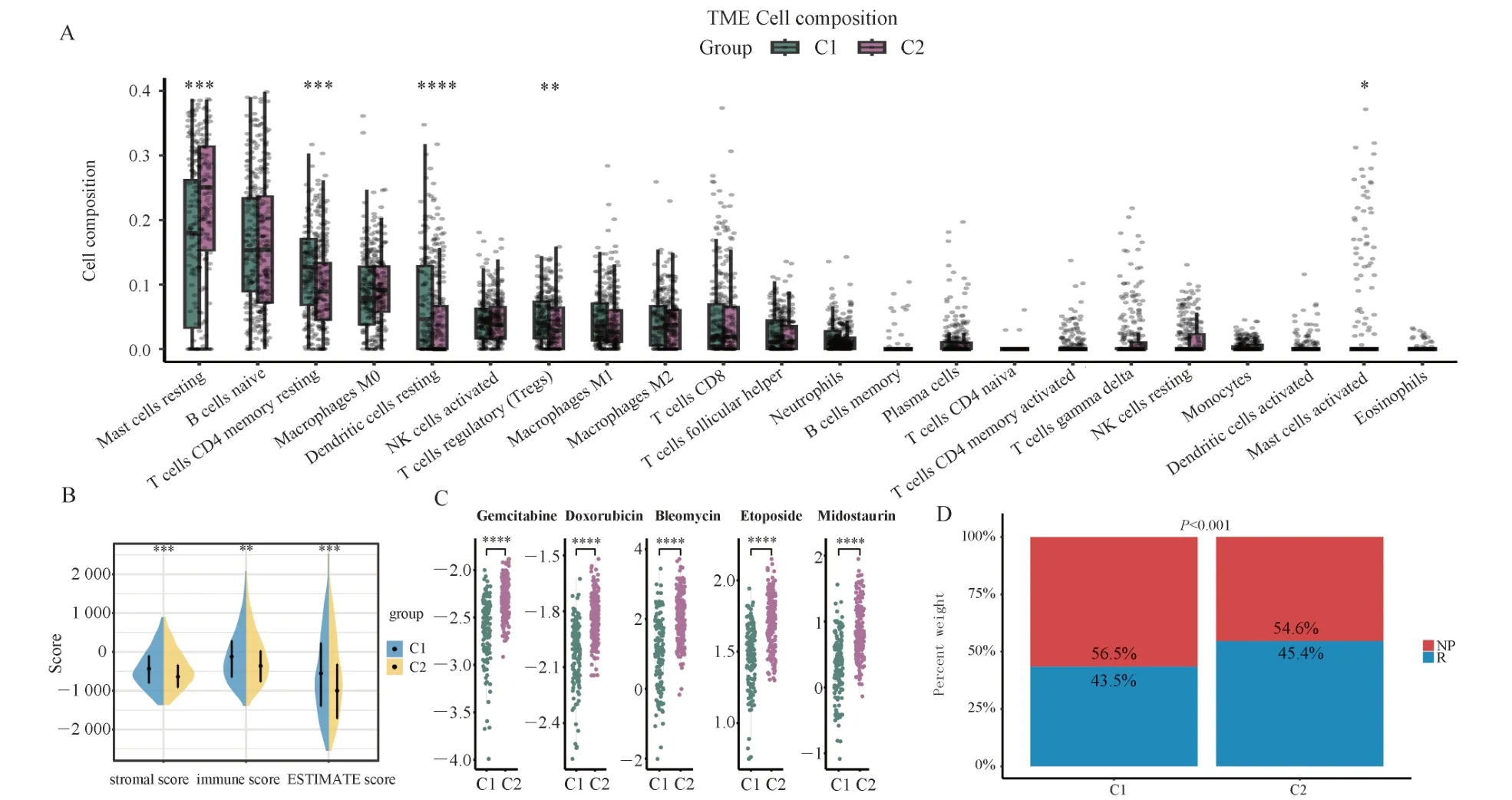
图3 C1、C2 与TME 和ESTIMATE 分数的相关性及化疗敏感性和免疫治疗反应分析Fig 3 Correlation of C1 and C2 with TME and ESTIMATE scores and analysis of chemotherapy sensitivity and immunotherapy response
2.4 识别 C2 相关模块
C2 亚型患者化疗药物的敏感性高于C1,免疫治疗反应更好,因此进行了WGCNA 以确定与该亚型相关的预后基因。使用方差最高的前3 000 个基因构建共表达网络,β=4,R2=0.9(图4A)。将模块特征基因进行聚类,截止高度为 0.25,总共生成了10 个模块(图4B)。洋红色模块与C2 负相关最强(r=-0.34,P=0.000 4)(图4C),因此被确定为进一步分析的关键模块。
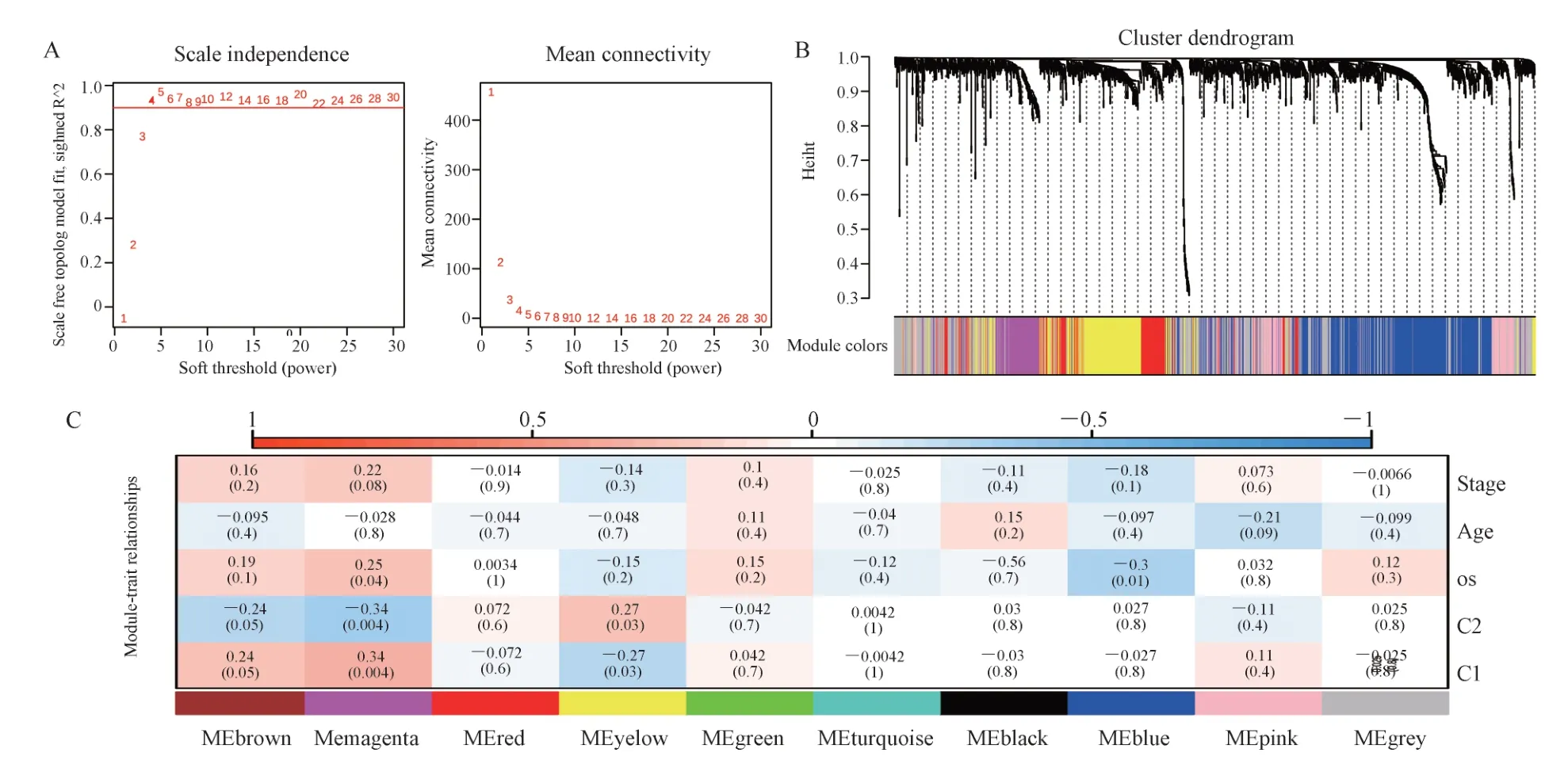
图4 识别 C2 相关模块Fig 4 Identification of C2-associated module
2.5 预后模型的构建
洋红色模块总共包含117 个基因。单变量Cox回归分析确定36 个基因为OS 相关基因。在这些基因中,GSDMC、AOC1、OTX1和CASC9被随机森林生存分析确定为最重要的基因(图5A)。基于对这4 个基因的LASSO 回归分析构建了风险评分模型。分析显示与C1 相比, C2 的风险评分较低(图5B)。使用中位风险评分作为临界值,将患者分为高风险组和低风险组。Kaplan-Meier 生存分析表明,与高风险组相比,低风险组具有更好的OS(图5C)。使用桑葚图可视化基于风险评分的两个集群中患者的分布(图5D)。
2.6 风险评分与TME、ESTIMATE 评分和免疫治疗反应的相关性
与低风险组相比,高危组肥大细胞静息状态和M2 巨噬细胞的比例更高(图6A)。相反,低风险组的滤泡辅助性T 细胞比例升高。此外,与低风险组相比,高危组的基质评分和ESTIMATE 评分更高(图6B)。高危组和低危组对五种化疗药物的敏感性无显著差异(图6C)。然而,与高危组相比,低风险组的患者表现出更高的免疫治疗反应(图6D)。
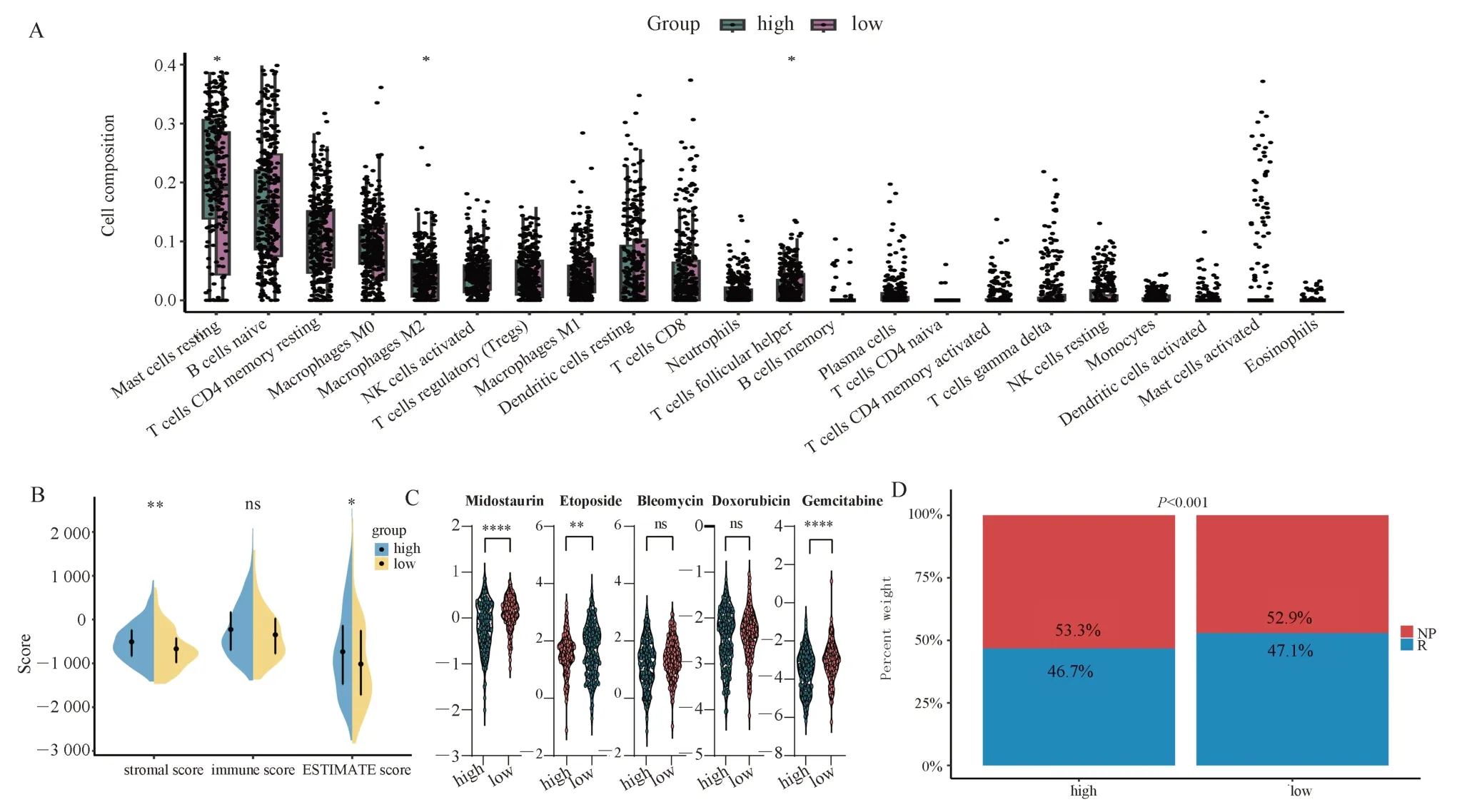
图6 风险评分与TME、ESTIMATE 评分和免疫治疗反应的相关性Fig 6 Correlation of risk score and TME, ESTIMATE score, and immunotherapy response
2.7 GSDMC 在HCC 细胞和组织中下调
通过随机森林生存分析将GSDMC确定为最重要的基因,因此研究了GSDMC对肝细胞癌细胞和肝癌组织的影响。为探究GSDMC在肝癌细胞中的表达水平,选取正常肝细胞系LO2 和3 个肝癌细胞系Huh-7、SUN-449 和SMMC-7721 进 行qRT-PCR实验。结果表明,与正常肝细胞相比,Huh-7、SUN-449 和SMMC-7721 种肝癌细胞系的GSDMC mRNA 表达水平显著降低(图7A), 结果具有统计学意义(P=0.001 3;P=0.003 7;P=0.002 6)。还发现,在这3 个肝癌细胞系中,GSDMC在SMMC-7721 中的表达最高,在Huh-7 中的表达最低。因此,选择了Huh-7 进行后续实验。随后,对4对HCC 组织样品进行WB 以检测GSDMC 的蛋白质水平。与癌旁组织相比,GSDMC在癌组织中的表达较低(图7B),在4 例肝癌组织及配对的癌旁组织中,GSDMC在肝癌组织和癌旁组织的表达中位数分别为0.340 9 和0.809 1,其蛋白水平表达在肝癌组织中低于癌旁组织,P=0.048 4(图7C),差异有统计学意义。采用免疫组化检测GSDMC在肝细胞癌中的表达(图7D),结果显示GSDMC在肝癌组织中下调。
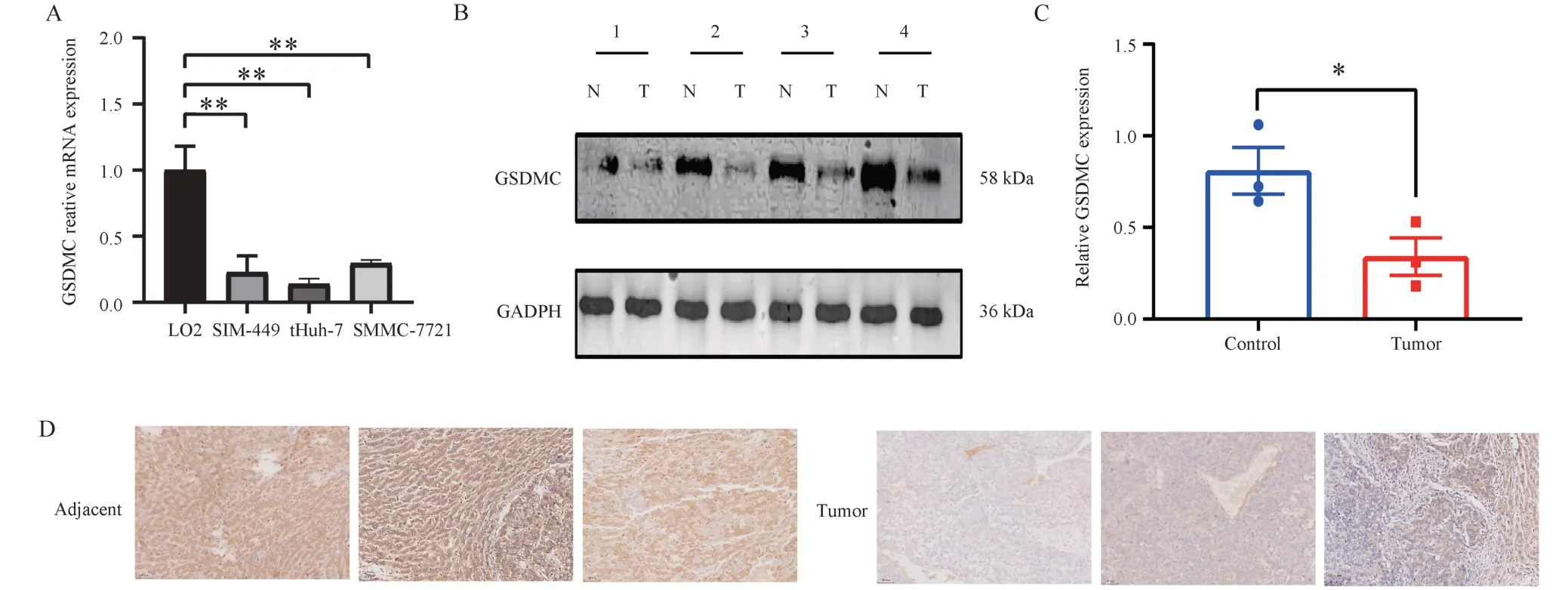
图7 GSDMC 在HCC 细胞和组织中下调性Fig 7 GSDMC was downregulated in HCC cells and tissues
2.8 过表达GSDMC 抑制HCC 细胞的干性
随后,进一步评估了GSDMC对肝癌细胞干性的影响。使用qRT-PCR 分析评估转染效率,结果表明GSDMC 成功转染到Huh-7 细胞中(P=0.002)(图8A)。采用细胞成球实验评估GSDMC是否影响HCC 的干性,结果表明,与对照细胞相比,GSDMC在Huh-7 细胞中的过表达显著降低了球体形成(图8B)。进一步的定量分析表明,GSDMC减少了球体/每个视野的数量(P=0.029)(图8C),表明GSDMC抑制HCC 细胞的干性。

图8 过表达GSDMC 抑制HCC 细胞的干性Fig 8 Overexpression of GSDMC attenuates CSC traits of HCC cells
3 讨论
本研究对大规模肝细胞癌患者群体进行了系统的生物信息学分析,旨在揭示与CSC 相关的26个基因集的分子特征,研究CSC 亚型相关的基因表达模式可能有助于患者的特异性疗法。此外,通过随机森林生存分析确定GSDMC是最重要的一个预后基因。后经实验验证了GSDMC在HCC 组织和细胞中的表达降低,GSDMC抑制HCC 细胞的干性。
利用26 个干细胞基因集的ssGSEA 评分,进行无监督聚类以区分两种的干细胞亚型。C2 亚型26个干性基因集的富集得分低,生存期更长,预后更好,肥大细胞浸润更显著,对免疫疗法反应率更高。C2 的生存结局明显优于C1。为探究化疗和免疫治疗对HCC 的联合治疗是否有更好的疗效,以便进一步研究。本研究分析了各种药物对C1 和C2 患者的影响。结果表明,吉西他滨、多柔比星、博来霉素、依托泊苷和米哚妥林的IC50在C2 中显著更高,表明与C1 相比,C2 患者对这些化疗药物更敏感。这意味着进一步的研究可以集中在HCC 患者的联合治疗上。因此,随后进行了WGCNA 以确定与C2 亚型的关键模块和基因。从该分析中,洋红色模块成为关键模块,由117 个候选关键基因组成。然后进行单变量Cox 和随机森林生存分析,以搜索洋红色模块内的预后基因,最后鉴定出具有预后相关性的4 个基因(GSDMC,AOC1,OTX1,CASC9)。
根据中位风险评分,肝癌患者随后被分为高风险和低风险组。高危组肥大细胞静息状态和M2 巨噬细胞的比例较高,而低危组的滤泡辅助性T 细胞水平升高。M2 巨噬细胞,在大多数实体恶性肿瘤中被称为肿瘤浸润细胞,在增殖、侵袭、迁移和转移中起着至关重要的作用[24]。滤泡辅助性T 细胞来源或 B 细胞相关恶性肿瘤中滤泡辅助性T 细胞数量的增加通常与不良预后有关,而在各种非淋巴细胞来源的实体器官肿瘤类型中,它预示更好的预后[25]。关于本研究中确定的四个干性模型基因,GSDMC上调与结直肠癌,乳腺癌和黑色素瘤的不良临床结果有关[26-28]。然而,已经发现GSDMC表达在几种食管鳞状细胞癌病例中受到抑制,这表明其作为肿瘤抑制基因的作用[29]。在本研究中,GSDMC在HCC 组织和细胞中的表达降低。球体形成实验和RT-qPCR 表明GSDMC抑制HCC 干细胞表型。
本研究有局限性。首先,研究中的数据是从公共数据库而不是本研究数据中获取。其次,基于生物信息学鉴定了与HCC 干性相关的模型基因,需要进一步的功能实验来研究其作为靶标的能力,以提高免疫治疗和化疗疗效。
作者贡献度说明:
包凌:参与实验设计执行、数据库检索和论文撰写;龚旋坤:参与部分数据库检索及部分基础实验;陈晓:参与实验设计、论文撰写指导。
所有作者声明不存在利益冲突关系。

