索拉非尼基于Hippo/YAP 及PI3K/Akt/mTOR 信号通路介导细胞自噬在肝细胞癌中产生耐药机制研究进展
曹 智,周 塏,陈 骋,梁贤文,刘路政,武金才,
(1.海南医学院临床学院, 海南 海口 571199;2.海南省人民医院肝胆胰外科,海南 海口 570311;3.海南医学院第二附属医院介入血管外科,海南 海口 570216)
肝细胞癌(hepatocellular carcinoma,HCC)是全球最常见的实体恶性肿瘤之一[1],许多患者发现时已为晚期,并且只能通过全身药物治疗方式进行治疗,但大部分患者往往达不到治疗的预期效果。其主要原因是HCC 细胞对相关药物出现耐药[2],导致许多药物疗效逐渐下降,其中包括索拉非尼,相关研究表明,虽然索拉非尼能够抑制HCC 肿瘤细胞的进展,但长期服用会诱导HCC 对其产生耐药,目前有许多学者探讨了索拉菲尼在HCC 中出现耐药的原因,认为可能是由PI3K/Akt/mTOR 信号通路介导 自 噬 所 致[3]。如Cao 等[4]研 究 发 现PI3K/Akt/mTOR 通路可通过抑制自噬增强肝细胞癌对索拉菲尼的耐药。因此,索拉菲尼与PI3K/Akt/mTOR通路抑制剂联合疗法成为治疗HCC 未来方向,如今此类研究在动物实验中取得一定的成果。值得注意的是,索拉菲尼还可参与Hippo/YAP 信号通路在HCC 中发挥作用,相关研究证实,Hippo/YAP 信号通路在HCC 中介导自噬影响索拉非尼的疗效[5]。因此,研究由索拉菲尼介导的PI3K-Akt-mTOR 途径及Hippo/YAP 信号通路参与HCC 的细胞自噬与增殖等过程,进一步明确索拉菲尼的在HCC 中的耐药机制,确定HCC 的新治疗靶点,对未来HCC 临床治疗方面有着重要意义。
1 索拉非尼治疗HCC 的机制
索拉非尼为一种广谱酪氨酸酶抑制剂,是被美国食品和药物管理局批准用于治疗晚期HCC 患者的药物[6]。其主要通过两种方式来达到抗肝肿瘤的目的,其一,索拉非尼通过抑制Raf-1、B-Raf 和相关激酶在Ras/Raf/MEK 信号通路中的活性来抑制肝肿瘤细胞增殖活性[7]。其二,索拉非尼可以通过靶向肝细胞因子受体(c-Kit)、Fms 样酪氨酸激酶(FLT-3)、血管内皮生长因子受体(VEGFR)-2、VEGFR-3、血小板衍生生长因子受体(PDGFR-β)和其他酪氨酸激酶来抑制血管生成,抑制肝肿瘤细胞摄取营养,致使肝细胞发生凋亡(图1)[8]。如今,索拉非尼作为晚期HCC 靶向药物已广泛应用于临床,在HCC 治疗中发挥了巨大的作用。但不幸的是HCC 对索拉非尼的耐药性的发展变得越来越普遍,主要是由于体内肿瘤微环境(EMT)的改变、表观遗传调节、癌症干细胞、自噬以及相关通路之间的串扰参与了索拉非尼耐药性[9]进而导致HCC 对其敏感性下降。目前索拉非尼在HCC 中产生耐药机制已成为了当前的研究热点,许多药物还在研究与开发当中,相信在未来索拉非尼联合疗法可以提高本身敏感性,从而会改善其疗效,缓解晚期HCC 病情进展。
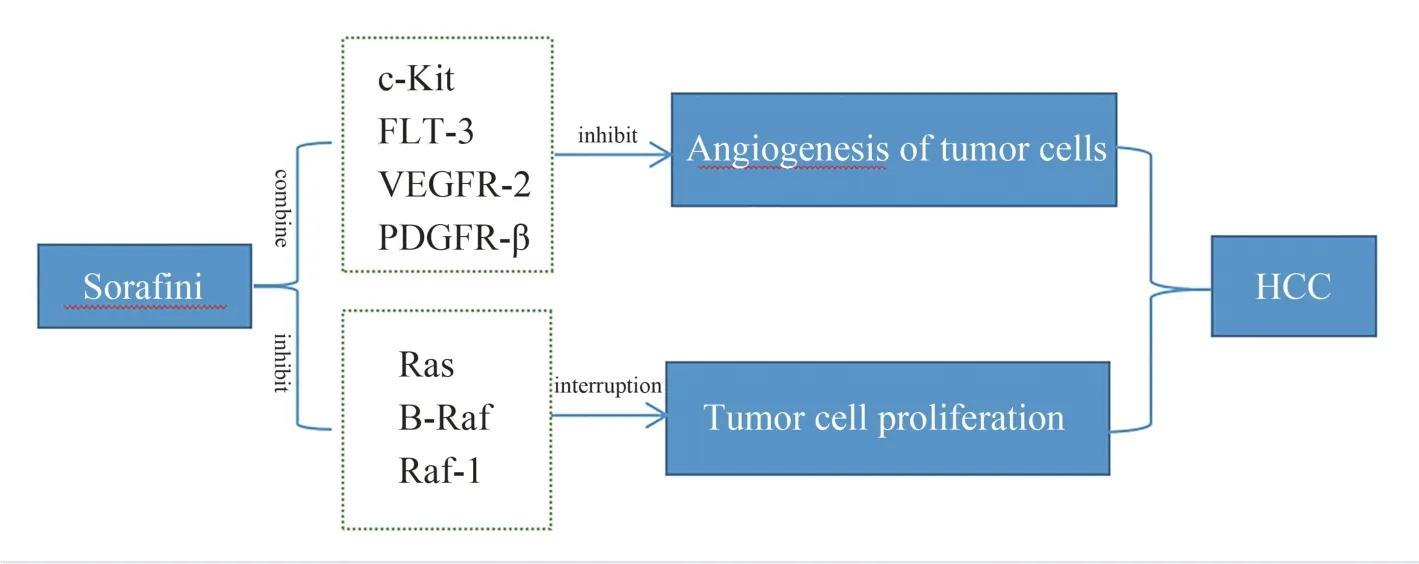
图1 索拉非尼治疗HCC 机制过程Fig 1 Mechanism of sorafenib treatment of HCC
2 Hippo/YAP 信号通路与HCC 关系
Hippo 信号通路又称“河马通路”,其中Yes 关联蛋白(YAP)是该信号通路中重要的转录因子,主要调节细胞的凋亡、增殖、维持细胞稳态等多种过程[10],该通路的失调会促使多种癌症的发生,相关研究显示Hippo/Yap 信号通路的过表达或失调,可导致肝脏生长、主细胞扩增以及肿瘤发生[11]。然后,Hippo/Yap 与HCC 之间的关系主要通过自噬进行介导的,许多研究已证实了YAP/TAZ(具有PDZ序列的转录共激活因子)激活后,将会通过自噬方面,从而调控肝肿瘤细胞的增殖、侵袭和存活能力[12],与此同时,Hippo/Yap 信号通路的过度激活,会抑制细胞自噬,从而降低相关靶向药物(索拉非尼)治疗HCC 的疗效。因此,下将详细介绍Hippo/YAP 信号通路介导自噬在HCC 中的作用。
2.1 Hippo/YAP 信号通路介导自噬参与HCC 的调控
Hippo/ YAP 与细胞增殖密切相关,并广泛地参与调控脏器生长、细胞自噬、肿瘤的发生、转移[13]。据相关研究阐述Hippo/YAP 被激活后,则会抑制自噬,从而导致肝脏组织重塑、原始细胞激活以及肿瘤发生,自噬对HCC 的具体调节机目前尚不明确[14]。有研究显示,Hippo/YAP 被激活后,可促使TAZ 表达从而导致Armus 的表达上调,而Armus是自噬体周转所需的RAB7-GAP,其表达增加会抑制自噬,从而增加自噬通量,导致肿瘤的发生[15](图2)。因此,Hippo/ YAP 异常激活可通过介导自噬促使HCC 细胞增殖。目前YAP 与自噬之间的关系日益受到医学界的重视,有许多研究相关分子通过影响YAP 与自噬的之间作用,从而缓解HCC 病情。如Zeng 等[16]发 现 芹 菜 素 降 低 了YAP 的 表 达,从 而减少了HCC 的迁移和侵袭,并通过调节自噬相关基因的表达促进了HCC 细胞的自噬。同时,还包括相关基因的研究,如Wang 等[17]通过实验表明lncRNA-ATB 可以通过调节YAP 活性和增加ATG5 表达来调控自噬,从而抑制HCC 细胞生长。此外,还有许多通过介导Hippo/YAP 信号通路参与自噬调控的因子尚未被研究或者正在研究中,望将来能够有所突破,为HCC 患者提供更好、更有效的治疗。
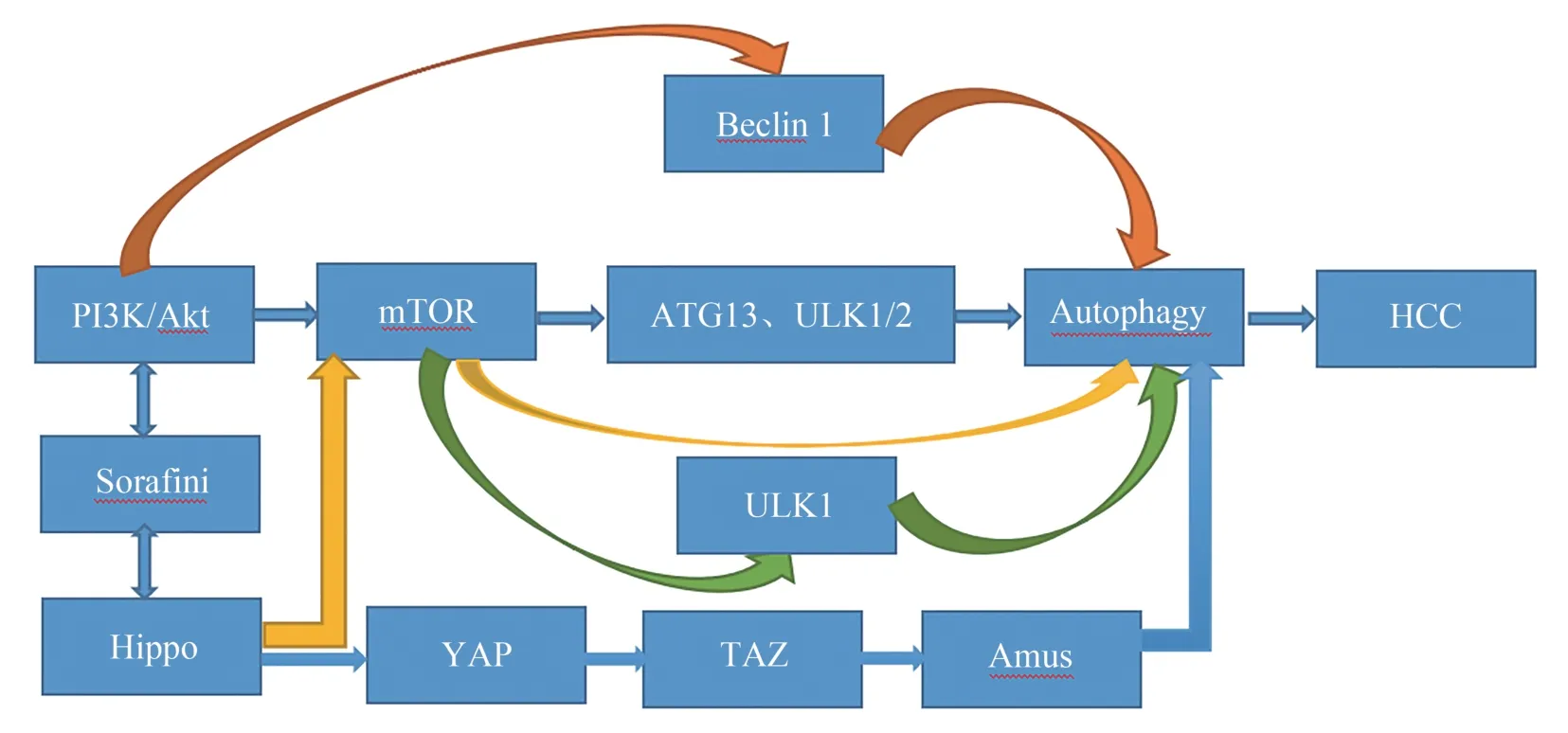
图2 YAP/Hippo 信号通路与PI3K/AKT/mTOR 通路介导自噬在HCC 中的作用Fig 2 YAP/Hippo signaling pathway and PI3K/AKT/mTOR pathway mediate autophagy in HCC
2.2 索拉菲尼基于Hippo/YAP 信号通路介导自噬在HCC 中形成耐药机制
自噬在癌症耐药性中有着极大的意义,相关研究表明,通过相关自噬类抑制剂抑制相关细胞自噬后,可增强癌细胞对抗药物的耐药[18],具体而言,由于肿瘤细胞中YAP 被激活后,通过抑制ROS 产生并促使mTOR 蛋白的活化,进一步加强抑制ROS的激活,从而阻止自噬相关细胞死亡并促进相关耐药性产生[5],值得注意的是,肿瘤细胞在缺氧状态下还可以诱导YAP 核易位,促进细胞存活以及药物杀伤逃逸,并反式激活细胞凋亡的靶基因,从而导致索拉非尼耐药[19],因此,许多学者致力于研究恶性肿瘤在形成缺氧环境下对抗药物耐药性的治疗策略,发现抑制抗氧化剂或恢复细胞内ROS 水平的药物是解决问题的最佳选择,研究发现蒽环类药物和紫杉醇可以通过增加细胞内ROS 水平在一定程度上促进抗癌作用[20]。但由于它们具有很强的清除细胞内ROS 的能力导致其抗耐药性失败[21]。此类研究还在延续。而靶向YAP 药物也可作为克服HCC 耐药性的理想选择。但尚未见相关研究报道,值得注意的是,索拉菲尼是目前治疗HCC 的常规一线药物,是否也会通过YAP 介导mTOR 通路抑制自噬导致肝肿瘤细胞对其出现耐药性?Zhou 等[19]的关研究表明HCC 患者在长期服用药物治疗时会导致肝肿瘤组织周边形成缺氧环境,这将导致HCC对索拉非尼耐药性增强,而他汀类药物能有效消除缺氧激活的YAP 蛋白作用,从而改善肿瘤组织缺氧微环境,致使HCC 细胞对索拉非尼的敏感性下降。因此,他汀类药物与索拉菲尼联合应用可能也成为未来的逆转HCC 耐药性的关键治疗策列,但目前由Hippo/YAP 信号通路介导自噬在HCC 中对索拉非尼形成耐药机制的相关研究较少,这可能会为索拉非尼耐药性提供新的治疗途径。
3 PI3K/Akt/mTOR 信号通路与HCC 相关
PI3K/Akt/mTOR 通路对于细胞来说是一条重要的信号转导通路,它不仅参与正常的组织细胞活动,通过调节正常细胞的活动过程如细胞周期、细胞增殖、凋亡和血管生成等,也与大多数肿瘤细胞活动有关联,并且有研究证实PI3K/Akt/mTOR 信号通路与肝肿瘤细胞的发生、发展息息相相关,而介导自噬在HCC 中的影响中也有所关联[22]。值得关注的是,PI3K/Akt/mTOR 通路还可影响HCC 相关靶向药物如索拉非尼的疗效,但通过参与自噬过程致使HCC 对索拉非尼耐药方面也是众多确立因素之一[23]。因此,以下将详细介绍PI3K/Akt/mTOR 信号通路介导自噬对HCC 的影响。
3.1 PI3K/Akt/mTOR 信号通路介导自噬参与HCC 的调控机制
目前相关研究已证实,HCC 中的PI3K/AKT/mTOR途径存在异常激活现象,且相关蛋白激酶(PI3K、AKT、mTOR 等)在HCC 中往往呈现高表达,为此造成HCC 治疗预后较差[24]。原因是该通路被激活后可抑制肝肿瘤细胞发生自噬,促进HCC 相关细胞增殖,导致病情的恶化[25]。其主要作用机制过程是PI3K/AKT 通路激活后,导致mTOR 激酶发生活化,进而促使自噬相关复合物发生磷酸化(如ATG13)和ULK1/2),促使HCC 细胞增殖,同时,mTOR 激酶还可抑制激酶1 复合物(ULK1),抑制了自噬机制的发生。此外,PI3K/AKT 通路激活后,可导致Beclin 1 的相关位点(Ser295、234 位点)磷酸化,通过抑制自噬致使HCC 病情进一步发展[26]。因此,PI3K/AKT/mTOR 途径在HCC 中的异常激活是目前导致HCC 进展的潜在机制,通过阻断PI3K/AKT/mTOR途径从而抑制HCC 是具有重要的临床意义。有研究发现,Xue 等[27]通过Anemoside B4(AB4)抑制了PI3K/Akt/mTOR 轴,以增加相关自噬因子的表达从而诱导细胞凋亡及自噬,进而达到抑制HCC 作用。因此,PI3K/Akt/mTOR轴抑制剂得到了相当大的关注,如今在此方面已取得突破性的进展,而有趣的是,当前有许多学者正在研究相关RNA(如LncRNA )介导PI3K/AKT/mTOR 在HCC 中 作 用[28]。但 目 前 来 说 对 相 关RNA 的研究仍不够成熟,未来可能会研究出治疗HCC 的 最 佳RNA 靶 点。
3.2 索拉菲尼基于PI3K/Akt/mTOR 信号通路介导自噬在HCC 中形成耐药机制
HCC 对索拉非尼形成耐药与许多复杂因素相关(如肿瘤微环境、相关遗传因子、相关信号通路等),其中PI3K/AKT/mTOR 途径异常活化起重要作 用[29]。研 究 发 现,PI3K/AKT/mTOR 是 导 致 许多药物出现耐药性的重要途径,主要是通过介导的自噬而发挥作用。如Cao 等[30]研究发现,在HCC 中PI3K/AKT/mTOR 和自噬途径的异常激活,是促使索拉非尼耐药的最重要因素。同时,也有研究表明PI3K/AKT/mTOR信号通路在索拉非尼耐药机制中细胞自噬相关[31],此外,索拉非尼长期使用后致使自噬体的不断沉积,从而影响其疗效,如Shimizu 等[32]发现通过索拉非尼治疗HCC 后,其自噬体逐渐累积和以及自噬通量发生活化,如LC3 脂质增加以及Huh62、HLF、细胞自噬底物 p5 明显下降,从而促进肝细胞存活并限制索拉非尼效率。因此,克服该药物的耐药性的主要策略是联合治疗;也就是说,两种药物以不同的方式抑制一个或多个关键信号通路,从而阻断耐药机制。如Kirstein 等[6]通过使用mTOR抑制剂后可改善HCC 对索拉非尼的敏感性,从而增强抗肿瘤作用,同时,Dai N 等[34]研究发现一种名为辣椒素的抑制剂,可通过抑制PI3K/Akt/mTOR 分子途径的,从而促进Beclin-1 和LC3(自噬相关因子)的表达,引起细胞自噬,从而使肝肿瘤细胞对索拉非尼耐药性性发生逆转。因此,索拉非尼联合治疗可以抑制HCC 细胞的生长,侵袭和转移,并以协同方式诱导自噬,此治疗方式作为HCC 治疗选择最佳的潜力。
4 讨论
Hippo/YAP 信号通路与PI3K/AKT/mTOR信号通路参与细胞凋亡、增殖、分化、代谢等病理生理过程,而值得关注的是,这两条通路在HCC 中处于异常激活状态,并促使肿瘤细胞发生、发展。同时、它们可与自噬之间建立了联系,致使HCC 对多种靶向药物产生了耐药,导致晚期HCC 患者生存率逐年下降。目前有相关文献表明通过相关信号通路抑制剂抑制PI3K/AKT/mTOR 途径以及Hippo/YAP 信号通路可提高HCC 对相关靶向药物的敏感性。因此联合疗法也正在逐渐取代单一治疗,成为治疗相关肿瘤疾病的重要手段。值得注意的是,索拉非尼仍是目前治疗肝细胞癌的标准一线选择,已广泛应用于临床中,但由于患者长时间服用出现耐药现象,且只在一部分患者疗效效果明显。因此许多研究者也致力于研究HCC 对索拉非尼的耐药机制,目前索拉非尼在治疗肝癌时可能会通过Hippo/YAP 信号通路与PI3K/AKT/mTOR 通路介导自噬从而发生耐药,或许未来的研究重点可侧重于索拉非尼与PI3K / AKT / mTOR 信号或YAP/Hippo 信号自噬轴之间的关联性,这将有助于相关信号通路抑制类药物以及蛋白、基因等众多治疗手段的开发,并与索拉非尼联合后可能成为治疗HCC 的最佳选择之一。
综上所述,本文主要列举了Hippo/YAP 通路及其PI3K/AKT/mTOR 信号通路各自在相关癌细胞中调控自噬来控制肝癌细胞对索拉非尼耐药的的相关机制,并简要概述了两条通路具有相关共通点,为肝癌的发病机制,癌细胞转移、癌症预后、对靶向药物耐药性方面提供了新的看法和新的分子学基础。或许将PI3K / AKT / mTOR 信号通路或Hippo/YAP 信号自噬轴抑制剂与索拉菲尼联合使用是治疗HCC 潜在最佳选择。
作者贡献度说明:
曹智:主要进行文献查找,翻阅,记录,写作等工作;武金才:文章整体把控及内容审校;周塏,刘路政:提供文章修改意见;陈骋,梁贤文:课题组成员,提供所在领域文献和相关领域修改意见。
所有作者声明不存在利益冲突关系。

