小檗碱对三阴性乳腺癌细胞MDA-MB-231增殖、迁移及凋亡的影响*
秦田, 杨宇石, 尹明英, 杨冰清, 金柔, 石钰, 黄瑾瑾, 徐澍*
(1.贵州医科大学附属医院 病理科, 贵州 贵阳 550004; 2.贵州医科大学 临床医学院 病理学教研室, 贵州 贵阳 550025)
乳腺癌患者中大约有10%~15%是雌二醇受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)表达均为阴性的三阴性乳腺癌(triple negative breast cancer,TNBC)。因TNBC无特异性的靶向药物,所以治疗效果差[1-3],目前TNBC的主要治疗方式仍然是手术联合放化疗方式,并具有较高的复发风险和较低的生存率[4-5]。乳腺癌在中医辨证中属多痰毒瘀互结,化痰活血、清热解毒散结是其治疗法则[6],而黄连可清热燥湿、泻火解毒,在热毒蕴结型乳腺癌中常作为君药使用(如黄连解毒汤)。小檗碱(berberine,BBR),又称黄连素,是从中药黄连中分离的一种季铵生物碱,是黄连抗菌的主要有效成分,大量研究表明其有抗炎、抑菌、保护神经、降糖、降脂及抑制肿瘤等广泛的药理作用[7-8]。因此在本研究中,通过不同浓度BBR对人TNBC细胞系MDA-MB-231进行干预,探究BBR对MDA-MB-231细胞的增殖、迁移、凋亡的影响以及NF-κB信号通路在其中发挥的作用。
1 材料与方法
1.1 材料
1.1.1细胞株 人TNBC细胞系MDA-MB-231(购自于中国科学院细胞库,保存于贵州医科大学附属医院病理科实验室)。
1.1.2主要药物及试剂 细胞培养基DMEM(美国 Gibico),胎牛血清(澳洲VICENT),盐酸BBR(中国 索莱宝),AnnexinV/PI试剂盒(以色列Biological Industries),抗β-actin抗体(美国 GeneTex),兔多克隆抗体NF-κB P65、兔多克隆抗体磷酸化 NF-κB P65、重组兔多克隆抗体凋亡相关蛋白Caspase-3、辣根过氧化物酶标记山羊抗兔IgG二抗(英国 Abcam)。
1.1.3实验仪器 光学倒置显微镜(Olympus, BX53),曝光机( Bio-Rad, YSTEM GelD),培养箱(Biobase, QP-160),流式细胞仪( Beckman coulter,CytoFLEX)。
1.2 方法
1.2.1细胞培养及分组 MDA-MB-231细胞株用含10%胎牛血清、1%链霉素、青霉素(100 mg/L)的高糖DMEM培养基于37 ℃、5%的CO2培养箱中培养;细胞培养2~3 d进行传代,取处于对数生长期、生长状态良好的细胞进行下一步实验。参照既往相关研究,以0、25、50 μmol/L为实验浓度分组[9]。
1.2.2平板克隆实验 取对数生长期的细胞,用0.25%胰蛋白酶消化、计数,使细胞悬浮在含10%胎牛血清的DMEM培养液中备用;接种细胞于2 mL培养基皿中,使每个细胞培养皿中细胞数为400个;置37 ℃、5%CO2及饱和湿度的细胞培养箱中培养,细胞贴壁后,使用BBR浓度0、25、50 μmol/L的培养基作用24 h,5 d换1次液,培养10 d,当培养皿中出现肉眼可见的克隆时,终止培养;弃去上清液,PBS清洗2次,吸取2 mL 4%多聚甲醛加入培养皿中固定细胞15 min;然后去除固定液,加结晶紫染色液(1∶20配制)染色10~30 min,流水缓慢洗去染色液,干燥后拍照,并用Image J软件计数克隆。
1.2.3划痕实验 取对数生长期的MDA-MB-231细胞,胰酶消化后种于6孔板内,在板底画线定位,培养箱继续培养24 h待细胞生长至100%融合,使用10 μL无菌枪头在每个培养孔中垂直于画线对细胞进行划痕,PBS清洗后在光学倒置显微镜下对划痕面积进行拍照;加入0、25、50 μmol/L BBR放入培养箱内培养24 h,取出在倒置显微镜下观察细胞迁移并拍照;使用Image J软件测量原面积和培养后面积,计算迁移率,迁移率(100%)=(原面积-培养后面积)/原面积×100%。
1.2.4Transwell迁移实验 取进入对数生长期的MDA-MB-231细胞,然后将细胞消化、计数;打开Transwell 24 孔板,在小孔上室加入100 μL含有5×104个细胞的基础培养基,然后加入BBR浓度0、50、100 μmol/L配制培养基100 μL;下室加入10% FBS完全培养基500 μL,将小室缓慢倾斜放入,避免气泡产生,置于37 ℃ 恒温CO2培养箱培养24 h后,PBS清洗小室、棉棒轻柔擦拭上室,4%多聚甲醛预固定小室20 min,PBS清洗2次,结晶紫染液染色15 min,PBS清洗3次,在倒置显微镜下观察,并随机选取5个视野,100×进行细胞计数。
1.2.5Annexin V/PI 检测细胞凋亡率 取对数生长期的MDA-MB-231细胞,胰酶消化后种于6孔板内,不同浓度BBR处理24 h后收集细胞上清及贴壁细胞,PBS洗涤2次,用100 μL 1×Binding buffer重悬细胞, 再加入FITC 5 μL、 PI 10 μL避光染色20 min,加入 Binding buffer 400 uL后吹打混匀,流式细胞仪下分析细胞凋亡率。
1.2.6Western blot检测蛋白表达 用0、25、50 μmol/L的BBR处理48 h对数生长期的MDA-MB-231细胞后,取待测蛋白在10%的分离胶进行SDS-PAGE电泳,随后冰上放置转印器具设置恒流250 mA进行转膜70 min,将蛋白转至PVDF膜,快速封闭30 min后放入β-actin一抗(1∶1 000)、P65一抗(1∶1 000)、磷酸化P65一抗(1∶1 000)、Caspase-3孵育4 ℃过夜,室温二抗孵育1 h,化学发光法(ECL)检测蛋白表达。
1.3 统计学分析
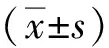
2 结果
2.1 不同浓度BBR对MDA-MB-231细胞生长形态的影响
正常TNBC的MDA-MB-231细胞生长呈现为梭形,胞质伸展,细胞贴壁紧密,而BBR给药组细胞呈现出不规则形态,细胞出现明显皱缩、细胞质高度浓缩、细胞外出现碎片,随着BBR给药浓度的增加,细胞的贴壁能力下降。见图1。

注:A~C分别为不同浓度BBR作用后光镜下MDA-MB-231的细胞形态。
2.2 不同浓度BBR对MDA-MB-231细胞增殖能力的影响
使用0、25、50 μmol/L浓度BBR作用MDA-MB-231细胞,在克隆形成实验中,可观察到BBR能抑制MDA-MB-231细胞的增殖活性(P<0.05)。见图2。

注:A 为不同浓度BBR作用后MDA-MB-231 细胞平板克隆形成情况,B为平板克隆形成实验的定量结果;(1)与0 μmol/L BBR组相比,P<0.05。
2.3 不同浓度BBR对MDA-MB-231细胞迁移能力的影响
使用0、25、50 μmol/L浓度BBR作用MDA-MB-231细胞,在划痕实验中,与0 μmol/L组相比,实验组随着BBR浓度增加,细胞划痕伤口愈合距离百分比逐渐降低;在Transwell迁移实验中,相较于0 μmol/L BBR组而言,BBR能明显抑制TNBC的迁移能力。见图3。

注:A、B为不同浓度BBR作用后MDA-MB-231细胞划痕实验结果(图A为光镜);C、D为不同浓度BBR作用后MDA-MB-231细胞Transwell实验结果(图C为结晶紫染色);(1) 与0 μmol/L BBR组相比,P<0.05。
2.4 不同浓度BBR对MDA-MB-231细胞凋亡的影响
BBR给药后MDA-MB-231细胞总凋亡率分别为7.72%±1.36%(0 μmol/L)、13.29%±6.55%(25 μmol/L)、13.70%±6.26%(50 μmol/L),与0 μmol/L BBR组相比,25 μmol/L、50 μmol/L引起的细胞凋亡率高(P<0.05),提示BBR能够诱导MDA-MB-231细胞凋亡。见图4。
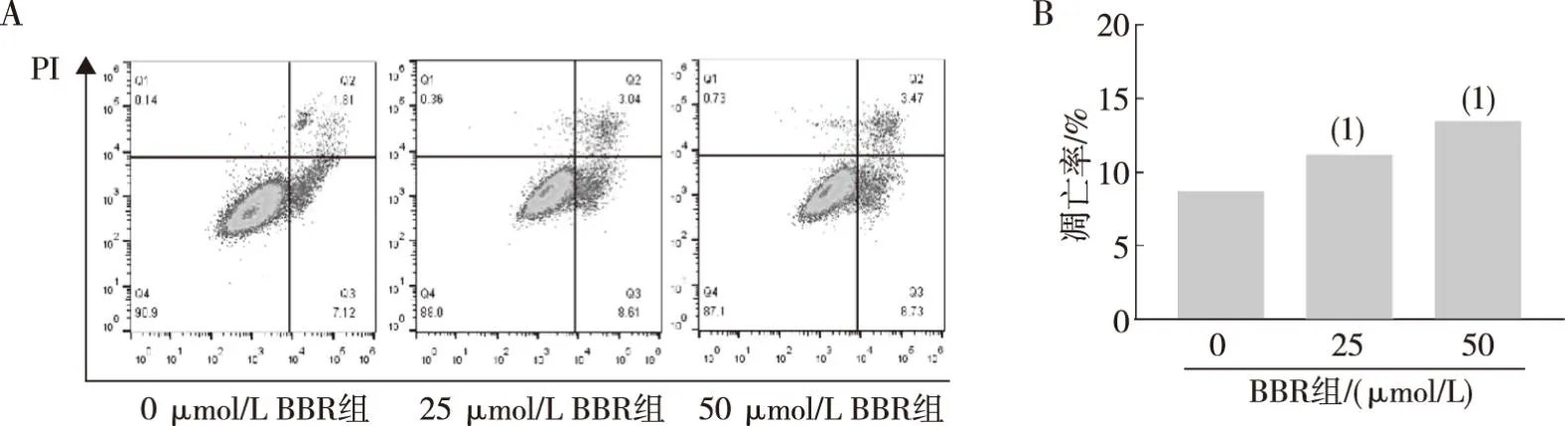
注:A为 0、25 及 50 μmol/L BBR组对人MDA-MB-231 细胞凋亡的影响,B为细胞凋亡率的定量结果;(1)与0 μmol/L BBR组相比, P<0.05。
2.5 P65蛋白、磷酸化P65蛋白及裂解活化的凋亡级联蛋白Caspase-3(C-Caspase3)的表达水平
BBR作用MDA-MB-231细胞48 h后,使用Western blot检测MDA-MB-231细胞中P65蛋白及其磷酸化的状态,发现P65蛋白水平不变,而其磷酸化水平降低(P<0.05),并且C-Caspase3在BBR作用后增加(P<0.05)。见图5。
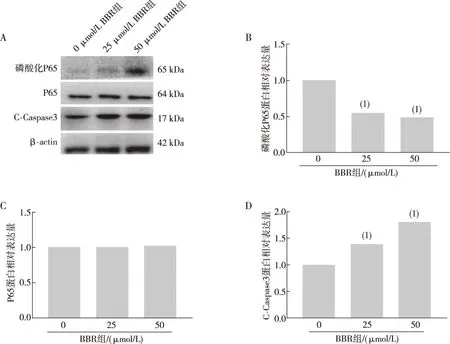
注:A为不同浓度BBR作用后MDA-MB-231细胞的蛋白条带图,B为磷酸化P65蛋白表达水平,C为 P65蛋白表达水平,D为C-Caspase3蛋白表达水平;(1)与0 μmol/L BBR组相比,P<0.05。
3 讨论
TNBC作为一类恶性程度和侵袭性均高的乳腺癌亚型,具有高复发率和低生存率的特点,目前临床尚无针对其的靶向治疗药物[10],因此,探索新的治疗方式对TNBC患者来说十分重要[11]。
BBR是黄连中主要的活性异喹啉类生物碱之一,研究证实可以通过诱导肿瘤细胞周期停滞、衰老、凋亡及自噬作用来抑制癌细胞的增殖、侵袭和转移,在不同的肿瘤中表现出明显的抗肿瘤活性[12-14]。特别是乳腺癌中,BBR有高度的抗肿瘤活性[12]。
NF-κB转录因子是免疫、炎症和急性期反应的关键调节因子,也参与细胞增殖和凋亡的控制[15-17]。在乳腺组织中,该通路的异常活化常导致肿瘤的发生[18],NF-κB在TNBC中经常被激活,抑制NF-κB活性会抑制TNBC细胞的生长[17]。当细胞处于静息状态时,NF-κB作为由亚基P65和P50以及抑制性亚基IκBα组成的异质体在细胞质中保持无活性状态。然而,在大多数癌症中,NF-κB处于活动状态,P65/P50亚基被释放并迁移到细胞核,在那里与特定的DNA序列结合并激活超过500个基因的转录。P65丝氨酸536 处的磷酸化的活化对 P65 的转录活性至关重要,P65上的丝氨酸S536位点磷酸化,可导致 P65 转录活性增强[19]。本实验结果表明,随着BBR的浓度逐渐增加,P65的磷酸化受到抑制。P65的磷酸化降低能够影响NF-κB DNA结合活性[20],同时,抗凋亡蛋白Bcl-2作为P65的下游靶基因,Bcl-2及其同源蛋白Bcl-xl转录水平被显著抑制[21],P65 S536位点磷酸化的下降可诱导凋亡的发生。在本研究中BBR可影响MDA-MB-231细胞的生长形态,可使细胞变小,胞质皱缩,出现细胞碎片,符合细胞凋亡的表现,同钱洁等[9]的研究一致。并且通过细胞凋亡检测发现BBR可明显促进MDA-MB-231细胞凋亡率增加,C-Caspase3活化增加,诱导了凋亡的发生。
综上所述,本研究发现BBR可呈浓度依赖性地抑制MDA-MB-231细胞的增殖、迁移并且诱导凋亡的发生。其机制可能是BBR通过对P65磷酸化的调控,抑制了P65的活性,抑制肿瘤细胞生长,诱导了肿瘤细胞凋亡的发生。本研究为BBR应用于TNBC治疗提供了一定的理论基础,但BBR抗肿瘤机制仍需进一步研究明确。

