组蛋白乙酰转移酶P300和去乙酰化酶SIRT2在乳腺浸润性导管癌中的表达*
段彦林, 金柔, 梅思思, 田世维, 黄玉鑫, 徐澍**
(1.贵州医科大学附属医院 病理科, 贵州 贵阳 550004; 2.黔南州中医医院 病理科, 贵州 黔南 558000)
乳腺癌是全球女性最常见的癌症,目前我国乳腺癌的发病率有逐年上升趋势[1]。表观遗传学发现,乙酰化失调可导致癌症的发生,组蛋白乙酰转移酶和组蛋白去乙酰化酶分别催化乙酰化和去乙酰化过程,两者的高度动态平衡维持着正常的生理机能[2-3],组蛋白乙酰转移酶P300是一种具有乙酰化活性的转录共激活子,可乙酰化多种组蛋白和非组蛋白,P300对非组蛋白的乙酰化作用可以增强与相应启动子的结合,从而激活转录活性[4],组蛋白去乙酰化酶SIRT2是一种依赖烟酰胺腺嘌呤二核苷酸去乙酰化酶,在生物的代谢、凋亡和基因转录等生命活动中起着重要作用[5]。目前关于P300和SIRT2蛋白在乳腺癌中的研究鲜有文献报道,本研究通过免疫组化的方法检测乳腺浸润性导管癌组织中P300和SIRT2蛋白的表达情况,探讨P300和SIRT2蛋白与乳腺癌临床病理特征的关系,以发现其在乳腺癌中可能存在的发病机制,为研究乳腺癌治疗新靶点提供参考。
1 材料与方法
1.1 材料
1.1.1临床资料 随访病理科2012年1月1日—2017年12月31日诊断的乳腺癌患者,完善患者年龄、月经情况、肿瘤最大径等相关临床资料,最终选取确诊前未经放化疗且有足够组织蜡块的385例患者做为病例组,收集同期癌旁2 cm以上乳腺组织蜡块36例作为对照组。385例乳腺癌患者龄27~84岁、平均50岁,患者随访时间最长者为113个月、平均随访时间62个月,随访期间无复发患者339例(88.1%)、有复发患者46例(11.9%),无转移患者379例(98.4%)、有转移患者6例(1.6%),生存患者358例(93%)、死亡患者27例(7%)。提取病例组病理诊断存档切片,由两位乳腺病理专业主任医师根据《中国抗癌协会乳腺癌诊治指南与规范(2021年版)》[6],采用双盲法对乳腺癌病理诊断和病理组织学分级进行复诊,重新判读乳腺癌分子分型。
1.1.2主要试剂 兔抗人多克隆抗体KAT3B/P300(型号ab275379)、兔抗人单克隆抗体SIRT2(型号ab19388)、HRP多聚体二抗,均购自英国Abcam公司;一抗稀释液,PBS磷酸盐缓冲液均购自北京中杉金桥公司;酒精、苏木素、二甲苯、3%过氧化氢均购自贵州永博鑫公司。
1.2 研究方法
1.2.1组织芯片及免疫组化 组织蜡块对照存档切片中选定位置进行定位,用打孔器套出蜡块中组织柱,选取高度相近的组织柱按编号顺序,经修整、包埋制成组织芯片[7]。组织芯片经切片、烤片、脱蜡、水化后采用En Vision二步法进行免疫组化染色[8]。EDTA(pH 8.0)120 ℃高压修复3 min,冷却后PBS冲洗3次,每次5 min,滴加3%过氧化氢孵育30 min,PBS冲洗3次,每次3 min,滴加一抗(KAT3B/P300检测滴度为1∶300,SIRT2检测滴度为1∶6 000),37 ℃温箱孵育1 h后PBS冲洗3次,每次5 min;加二抗温箱孵育1 h,PBS冲洗后DAB显色3 min,经苏木素复染,梯度酒精脱水,二甲苯透明后封固。
1.2.2结果判读 P300和SIRT2在胞核和(或)胞浆中出现粗颗粒状、片状黄色或棕黄色着色为阳性。由两位病理医师按双盲法随机选取10个高倍视野,计数1 000个上皮细胞,以染色强度(无表达为0分,点状淡黄色为1分,粗颗粒状和片状黄色为2分,棕黄色为3分)和阳性细胞百分比(<1%为0分,1%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分)的乘积为免疫组化结果评分(IRS)[8]。P300:IRS≤8分为低表达,>8分为高表达[9];SIRT2:IRS≤3分为低表达,>3分为高表达[10]。
1.3 统计学分析
采用SPSS 23.0软件对实验数据进行统计分析,计数资料以n(%)表示,率的比较采用χ2检验,相关性分析采用Spearman相关性进行检测,运用 Kaplan-Meier和Log rank test统计学方法分析P300和SIRT2蛋白与乳腺癌预后的相关性,以P<0.05为差异有统计学意义。
2 结果
2.1 P300和SIRT2蛋白在病例组及对照组中的表达
病例组中P300蛋白的低表达率高于对照组,SIRT2蛋白的低表达率低于对照组,差异均有统计学意义(P<0.05)。见表1、图1。

注:A为P300蛋白低表达,B为P300蛋白高表达,C为SIRT2蛋白高表达,D为SIRT2蛋白低表达。

表1 P300和SIRT2蛋白在病例组和对照组中的表达[n(%)]Tab.1 Expressions of P300 and SIRT2 proteins in case group and control group[n(%)]
2.2 病例组患者P300蛋白表达及其与临床病理特征的关系
病例组组织中P300蛋白表达结果显示:肿瘤最大径>5 cm的低表达率明显高于≤5 cm组(P<0.001),TNM分期Ⅲ~Ⅳ期的低表达率高于Ⅰ~Ⅱ期、有淋巴结转移的低表达率高于无淋巴结转移、Ki67高表达的低表达率高于Ki67低表达,差异有统计学意义(P<0.05);P300蛋白表达在患者年龄、月经情况、组织学分级中比较,差异均无统计学意义(P>0.05)。见表2。P300蛋白在LuminalB型中的低表达率高于三阴性乳腺癌(triple negative breast cancer,TNBC),差异有统计学意义(P<0.05)。见表3。

表2 P300和SIRT2蛋白表达与乳腺癌临床病理特征的关系[n(%)]Tab.2 Relationship between P300 and SIRT2 proteins expression and clinicopathological
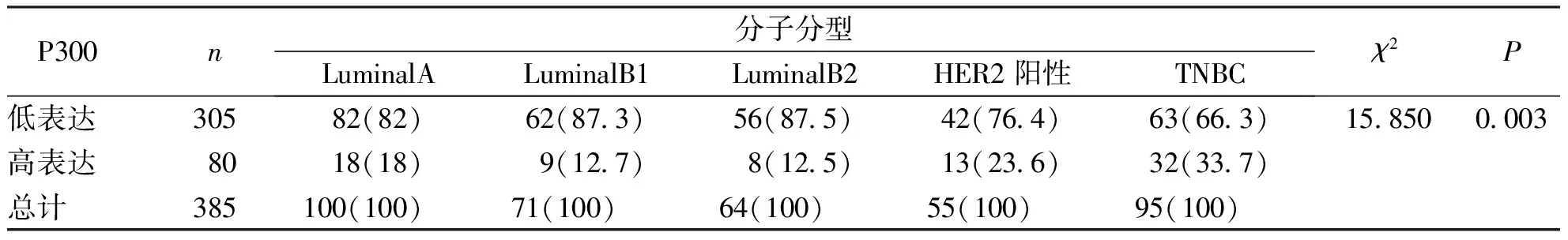
表3 P300蛋白表达与乳腺癌分子分型的关系[n(%)]Tab.3 Relationship between P300 protein expression and molecular subtypes of breast cancer[n(%)]
2.3 病例组患者SIRT2蛋白表达及其与临床病理特征的关系
病例组组织中SIRT2蛋白表达结果显示:在组织学分级3级中的低表达率低于1~2级、肿瘤最大径>5 cm的低表达率低于≤5 cm、Ki67高表达的低表达率低于Ki67低表达,差异有统计学意义(P<0.05);SIRT2蛋白表达在患者年龄、月经情况、TNM分期和淋巴结转移中的比较,差异均无统计学意义(P>0.05)。见表2。SIRT2蛋白在LuminalA型和LuminalB型中的低表达率低于HER2阳性型和TNBC,差异有统计学意义(P<0.05)。见表4。

表4 SIRT2蛋白表达与乳腺癌分子分型的关系[n(%)]Tab.4 Relationship between SIRT2 protein expression and molecular subtypes of breast cancer[n(%)]
2.4 病例组P300和SIRT2蛋白表达的相关性
病例组中P300和SIRT2蛋白的表达呈负相关,差异有统计学意义(r=-1.77,P<0.001)。
2.5 病例组患者P300和SIRT2蛋白表达及其与预后的关系
应用 Kaplan-Meier和Log-rank test统计学方法,分析P300和SIRT2蛋白表达与病例组患者无病生存期(disease-frec survival,DFS)和总生存时间(overll survival,OS)的关系,结果显示,P300蛋白低表达比高表达DFS短,总体无病生存率低,差异有统计学意义(P<0.05);SIRT2与乳腺癌患者预后无关(P>0.05)。见图2。

图2 P300和SIRT2蛋白乳腺癌预后的关系Fig.2 Relationship between P300 and SIRT2 protein in prognosis of breast cancer
3 讨论
根据2021年国际癌症研究机构发布的最新全球癌症报告显示,2020年全球185个国家新发乳腺癌2 261 419例,约占新发癌症总数的11.7%,首次超过肺癌成为最常见的癌症[1]。近年来,表观遗传学变化已公认为是导致乳腺癌进展的主要原因,表观遗传学中组蛋白乙酰化是在核心组蛋白尾部结构域内的赖氨酸残基末端添加乙酰基部分,中和了正电荷,减少DNA和组蛋白之间的静电吸附作用形成松弛的染色质,使转录因子更易与DNA结合,从而促进基因转录[2]。相反,组蛋白去乙酰化形成了致密的染色质,使DNA启动子上的转录蛋白不可接近而导致转录失活。组蛋白的乙酰化反应受组蛋白乙酰化转移酶和组蛋白去乙酰化酶控制,在肿瘤发生过程中,精细调节的乙酰化状态受损,使正常细胞的增殖、分化和凋亡发生变化,进而转化为恶性细胞,同时通过降低细胞的粘附、促进细胞迁移、侵袭和血管生成导致癌症的进一步发展[2]。除此之外,组蛋白去乙酰化酶还可以对负责细胞分化和周期调控的抑癌基因进行沉默,使细胞缺乏分化,增殖失控,从而导致肿瘤的发生[8]。组蛋白乙酰化转移酶和组蛋白去乙酰化酶表观遗传调控的可逆性使其成为治疗癌症的诱人靶点[2]。
P300蛋白是由EP300基因编码的组蛋白乙酰化转移酶,可以乙酰化许多组蛋白和非组蛋白,以调节与细胞生长、发育和肿瘤发生有关的许多信号通路,包括钙信号、缺氧应激、Notch信号和NF-κB信号通路等[11]。在乳腺癌中,BRCA1是当前研究比较成熟的肿瘤抑制基因,BRCA1蛋白在细胞周期调控、DNA 损伤修复、基因转录激活、抑制细胞生长等方面发挥着作用[12];P53蛋白是对细胞凋亡和细胞周期调节基因起调控作用的肿瘤抑制因子,P53的激活可以促进依赖性细胞凋亡[13],P300可促进BRCA1和P53这两个真正的肿瘤抑制因子发挥肿瘤抑制作用,使细胞周期保持正常,保证DNA受损后可以程序化凋亡[14]。在乳腺和结直肠原发性肿瘤和细胞系中,发现P300基因失活与癌症的发生相关[15]。在口腔癌和宫颈癌细胞系中也发现P300基因突变,在引入正常的P300基因后,细胞增殖减少[16],这些研究都提示P300具有肿瘤抑制功能。在本研究中,对比癌旁组织,乳腺癌组织中P300蛋白低表达(P<0.05);P300蛋白在肿瘤直径大、TNM分期高、有淋巴结转移和Ki67高表达的乳腺浸润性导管癌中低表达(P<0.05),P300蛋白低表达的乳腺癌患者DFS短(P<0.05),表明P300蛋白可能抑制乳腺乳腺浸润性导管癌的发生、发展。
SIRT2是Sirtuins蛋白家族成员之一,Sirtuins家族参与一些重要的生理过程,如参与调节细胞代谢、增殖、凋亡、DNA损伤修复、细胞应激、基因表达调控等。SIRT2作为组蛋白去乙酰化酶,通过使不同的底物蛋白去乙酰化,发挥其生理和病理作用的重要功能。SIRT2可以使P53去乙酰化,降低其转录活性,并导致阻断P53依赖性凋亡以响应DNA损伤,促进细胞增殖,SIRT2基因敲除可诱导P53的积累并促进癌细胞凋亡[13]。叉头框蛋白O3(forkhead box protein O3,FOXO3)是一种肿瘤抑制因子,参与细胞周期控制以及抗氧化和DNA损伤修复途径,SIRT2对FOXO3的去乙酰化导致其泛素化和随后的降解,从而促进细胞周期进展并促进癌症的发生[17]。SIRT2可以促进线粒体代谢,抑制E-钙蛋白途径,从而促进癌细胞的侵袭[18];SIRT2使微管蛋白去乙酰化,促进细胞运动[19];另有研究发现,SIRT2可以增强肿瘤细胞突破基底膜的能力,使肿瘤细胞获得高侵袭能力[20];SIRT2在基底样型乳腺癌(basal-like breast cancer,BLBC)样本中被扩增并高度表达,它与Slug蛋白相互作用并使其脱乙酰化,并促进蛋白酶体降解Slug,从而促进癌细胞的侵袭[21];通过促进乳腺癌小鼠模型中的C-MYC泛素化和降解,抑制SIRT2也显示出抗癌作用[22]。在以往的研究发现,SIRT2在胃癌、结直肠癌、干细胞样肾细胞癌细胞中高表达[5]。在本研究中,与癌旁组织相比,SIRT2蛋白在乳腺浸润性导管癌组织中的低表达率低(P<0.05),在组织学分级高、肿瘤直径大和Ki67高表达组织中的低表达率低(P<0.05),表明SIRT2可能促进乳腺浸润性导管癌的发生、发展。SIRT2在Luminal型中的低表达率,低于其在HER2阳性型和TNBC中的低表达率(P<0.05)。Luminal型乳腺癌特征是ER/PR的表达,SIRT2作为一种组蛋白去乙酰化酶可能会影响性激素受体在乳腺癌中的表达[23],进一步表明SIRT2高表达是乳腺癌发生的一个危险因素,但具体作用机制仍待更多的研究证明。P300和SIRT2作为组蛋白乙酰化转移酶和去乙酰化酶,两者的高速动态平衡维持着细胞的正常生理功能,本实验中SIRT2和P300呈负相关,表明两者在乙酰化机制中互相拮抗,与以往研究一致。
综上所述,P300和SIRT2蛋白可能与乳腺浸润性导管癌的发生、发展相关,P300蛋白低表达可能提示乳腺浸润性导管癌患者预后较差。

