腹腔镜结直肠癌根治术联合微波消融术与联合腹腔镜肝切除术的疗效比较*
吕鲁闽, 卓忠贵
(福建省立医院武夷山分院 普外科, 福建 武夷山 354300)
结直肠癌(carcinoma of colon and rectum, CRC)是最常见的恶性消化道肿瘤之一,占全部恶性肿瘤的10.6%。结直肠癌的发病率位居所有恶性肿瘤的第3位,死亡率位居所有恶性肿瘤的第2位[1]。CRC发生远处转移最常见的器官为肝脏,15%~25%的患者就诊时已发生肝转移[2]。一期同步切除是目前常用的手术治疗方式[3]。目前有研究发现腹腔镜一期同步切除术后长期预后方面与开腹术后相比有一定优势[4]。另有研究显示,腹腔镜结直肠癌根治联合术中射频消融与腹腔镜结直肠癌根治联合开放肝切除对比,长期预后相似,但射频的肿瘤直径较小[5]。随着腹腔镜肝切除技术的发展,腹腔镜结肠癌根治联合腹腔镜肝切除也得到越来越多的开展,然而腹腔镜肝切除仍主要在大型医院开展,技术要求高,而微波消融技术目前得到较广泛的运用[6]。目前腹腔镜结直肠癌根治联合肝肿瘤微波射频消融对比腹腔镜结直肠癌根治联合腹腔镜肝切除在结直肠癌肝转移的优劣尚未见研究,因此本研究通过回顾性分析59例结直肠癌肝转移并行直肠癌根治术患者的临床病例资料,对比腹腔镜结直肠癌根治联合肝肿瘤微波消融与腹腔镜结直肠癌根治联合腹腔镜肝切除的疗效,报告如下。
1 对象与方法
1.1 研究对象
回顾性收集2014年1月—2021年12月收治的59例结直肠癌肝转移患者临床和病理资料。所有病人均经术后病理确诊,其中男39例、女20例,腹腔镜结直肠癌根治术联合微波消融术28例,腹腔镜结直肠癌根治术联合腹腔镜肝切除术31例。纳入标准:(1)经术后病理确诊为结直肠癌肝转移;(2)结直肠癌原发病灶可行根治性切除;(3)肝转移灶可行根治性切除;(4)肿瘤无除肝转移外的远处转移;(5)无麻醉禁忌症。排除标准:(1)无法耐受手术;(2)残余肝脏体积不足;(3)合并除肝脏以外其他器官转移;(4)病例资料缺失。
1.2 治疗方法
腹腔镜结直肠癌根治联合微波消融组:患者取分腿位,气管插管全麻后建立气腹,气腹压力维持14 mmHg;Trocar布孔采用5孔法(脐下、剑突下、右腋前线平脐部、左肋缘下腋中线、右肋缘下腋中线),根据原发肿瘤所在部位行对应的结直肠癌或直肠癌根治术,并清扫肠系膜血管淋巴结,重建消化道;将网膜或其他组织脏器剥离肝脏,肝转移灶行术中超声定位,定位后将微波针在超声引导下穿刺如肿瘤组织中心,设置消融功率80~100 W 不等,消融时间5~10 min ,对于直径≤3 cm 的病灶行单次消融;肿瘤>3 cm 病灶采取多点重叠消融;射频后再次行超声造影检查确保无残留病灶。腹腔镜结直肠癌根治联合腹腔镜肝切除组:切除结肠原发灶方法同前,之后根据肝脏肿瘤所在部位增加1~2个上腹部Trocar;离断三角韧带、冠状韧带和镰状韧带后进行超声探查,标记肿瘤所在部位,随后采取第一肝门阻断,麻醉控制中心静脉压<5 cm H2O,超声刀沿肿瘤边缘切除肿瘤,断面胆管或血管予动脉夹或钛夹夹闭,切除肿瘤后断面彻底止血。
1.3 观察指标
1.3.1围术期及术中情况 (1)术前资料:年龄、性别、体质量指数(BMI)、ASA分级、基础疾病、Child-pugh分级、转氨酶、胆红素、血清白蛋白、原发肿瘤部位、肝转移肿瘤部位、肿瘤个数、肿瘤直径。(2)术中指标:手术时间、术中出血量。(3)术后指标:并发症、严重并发症(Clavien-Dindo≥3分)、肺部感染、腹腔感染、肠瘘、胆瘘、切口感染、住院期间死亡、术后肝功能[术后第1天、第3天谷丙转氨酶(ALT)、谷草转氨酶(AST)、胆红素(TBiL)、白蛋白(ALB)]、术后排气时间及术后住院天数。
1.3.2生存情况术后无瘤生存期(progression-free survival,PFS)为手术日开始至患者肿瘤复发或调查截止的时间和总体生存期(overall survival,OS)为手术日开始至患者死亡或调查截止的时间。
1.3.3随访采用门诊和电话随访患者肿瘤复发及生存情况,患者随访至2022年1月。
1.4 统计学处理
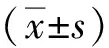
2 结果
2.1 一般资料
腹腔镜结直肠癌根治联合微波消融组和腹腔镜结直肠癌根治联合腹腔镜肝切除组患者性别、年龄、BMI、ASA分级、基础疾病、术前肝功能、原发肿瘤部位、肝转移肿瘤部位、肿瘤个数、肿瘤直径等方面比较,差异无统计学意义(P>0.05)。见表1。

表1 结直肠癌跟转移患者术前一般资料比较Tab.1 Preoperative general information comparison between patients with CRC and liver metastases
2.2 术中情况
如表2所示,腹腔镜结直肠癌根治联合微波消融组和腹腔镜结直肠癌根治联合腹腔镜肝切除组患者均无中转开腹,腹腔镜联合腹腔镜肝切除组的手术时间和术中出血量均高于腹腔镜联合微波消融组(P<0.05)。

表2 结直肠癌跟转移患者术中和术后情况比较Tab.2 Intraoperative and postoperative conditions comparison between patients with CRC and liver metastases
2.3 术后情况
腹腔镜结直肠癌根治联合微波消融组和腹腔镜联合腹腔镜肝切除组对比在术后总体并发症率、严重并发症率、肺部感染、腹腔感染、肠瘘、胆瘘、切口感染、住院期间死亡、术后排气时间、术后住院天数、术后第1天和第3天时TBiL上比较,差异无统计学意义(P>0.05);腹腔镜结直肠癌根治联合腹腔镜肝切除组在肺部感染率以及术后第1天、第3天时ALT、AST、ALB均高于腹腔镜结直肠癌根治联合微波消融组(P<0.05);见表2。腹腔镜结直肠癌根治联合微波消融组中1例患者发生严重并发症为严重腹腔感染。腹腔镜联合腹腔镜肝切除组中2例患者发生严重并发症,其中1例发生肠瘘,1例患者因术后肝功能衰竭死亡。
2.4 随访情况
所有患者均获得随访,中位随访时间为27个月。腹腔镜结直肠癌根治联合微波消融组与腹腔镜结直肠癌根治联合腹腔镜肝切除组比较,OS、PFS差异有统计学意义(P<0.05)。见图1。肝脏单发转移瘤患者与肝脏多发转移瘤患者比较,OS、PFS比较,差异有统计学意义(P<0.05)。见图2。肝脏转移瘤直径>3 cm患者与肝脏转移瘤直径≤3 cm患者比较,OS、PFS比较,差异有统计学意义(P<0.05)。见图3。

图1 两组患者OS和PFS曲线Fig.1 PFS and OS curves for patients undergoing laparoscopic radical resection of CRC combined with laparoscopic hepatectomy versus MWA

图2 肝转移灶单发和肝转移灶多发患者OS和PFS曲线Fig.2 PFS and OS curves for patients with single versus multiple liver metastases

图3 肝转移灶直径≤3 cm和>3 cm患者OS和PFS曲线Fig.3 PFS and OS curves for patients with liver metastasis diameter ≤3 cm versus >3 cm
2.5 多因素分析
对影响患者OS和PFS的因素进行单因素和多因素分析,显示腹腔镜结直肠癌根治联合微波消融、肝转移瘤多发和肝脏转移瘤直径>3 cm是影响结直肠癌肝转移患者手术治疗OS和PFS的独立危险因素。见表3。

表3 结直肠癌肝转移患者PFS和OS的影响因素分析Tab.3 Analysis of factors influencing PFS and OS in patients with liver metastasis from CRC
3 讨论
结直肠癌极易发生肝转移,约20%结直肠癌患者就诊时已发生肝转移[3]。研究显示结直肠癌肝转移患者行原发灶和肝转移灶切除可使患者获得更长的生存时间[7]。随着外科手术技术不断提高,目前一期同步切除结直肠原发病灶,并行肝转移灶切除或消融已经成为常用的治疗方式[8]。随着腹腔镜技术的发展,腹腔镜结直肠癌根治术在各级医院广泛开展[9]。在大型医院,结直肠癌原发灶和肝转移灶的一期切除也采用腹腔镜进行,但腹腔镜肝切除仍然要求较高的技术水平,需要较长的学习时间。目前微波消融在肝转移瘤的运用越来越广泛,具有创伤小、安全性高的特点,但主要运用于直径较小的转移灶,在大体积的转移瘤上行微波消融的可行性及远期随访仍有待于研究[10]。本研究对腹腔镜结直肠癌根治联合腹腔镜肝切除和腹腔镜结直肠癌根治联合微波消融的安全性和有效性以及远期疗效进行了分析。本研究显示腹腔镜结直肠癌根治联合腹腔镜肝切除组的OS和PFS均优于腹腔镜结直肠癌根治联合微波消融组,且多因素回归也显示腹腔镜结直肠癌根治联合腹腔镜肝切除是结直肠癌肝转移患者OS和PFS的保护因素。本研究分析其原因可能有以下方面,首先对于大直径的肿瘤,微波消融消融范围难以一次完全覆盖,有研究认为对于直径>3 cm的转移瘤通过多重微波消融也可以达到肝切除相似的疗效[11-12]。但在本研究的病例中发现对于直径>3 cm肿瘤行微波消融,往往在消融边缘早期出现肿瘤复发,这说明多重消融可能对于大体积的肿瘤存在部分肿瘤区域仍难以覆盖的缺点。一项META分析显示结直肠癌肝转移行消融术的复发率更高,远期生存率更低[13],这与本研究的结果一致。也有研究显示对于<5 cm的肝脏肿瘤行射融术效果与肝切除术相似[14-15],而对于>6 cm以上肝脏肿瘤微波消融的肿瘤复发率较手术切除更高[16]。另外本研究发现对于位于肝脏表面的肿瘤微波消融同样也存在消融不全的风险,本研究术中观察少数患者存在微波消融对于突出肝脏表面肿瘤消融不完全的情况,需行手术切除。此外有研究认为对于特定患者如肝转移瘤直径>3 m或KRAS/NRAS/BRAF突变或原发灶为右半结肠癌的患者行规则性肝切除能使患者生存获益,可显著延长中位PFS[17-19],更说明了行手术治疗较微波消融的优势。而对于新辅助患者考虑化疗药物对肝脏的损害,要求尽可能保留多的肝实质,因此这部分病人目前推荐行局部切除[20-22]。
在术中及围手术期安全方面,本研究显示腹腔镜肝切除组的手术时间明显长于微波消融组,术中出血量也多于微波消融组,因此微波消融具有更高的术中安全性,且技术较腹腔镜肝切除更容易掌握[23]。目前研究表明,对于直径>3 cm的肝肿瘤,采用多重消融可能因为输出能量过大,引起邻近器官的热损伤[24-25]。本研究显示在术后并发症中,微波消融组和腹腔镜肝切除组,均可引起肺部感染,这与腹腔镜肝切除需要大量游离肝周韧带,切除肝组织刺激膈肌引起反应性肺部炎症有关。而微波消融组中在对于部分位于肝脏膈顶部的肿瘤需经胸腔进行射频,或膈肌热损伤引起炎症反应,这是造成肺部感染的主要原因。本研究并未发现脉管血栓、胆道损伤等少见并发症,这些并发症被认为与操作者经验相关[26]。腹腔镜肝切除中有1例出现胆瘘,这是由于肝切除断面部分小胆管为术中能量器械凝闭,术后这些小胆管可引起胆瘘。两组患者的术后排气时间和术后住院时间无明显区别,证明了腹腔镜结直肠癌根治联合腹腔镜肝切除在术后恢复方面具有和微波消融组相同的优势。
本研究进行亚组生存分析和多因素回归还显示肝脏多发转移瘤和转移瘤直径>3cm是影响结直肠癌肝转移的预后的独立危险因素,这与目前已有的研究结论相符合[12,27]。本研究存在一定局限性,首先本研究为回顾性研究,且入组患者较少,因此会产生一定偏倚。但本研究纳入患者基本资料较为均衡,具有较好的可比性。
综上所述。腹腔镜结直肠癌根治联合腹腔镜肝切除治疗结直肠癌肝转移较腹腔镜结直肠癌根治联合术中微波消融更具有更好的预后,且术后并发症率并不增加。

