金黄色葡萄球菌耐药机制及治疗药物
罗丹,马世伟,王哲,*
(1 上海交通大学农业与生物学院,上海 200240;2 上海市兽医生物技术重点实验室, 上海 200240)
金黄色葡萄球菌(Staphylococcusaureus)是一种常见的人兽共患的条件性致病细菌。金黄色葡萄球菌产生的多种毒素(溶血毒素、杀白细胞素和肠毒素等)和酶可引起包括局部化脓性感染和全身血液系统感染在内的多种疾病,严重者还易发展成心包炎和败血症等[1]。在兽医临床上,金黄色葡萄球菌是引起奶牛乳房炎的罪魁祸首,给养殖业和乳制品行业造成巨大的经济损失[2]。
抗生素的发现,是20世纪巨大的医学成就。但由于抗生素的广泛使用甚至滥用,促使病原微生物进化出抗微生物药物耐药性,每年至少可造成70万人的死亡[3]。其中,耐甲氧西林金黄色葡萄球菌(Methicillin-resistantStaphylococcusaureus,MRSA)、耐万古霉素金黄色葡萄球菌(Vancomycin resistantStaphylococcusaureus,VRSA)的广泛存在与快速传播对全球公共卫生安全造成巨大威胁。
当前,细菌耐药性问题已成为全球科学家关注的焦点。研究表明[4],金黄色葡萄球菌能够通过复杂多样的耐药机制逃避药物的杀伤。其不仅可以通过改变外膜通透性、利用染色体编码的外排泵和产生抗生素修饰酶和水解酶,来启动固有耐药(Intrinsic resistance)机制对抗生素产生耐药性。此外,还可以通过基因突变和获得外源性耐药基因,启动获得性耐药机制(Acquired resistance)从而影响细菌对抗生素的敏感性。
本文从主要的细胞靶标(即细胞被膜、核酸合成和蛋白质合成)角度出发,对目前应用于治疗人类感染和/或用于畜牧业药物的抗性机制进行了综述,并对正在开发的新药物和新靶点抑制剂进行了讨论,希望本综述能够对研究金黄色葡萄球菌的耐药机制或者确定新的治疗策略提供一定的参考价值。
1 细胞被膜合成抑制剂
1.1 β-内酰胺类抗生素
青霉素能够与青霉素结合蛋白(Penicillin binding protein,PBP2)结合,从而干扰肽聚糖的生物合成[5]。blaZ基因编码β-内酰胺酶,可水解青霉素,使药物失活[6]。blaZ基因表达受到blaI和blaR1基因调控,blaI基因编码blaZ基因负调控蛋白BlaI,抑制blaZ基因转录;blaR1基因编码相关信号转导蛋白BlaR1则可解除这种抑制作用。为应对青霉素耐药在全球范围的内扩散,半合成耐青霉素酶类药物,如甲氧西林以及后来的苯唑西林被开发用于临床。但在甲氧西林用于临床治疗的同一年(1966年),临床便分离得到一株MRSA[7]。
MRSA通过水平转移获得了由mecA基因编码的PBP2a蛋白。由于PBP2a对大多数β-内酰胺类药物亲和力较低,能够保证细菌正常的肽聚糖生物合成,因此获得了对β-内酰胺类药物的耐药性[8]。mecA基因位于金黄色葡萄球菌染色体盒(Staphylococcalchromosome cassette,SCC)中,该染色体盒中还存在其他的耐药基因,可产生对其他抗生素和有害物质(例如重金属)的耐受性[9-10]。mecA基因转录受到blaR1/blaI和mecRI/mecI两套系统的控制,mecI和blaI基因编码阻遏蛋白,抑制mecA基因的表达,而mecRI和blaR1分别编码相关传感器和诱导蛋白,解除阻遏蛋白的抑制作用。除mecA主要结构基因外,金黄色葡萄球菌对β-内酰胺类抗生素耐药水平的高低还受到细菌染色体上辅助基因的调控,包括femA、agr和sar等。
此外,家畜相关MRSA(Livestock associated MRSA,LA-MRSA)ST398 SCCmec V 型已成为一个严重的公共卫生问题。LA-MRSA ST398不仅可以感染猪、牛、羊和鸡等多种动物,还可以通过环境和食物链等途径引发人群感染[11]。有报道[12-13]称,在猪LA-MRSA ST398分离株中,发现了由质粒携带的新的耐药基因,如甲氧苄啶耐药基因dfrK和林可酰胺/截短侧耳素/链霉素A外排泵基因vga(C)。
1.2 糖肽类抗生素
万古霉素是治疗MRSA感染的首选药物之一。随着药物的广泛使用,临床上出现了不同程度的耐万古霉素的MRSA分离株。其中,中间耐药金黄色葡萄球菌(Vancomycin intermediateStaphylococcus aureus,VISA)是万古霉素临床治疗失败的重要原因。在长期的药物压力下,VISA细胞壁生物合成及稳态相关基因突变,导致其细胞壁结构发生改变、厚度增加和肽聚糖交联减少,提供了大量错误的D-Ala-D-Ala靶点[14]。此外,MRSA从肠球菌中获得了vanA操纵子,导致了高度耐药性VRSA的出现[15-16]。
目前,特拉万星和奥利万星等半合成脂糖肽类药物已被批准用于治疗急性细菌性皮肤软组织感染。这些药物不仅可以抑制细菌肽聚糖合成,还可以裂解细菌细胞膜[17-18]。
1.3 达托霉素
达托霉素(Daptomycin,DAP)在治疗MRSA感染引起的菌血症和心内膜炎中发挥重要作用[19-20]。然而,高水平药物压力导致MRSA自发突变,产生耐药性。例如,mprF基因促进带有正电荷的赖氨酸-磷脂酰甘油(Lys-PG)的合成,从而排斥带有正电荷的钙-DAP复合物靶向细胞膜[21-22]。其次,细菌也可以通过释放游离的PG,与钙-DAP复合物结合,干扰复合物插入细胞膜[23]。此外,细胞壁增厚也会影响DAP穿透细胞膜,提示VISA分离株的流行是获得DAP高度耐药性的主要风险因素之一[24]。
2 核酸合成抑制剂
2.1 氟喹诺酮类抗生素
氟喹诺酮类药物通过抑制DNA双链连接,导致细菌死亡[25]。金黄色葡萄球菌对氟喹诺酮类药物的耐药机制主要有2种。包括由grlA基因(编码拓扑异构酶Ⅳ)和gyrA基因(编码DNA解旋酶)突变导致的药物亲和力下降;以及PknB激酶磷酸化调节蛋白MgrA,MgrA与不同nor基因(norA、norB和norC)的启动子结合,调控外排泵基因的表达[26]。其中norA主要泵出亲水性的环丙沙星和诺氟沙星[27],而norB和norC则可泵出疏水性的司帕沙星和莫西沙星。
2.2 利福平和复方磺胺甲恶唑
利福平是一种广谱性杀菌抗生素,临床上主要用于治疗结核病。此外,利福平也常作为辅助抗生素,与β-内酰胺类或糖肽类抗生素联用,治疗金黄色葡萄球菌引起的菌血症和心内膜炎[28]。细菌对利福平的耐药性很容易产生,主要原因是编码RNA聚合酶β亚基的rpoB基因发生突变,导致药物亲和力降低[29]。
复方磺胺甲恶唑是甲氧苄啶与磺胺甲恶唑的混合物[30],通过抑制叶酸生物合成(二氢叶酸合酶和二氢叶酸还原酶)来干扰细菌代谢,发挥抑菌作用。据报道[30],金黄色葡萄球菌对这2种药物的耐药率很高,其耐药性主要源于药物靶点突变,导致药物与靶点亲和力下降,包括编码二氢叶酸还原酶的dfrB基因突变,以及dfr家族其他基因,如dfrA、dfrG和dfrK基因的突变[31]。
3 蛋白质合成抑制剂
细菌核糖体是蛋白质合成的工厂,蛋白质合成主要分为翻译起始、延伸、终止和核糖体再循环四个环节(如图1A所示)。金黄色葡萄球菌可通过产生灭活酶和药物修饰酶、染色体突变、靶点修饰与保护和外排作用等机制,能够对蛋白质合成抑制剂(30S和50S核糖体抑制剂)产生耐药性(图1B)。
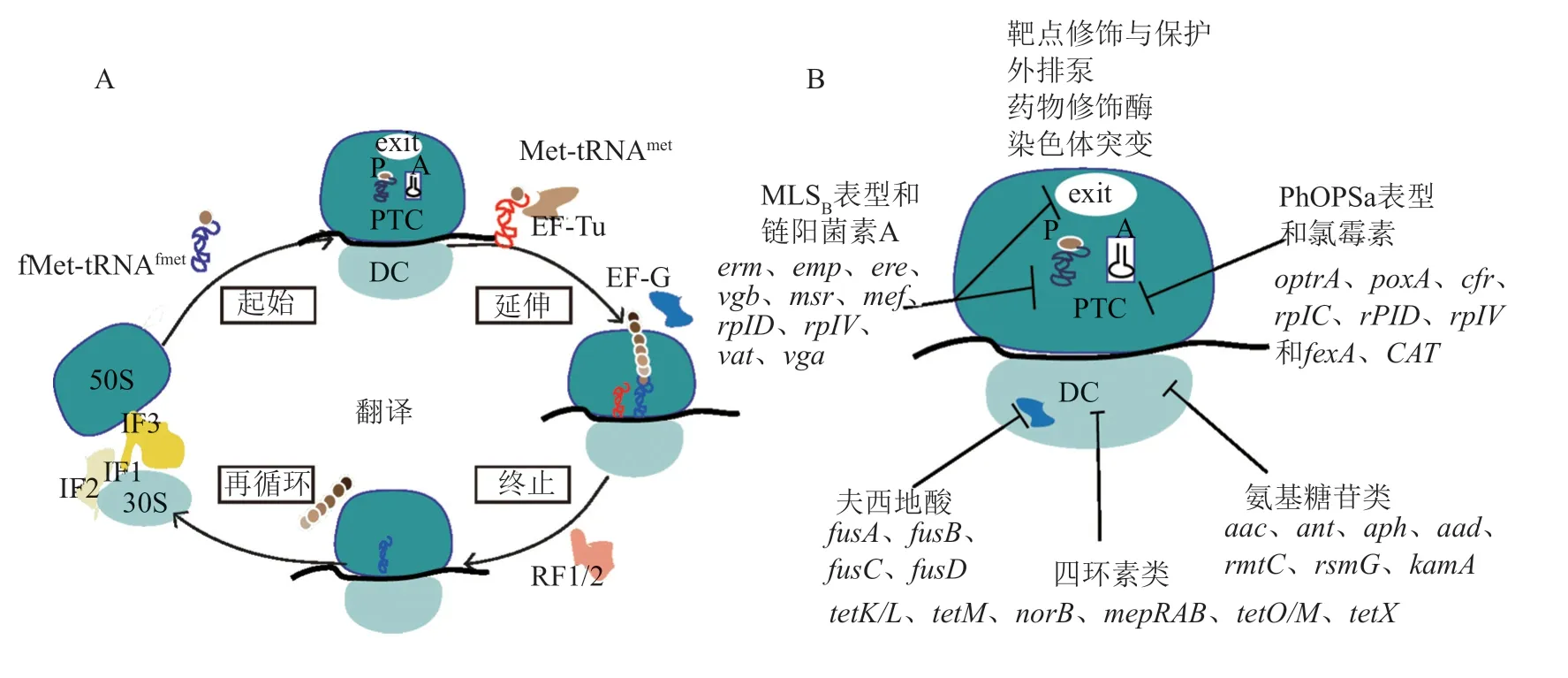
图1 蛋白质生物合成的过程及其抑制剂耐药机制图解
3.1 30S 核糖体抑制剂
3.1.1 四环素类抗生素
四环素类药物是一种广谱型抗菌药物,是养殖业中应用最为广泛的抗菌药物之一。四环素类抗生素的耐药机制包括外排作用、核糖体保护蛋白和酶促降解机制[32]。
在葡萄球菌中,Tet(K)和Tet(L)是最常见的四环素特异性外排泵。2021年Wang等[33]报告了在葡萄球菌属中赋予替加环素和依拉环素抗性的新型 Tet(L)外排泵变体Tet(L)F58L和Tet(L)A117V,这导致药物治疗MRSA失败。2021年Yang等[34]首次描述了含有四环素串联基因tet(61)-tet(58)的质粒,该质粒能够在细菌中复制和表达四环素抗性。此外,mepRAB操纵子突变和rpsJ基因(编码核糖体S10蛋白)突变也与四环素类药物敏感性降低密切相关。其中,mepR的突变导致了多药外排泵MepA的过度表达。
四环素核糖体保护蛋白(Ribosomal protection protein,RPPs),是与延伸因子(Elongation factor, EF)EF-G和EF-Tu具有高度同源性的GTP酶。RPPs TetO/TetM决定簇通常位于染色体的接合转座子上,与EF-G竞争重叠结合位点,依赖GTP水解,将四环素释放,从而赋予对四环素、米诺环素和多西环素的抗性[35]。然而,在D环C-9位含有侧链的其他四环素类药物,如替加环素、依拉环素和奥马环素,通常在 RPPs蛋白存在下保留翻译抑制和抗菌活性[36]。
此外,tet(X)编码黄素依赖性单加氧酶,能够钝化或灭活四环素酶。tet(X)及其变异体具有质粒和转座子的共轭性质,在农业和水产养殖细菌中广泛存在,可能引起超级耐药菌在“动物—环境—人类”链条中快速传播。
3.1.2 氨基糖苷类抗生素
氨基糖苷类修饰酶 (Aminoglycosides modifying enzyme,AME) 在氨基糖苷类抗性机制中发挥重要作用。AME编码基因通常位于质粒、转座子或整合子等移动元件上,根据产生的修饰分类为氨基糖苷类乙酰转移酶 (Aminoglycosidesacetyltransferase,AAC)、核苷酸转移酶 [也称为腺苷转移酶 (Aminoglycosides-nucleotidyl transferase,ANT)]和磷酸转移酶(Aminoglycosides-phosphotransferase,APH)[37]。庆大霉素和新霉素耐药性由Tn4001编码的aacA-aphD所赋予[38]。新霉素耐药性由Tn5405编码的aphA或aadD引起[39]。
此外,药物结合位点的修饰也可以降低药物对其靶标的亲和力。例如,16SrRNA甲基转移酶(RmtC、KamA)甲基化核糖体中的氨基糖苷类结合位点[40]。甲基转移酶KsgA失活,出现对春雷霉素的适度抗性,RsmG(也称为GidB)失活会导致低水平的链霉素耐药性[41]。
3.2 50S 核糖体抑制剂
3.2.1 大环内酯—林可酰胺—链霉素B (MLSB) 表型
大环内酯类、林可酰胺类和链霉素B(MLSB)以同样的方式抑制细菌蛋白质的合成[42]。葡萄球菌大环内酯类耐药的三个主要机制是:细菌核糖体的修饰(erm基因),外排泵外排机制(msr基因),以及酶失活,前两种机制对金黄色葡萄球菌耐药性的发展起着关键作用[43]。
靶位修饰由erm基因介导,通过编码腺苷酸-N-甲基转移酶使23SrRNA甲基化,减少MLSB类药物与细菌核糖体靶位点的结合,导致交叉耐药性。其中,ermA和ermC基因是导致MRSA分离株MLSB耐药的重要原因。此外,核糖体蛋白L4(rplD)和L22(rplV)的突变也表现为MLSB耐药[44]。
msr基因编码ATP结合盒(ATP-binding cassette,ABC)转运蛋白,具有ATP依赖性外排泵活性。从金黄色葡萄球菌分离出对大环内酯类具有抗性的msr(A)和mef(A)可以发挥保护性蛋白质的作用,导致 23SrRNA亚基上的抗生素结合位点被阻断。最近,Fernandez等[45]在金黄色葡萄球菌的基因组岛中发现了新的mef(D)、msr(F)和msr(H)大环内酯类抗性基因,这可能有助于葡萄球菌科物种之间耐药性的传播。此外,大环内酯类的酶失活与empC、ereA和ereB编码的酯酶的存在有关,磷酸转移酶MphB也在金黄色葡萄球菌的大环内酯抗性发展中发挥作用。
3.2.2 达福普汀/奎奴普汀(Synercid)
达福普汀/奎奴普汀(Synercid)是一种链阳菌素类药物的混合物,链阳菌素A与核糖体P位点结合,链阳菌素B阻塞肽出口通道的入口,从而阻断蛋白质翻译[46]。其中,链阳菌素A的耐药性通常是由乙酰转移酶编码基因(vatA、vatB和vatC)或假定的外排泵基因(vgaA和vgaB)的存在导致的。此外,vgb基因产物也可以通过环状缩肽的线性化使 B 型链阳菌素失活[47]。
3.2.3 恶唑烷酮类
氯霉素乙酰转移酶(Chloramphenicol acetyltransferase,CAT)导致的药物失活是金黄色葡萄球菌对氯霉素耐药的最常见机制[48]。CAT可灭活氯霉素和甲砜霉素,但不能灭活氟苯尼考,因此,CAT引起的耐氯霉素菌株仍对氟苯尼考敏感 。
此外,氯霉素/氟苯尼考外排蛋白FexA和介导利奈唑胺耐药的23SrRNA甲基转移酶Cfr也能够引起氯霉素耐药[49]。cfr基因编码RNA甲基转移酶,介导23SrRNA A2503的甲基化,降低了大多蛋白质合成抑制剂的亲和力,赋予“PhLOPSa”(苯酚、林可酰胺、恶唑烷酮、截短侧耳素和链霉素 A)抗性表型[50-51],这些药物均为目前用于人类和/或兽医学的重要抗菌药,因此,人类葡萄球菌病原体cfr基因的动物宿主问题成为了广泛关注的重点[52-53]。据报道[54],在中国高达5%的猪、鸡和鸭的凝固酶阴性葡萄球菌分离株含有cfr基因。同时,在中国、美国以及爱尔兰等国家都有人类感染携带cfrMRSA的病例报道[55]。
利奈唑胺是第一个获批应用于临床的恶唑烷酮类药物。磷酸泰地唑胺作为最新一代恶唑烷酮类药物,对多重耐药葡萄球菌和肠球菌均具有活性[56]。革兰阳性菌对恶唑烷酮类药物产生耐药的原因主要包括:cfr基因介导23SrRNA A2503的甲基化,23S rRNA基因Ⅴ结构区突变 (C2161T、G2576U 、U2500A、G2447U),核糖体蛋白L3、L4和L22(分别由rplC、rplD和rplV编码)突变,以及通过基因optrA编码的ABC转运蛋白外排泵[57]。
OptrA属于ATP结合盒(ABC)转运蛋白F家族,该亚家族还包括与多种耐药性相关的Vga、Lsa、Sal和Msr蛋白[58]。目前为止,optrA基因的抗性机制存在多种假说:一种假说认为其与msr或vga基因类似,通过外排减少目标抗生素在细胞内积累,形成耐药;另一种认为其与Vga和Lsa蛋白类似,通过直接作用于核糖体而产生抗性表型。值得注意的是,在意大利[59]分离的高度耐利奈唑胺MRSA中检测到一种新的耐药基因poxtA,该基因编码ABC转运蛋白F家族核糖体保护蛋白,可导致PhLOPSa抗性表型。尽管恶唑烷酮类药物尚未获准用于兽医,但在来源于动物和环境的肠球菌中,检测到越来越多的利奈唑胺耐药基因。如2015年,Wang等[60]首次报道了动物源和人源粪肠球菌中由质粒介导的optrA基因。因此,要进一步加强畜禽临床用药规范管理和耐药基因流行的监测。
3.3 夫西地酸和莫匹罗星
夫西地酸 (Fusidic acid,FA)通过干扰延伸因子EF-G从核糖体中的解离来抑制细菌蛋白质合成。由于FA的广泛使用,近年来其耐药率显著上升[61-62]。EFG(fusA)及获得性耐药基因编码的相关蛋白(fusB、fusC和fusD)突变,阻碍FA与EF-G 结合,产生耐药性[63-65]。
莫匹罗星是一种局部外用抗生素,常用于鼻前庭金黄色葡萄球菌去定植的研究和MRSA感染的治疗[66]。莫匹罗星通过干扰异亮氨酰-tRNA合成酶(Isoleucyl-tRNA synthetase,IleRS)活性抑制细菌蛋白质合成。大多数莫匹罗星高度耐药的分离株都携带了含有mupA基因(编码一种新的IleRS)的质粒[67]。
通过对质粒中mupA基因侧翼插入序列的鉴定,发现mupA基因在质粒之间的移动是通过重组完成的。这些质粒通常也携带了其他抗菌药物的耐药性决定因素,导致大环内酯类、庆大霉素、四环素类和甲氧苄啶的耐药性。有研究报道[67]了一种新基因mupB是造成高水平莫匹罗星耐药的原因之一,而IleRS染色体编码基因点突变会引起莫匹罗星低水平耐药[68]。
4 新药物和新靶点抑制剂
目前抗菌药物的开发仍聚焦于细胞被膜、核酸和蛋白质生物合成三大靶点,并且通过药物组合的方式以期达到对抗耐药细菌的目的。截至2021年3月,全球处于临床开发阶段的43种抗生素中有17种被认为具有潜力治疗金黄色葡萄球菌感染引起的疾病(表1)。
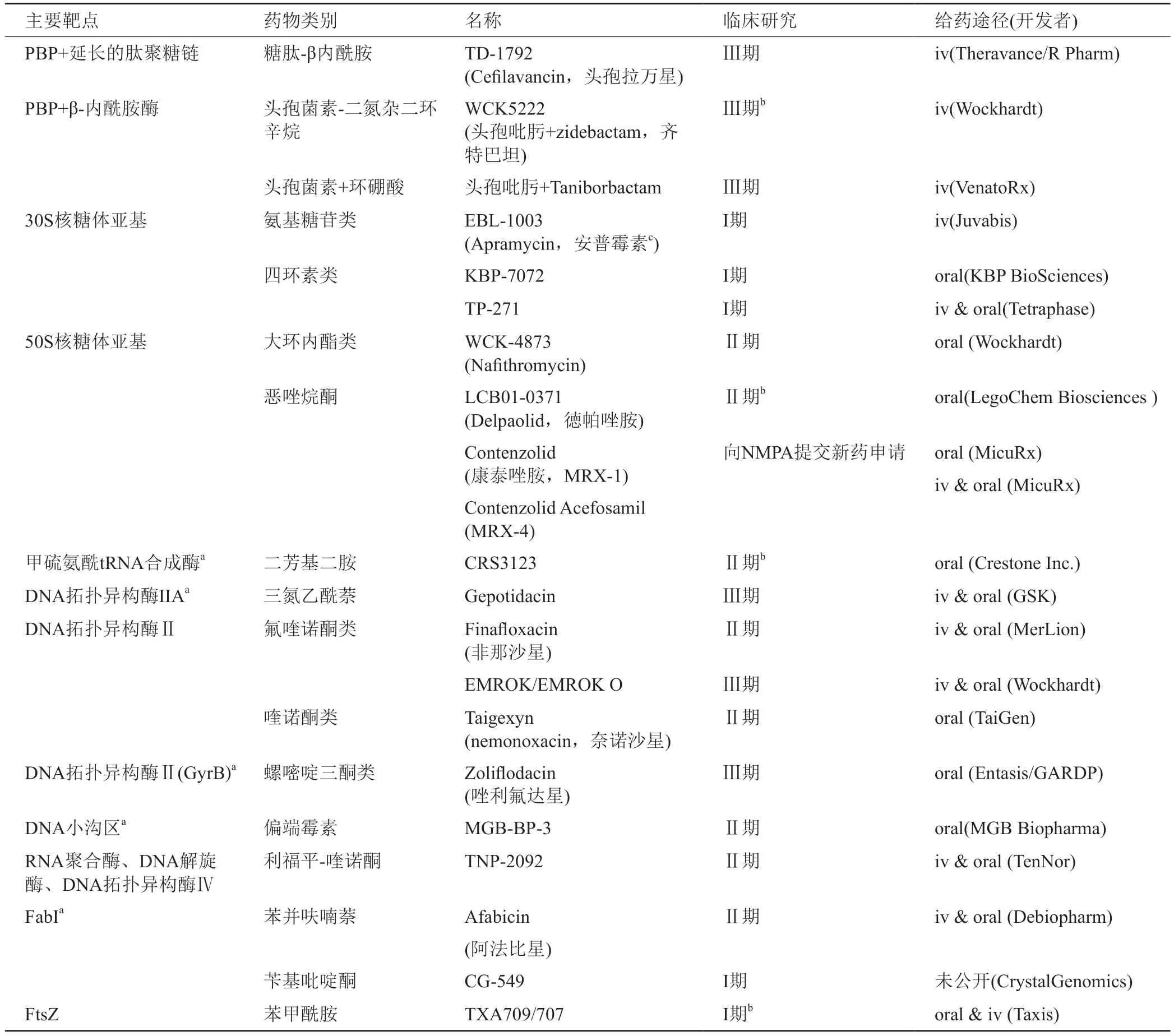
表1 全球临床开发阶段的抗生素[69]
4.1 抑制磷壁酸(Teichoic acid)生物合成
磷壁酸是革兰阳性菌细胞壁的重要组成部分,包括壁磷壁酸(Wall teichoic acid,WTA)和脂磷壁酸(Lipoteichoic acid,LTA)[70-73]。WTA与LTA被认为是革兰阳性菌潜在的药物靶标。Targoci是新一代靶向WTA生物合成的小分子药物[74],靶标为tarG,它是ABC转运蛋白的跨膜成分,可将WTA输出到细胞表面。该化合物可抑制特定金黄色葡萄球菌菌株的生长,包括MRSA,而且其在阻断细胞内金黄色葡萄球菌生长方面比万古霉素更有效。Tunicamycin也可以选择性抑制WTA生物合成,使MRSA重新对β-内酰胺类药物敏感[75]。
通过修饰WTA或LTA,也可以降低细菌对抗生素的耐药性。例如,缺少D-丙氨酸的磷壁酸,使金黄色葡萄球菌对万古霉素的敏感性增加了3倍[76]。
此外,参与细胞壁生物合成与调控的其他蛋白也是潜在的药物靶标,如肽基转移酶Fem[77]、WTA GlcNAc糖基转移酶TarS/TarP[78]和聚合分裂蛋白FtsZ[79]等。其中针对FtsZ蛋白抑制剂的研究最多,从最先的PC19073一直发展到现如今的TXA707和TXA709[80-81]。
4.2 氨酰-tRNA合成酶
氨酰-tRNA合成酶通过两步特异的催化反应使氨基结合到对应的tRNA上[82-84],是蛋白质生物合成过程中不可或缺的一类酶。因此,氨酰-tRNA合成酶也是抗生素治疗细菌感染的潜在靶标之一。目前已开发出的抗生素莫匹罗星近年来耐药率显著上升,该药在“3.3”中已有介绍。由于苯丙氨酸-tRNA合成酶为金黄色葡萄球菌所特有,因此靶向苯丙氨酸-tRNA合成酶的抗生素可能会更有效地治疗MRSA感染[85]。
4.3 脂质Ⅱ循环
脂质Ⅱ循环是革兰阳性菌细胞壁合成的重要途径。该途径中的各种酶和中间产物均是潜在的药物靶标。除了广为人知的靶向PBPs的β-内酰胺类抗生素和靶向脂质Ⅱ的万古霉素外,还有靶向酶MurG的抗生素雷莫拉宁(Ramoplanin),靶向酶MraY的抗生素衣霉素(Tunicamycin),靶向中间产物尿苷二磷酸N-乙酰葡萄糖胺(UPP)的杆菌肽(Bacitracin)、尿苷磷酸(UP)的Friulimicin[86-87]和靶向脂质Ⅱ脂质部分的泰斯巴汀(Teixobactin)[88-89]。此外,Agr群体感应系统和脂肪酸合成途径的Fab蛋白(FabG、FabZ、FabI和FabF)等也受到了研究人员的广泛关注。
5 展望
MRSA具有易感染、死亡率高和多重耐药等特点,当前如何更有效预防和控制MRSA感染也成为热门研究。目前,临床使用的抗生素大多针对3种类型的靶点,即细胞壁(青霉素结合蛋白)、核糖体、和DNA 促旋酶/拓扑异构酶。未来应该更侧重于开发创新预先没有存在交叉耐药性的抗菌药物,探索新类别或新靶点[90]。例如,以脂肪酸生物合成FabI蛋白为靶点的阿法比星,以及靶向脂质Ⅱ的泰斯巴汀等。当然,这项工作非常具有挑战性,需要整合大量资源以及加强科研合作[90-91]。此外,一般单一靶点药物使用后,通常迅速获得耐药性,而药物组合是防止耐药性发展的最佳策略[92]。最近,有研究者[92]提出限制或者逆转耐药性演变的新范式:即通过抑制获得性耐药机制,利用药物之间的相互作用,使耐药株重新敏感。例如,阿莫西林(半合成青霉素)—克拉维酸(β-内酰胺酶抑制剂)的配对。此外,有研究者已经陆续合成了针对部分药物耐药机制的抑制剂,例如靶向氨基糖苷类修饰酶、ErmC甲基转移酶和外排泵等的抑制剂[93]。当然,这些抑制剂早期可能更适合应用于兽医畜牧业,因为面对的伦理问题相对较少。因此,需要结合临床实际情况,制定合适的治疗策略抑制耐药性的演变。
此外,细菌的代谢状态对抗生素疗效十分重要,尤其是在慢性、复发性感染以及耐受感染中。因此,抗生素之间的代谢差异可以为药物组合的设计提供依据[94]。例如,干扰三羧酸(TCA)循环可降低体外抗生素敏感性;耐受索拉非尼的细胞上调了糖酵解酶HK2的表达,而索拉非尼和HK2抑制剂的组合可导致细胞凋亡并减少小鼠肿瘤的生长。尽管协同组合可能增加耐药性突变的选择性优势,但可以使用更少的药物更快地清除感染,延缓毒性和耐药性出现的时间。
针对MRSA的替代治疗策略也在探索中,包括但不限于抗体、抗毒素疗法、噬菌体和疫苗等[95-96]。其原理主要是通过中和/抑制MRSA毒力因子,从而降低MRSA的定植和感染。而且与抗生素的发现相比,新噬菌体的发现是更迅速的[97]。此外,在兽医和畜牧业中使用人类医学中应用的抗菌药物是非常不明智的,在兽药中使用单一广谱抗性机制的药物也是不可取的,因为这造成了耐药性的快速发展以及带来严重的连锁反应。例如,兽药氟苯尼考对细菌群落抗性的选择性压力,造成cfr抗性基因赋予“PhLOPSa”抗性表型,产生交叉耐药性。作为兽医工作者,应进一步完善兽用抗菌药物使用管理及检测体系,加强兽医与医学环境交叉领域合作,以此来降低耐药性的发生。
控制耐药性需要一系列策略,包括药物组合、替代治疗、药物发现以及耐药性监测[98]。同时也迫切需要利用系统生物学方法,利用抗菌策略来预测细菌感染进化的方向,并引导感染远离多药耐药性。了解金黄色葡萄球菌的耐药性现状和抗生素的耐药机制,能够更好地为未来金黄色葡萄球菌耐药的防控提供理论指导,为临床防治细菌耐药和新药研制提供新的视角和参考。

