体外模拟消化对鲟鱼头硒螯合肽结构及抗氧化活性的影响
贾娇 吴汶飞
摘要为了明确鲟鱼头蛋白肽和鲟鱼头硒螯合肽的抗氧化活性差异,体外模拟了口腔及胃肠道消化处理过程中鲟鱼头蛋白肽和鲟鱼头硒螯合肽的结构及抗氧化活性变化。结果表明:鲟鱼头硒螯合肽的紫外光谱吸收峰在体外口腔胃肠模拟消化过程中比鲟鱼头蛋白肽更加稳定。体外模拟消化导致鲟鱼头蛋白肽和鲟鱼头硒螯合肽的圆二色谱吸收峰强度显著降低。粒径分布结果也表明:鲟鱼头硒螯合肽在消化过程中具有更好的溶解性。ABTS、DPPH以及OH自由基清除活性结果显示,在体外模拟消化后,鲟鱼头蛋白肽和鲟鱼头硒螯合肽的自由基清除活性进一步增强,且鲟鱼头硒螯合肽的自由基清除能力最强。
关键词鲟鱼头蛋白肽;硒螯合肽;结构特性;体外模拟;抗氧化活性
中图分类号TS254 文献标识码A 文章编号05176611(2024)07016905
doi:10.3969/j.issn.05176611.2024.07.040
Effects of in vitro Simulated Digestion on the Structure and Antioxidant Activity of Sturgeon Head Peptides-selenium
JIA Jiao1,2, WU Wen-fei1,2
(1.School of Food Science and Technology, Dalian Polytechnic University, Dalian, Liaoning 116034;2.National Engineering Research Center of Seafood, Dalian Polytechnic University, Dalian, Liaoning 116034)
AbstractIn order to clarify the difference in antioxidant activity of sturgeon head peptides and sturgeon head peptides-selenium, the structure and antioxidant activity changes of sturgeon head peptides and sturgeon head peptides-selenium during oral and gastrointestinal digestion were simulated in vitro. The results showed that the UV absorption peak of sturgeon head peptides-selenium is more stable than that of sturgeon head peptides during in vitro simulated oral gastrointestinal digestion. in vitro simulated digestion resulted in a significant decrease in the circular dichroism absorption peak intensity of sturgeon head peptides and sturgeon head peptides-selenium. The particle size distribution results also indicate that sturgeon head peptides-selenium has better solubility during digestion. The results of ABTS·+, DPPH· and ·OH scavenging activity showed that after simulated digestion in vitro, the free radical scavenging activities of sturgeon head peptides and sturgeon head peptides-selenium were further enhanced, and sturgeon head selenium-chelating peptide had the strongest free radical scavenging ability.
Key wordsSturgeon head peptides;Selenium-chelating peptides;Structural characteristics;in vitro simulation;Antioxidant activity
鱘鱼(Sturgeon)隶属于鲟形目硬骨鱼纲[1],是目前地球上最古老的软骨硬鳞鱼类之一[2]。鲟鱼营养价值极其丰富,富含各种氨基酸、不饱和脂肪酸和胶原蛋白,营养价值远高于畜禽类[3],其中P、Ca、Na、K、Mg、Cl等矿物质含量高达2%[4],蛋白含量高达21%[5],是优质蛋白的重要来源,其药用价值和保健功能在很多水产品之上[4]。近些年,随着鲟鱼年产量的逐年递增[6],有关其加工副产物的综合利用与高值化也备受关注。鲟鱼头是鲟鱼加工过程中的主要下脚料,在加工过程中被直接丢弃,造成了资源的浪费,其优质的营养物质也未被开发利用。
作为一种基本的微量营养元素,硒在人体中起着至关重要的作用。硒可以抑制多种致癌因子,从而起到辅助防癌抗癌作用,被称为“抗癌之王”。硒在我国分布十分不均衡,大约有22个省、72%的县处于缺硒或低硒状态[7]。人体缺硒会导致40余种疾病,如糖尿病、肾病、肿瘤、癌变、风湿性关节炎、白内障、贫血等[8],还会导致克山病、大骨节病等地方性疾病[9],孕妇缺硒还会导致胎儿发育受损[10]。适量补硒可以显著减少癌症和其他多种疾病的发生率。目前国内外关于蛋白肽与Fe、Zn、Ca等矿物质离子制备矿物质螯合肽的研究较多,但关于硒螯合肽的研究较少,因此还有极大的空间可以探求。以鲟鱼头为原料制备肽硒螯合物,研究其体外模拟消化过程中的结构变化和抗氧化活性,在充分利用海洋下脚料资源的同时,可为开发食源性硒补充剂及抗氧化肽提供了新的思路。
1材料与方法
1.1原料与试剂
鲟鱼头,衢州鲟龙水产食品科技开发有限公司。
胃蛋白酶,美国Sigma公司;人工唾液消化液,上海源叶股份有限公司;维生素E类似物(Trolox),北京百奥莱博科技有限公司;亚硒酸钠、盐酸、碳酸二氢钠、碳酸氢二钠、水杨酸、硫酸亚铁、H2O2、DPPH、ABTS等試剂均为分析纯。
1.2仪器与设备
SP1702紫外可见光谱仪,美国Perkin Elmer股份有限公司;Spectrum 10傅里叶变换红外光谱仪,美国Perkin Elmer有限公司;J1500圆二色谱仪,JASCO日本分光公司;ZS90激光粒度仪,英国马尔文仪器有限公司。
1.3鲟鱼头硒螯合肽的制备
根据宫民等[11]的研究方法提取得到鲟鱼头蛋白,并利用胃蛋白酶在37 ℃、pH 2的条件下酶解120 min,制备得到鲟鱼头蛋白水解产物。随后将0.5 mol/L亚硒酸钠溶液和3%(W/V)鲟鱼头蛋白水解液以体积比1∶2充分混匀,以制备鲟鱼头硒螯合肽,调节pH至90。随后在80 ℃水浴中反应1 h,冷却至室温,离心后取上清液并加入上清液体积5倍的95%乙醇溶液,混合均匀后静置沉淀12 h,离心后收集沉淀。最后用少量无水乙醇洗涤沉淀,以除去未结合上的硒,将沉淀冻干后得到鲟鱼头硒螯合肽,备用。
1.4鲟鱼头硒螯合肽的口腔胃肠模拟消化
口腔胃肠模拟消化方法参考金子琪等[12]的研究方法,配制模拟消化液。首先取20 mg样品溶于20 mL蒸馏水中,放入37 ℃水浴中预热,接着与20 mL人工唾液混合,调节pH至6.8,在37 ℃ 100 r/min下恒温振荡10 min,以模拟口腔消化。将口腔消化后得到的产物用1 mol/L HCl将pH调节至2.0,添加3.75 μL模拟胃消化液,消化90 min以模拟胃消化过程。继续用1 mol/L NaHCO3调节pH至7.5,加入13.125 μL模拟肠消化液,消化120 min以模拟肠消化过程。
1.5紫外可见吸收光谱测定
将冻干后的鲟鱼头蛋白肽和鲟鱼头硒螯合肽分别溶解在浓度为0.1 mg/mL去离子水中。用紫外可见分光光度计记录鲟鱼头蛋白肽和鲟鱼头硒螯合肽在200~800 nm波长范围内的紫外可见光谱。
1.6圆二色谱测定
将1 mg/mL鲟鱼头蛋白肽和鲟鱼头硒螯合肽分别放置于光程为0.1 cm的石英试管中,使用Jasco J1500圆二色光谱仪在190~260 nm波长下以1 nm/s速度重复扫描3次。扫描温度为(25±0.2) ℃。
1.7粒径测定
将鲟鱼头蛋白肽和鲟鱼头硒螯合肽溶于去离子水中,配制成1 mg/mL溶液,利用激光粒度仪进行测量。
1.8体外抗氧化活性研究
1.8.1
ABTS自由基清除活性测定。
根据Ketnawa等[1314]的方法,将 ABTS水溶液(7 mmol/L)和过硫酸钾溶液(140 mmol/L)以1∶1的比例混合并摇匀,在室温下避光反应12~16 h形成ABTS自由基溶液,用PBS缓冲液(0.2 mol/L,pH 7.4)稀释,使其在734 nm处的吸光值为0.70±0.02。将样液与ABTS自由基溶液混合后于30 ℃下避光反应6 min,反应结束后在734 nm处测定吸光值,以As表示,用蒸馏水替代稀释后的样品溶液作为空白组,其吸光值以A0表示。按以下公式计算ABTS自由基清除活性:ABTS自由基清除率=[(A0As)/A0]×100%。配制0、1、2、3、4、5 mmol/L浓度梯度的Trolox代替样液,重复上述样品测定操作绘制标准曲线,结果表示为mol TEAC/100 g DW。
1.8.2DPPH自由基清除活性测定。
根据章银良等[15]的方法,取1 mL样品溶液和3 mL DPPH(0.04 mg/mL)溶液于5 mL的EP管中,混合均匀后室温下避光反应30 min,用酶标仪在517 nm处测定吸光度,记为As。以相同的方法取1 mL蒸馏水代替稀释后的样品溶液作为空白组,测得的吸光度记为A0。按以下公式计算DPPH自由基清除率:DPPH自由基清除率=[(A0As)/ A0]×100%。按照上述样品反应步骤,配制0、1、2、3、4、5 mmol/L浓度梯度的Trolox标准溶液制作标准曲线。最终结果以mmol TEAC/100 g DW表示。
1.8.3
OH自由基清除活性测定。
根据马勇等[16]的方法,在2 mL EP管中依次加入100 μL FeSO4溶液(9 mmol/L)、100 μL乙醇水杨酸溶液(9 mmol/L),接着加入1 mL样液,最后加入100 μL H2O2(8.8 mmol/L),混合摇匀后于37 ℃干浴器内避光反应15 min。反应结束后用酶标仪测定其在510 nm处的吸光度,记为As,以相同的方法取1 mL蒸馏水代替稀释后的样品溶液作为空白组,在510 nm处测定其吸光度,记为A0。按以下公式计算OH自由基清除率:OH自由基清除率=[(A0As)/A0]×100%。按照上述样品反应步骤,配制0、1、2、3、4、5 mmol/L浓度梯度的Trolox标准溶液,按上述样品反应步骤制作标准曲线,结果表示为mmol TEAC/100 g DW。
1.9统计学分析方法
所有试验结果均以3个独立试验的平均值±标准偏差来表示,并用SPSS 18.0统计学软件(SPSS Inc,Chicago,IL)进行单因素方差分析(Oneway AVOVA)。不同的标记字母表示数据间存在显著差异(P<0.05)。
2结果与讨论
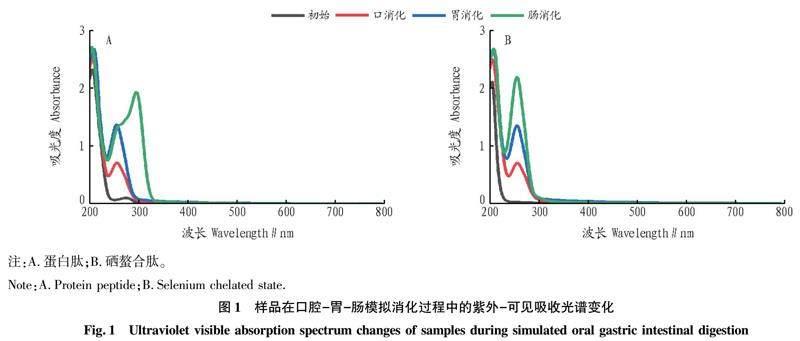
2.1口腔胃肠模拟消化中的紫外可见吸收光谱变化
可通过紫外可见吸收光谱的变化推测蛋白质、多肽等物质的分子结构变化,其含有的生色团的紫外吸收可反映蛋白质和多肽等的构象变化。从图1可以看出,鲟鱼头蛋白肽在模拟消化过程中变化浮动较大,在经口、胃、肠消化后,紫外吸收峰从255 nm移动到295 nm,表明其在消化過程中样品发生了取代作用,导致氨基酸结构被破坏,从而引起特征峰的移动。与鲟鱼头蛋白肽相比,鲟鱼头硒螯合肽在模拟消化过程中的吸收峰几乎没有发生变化,只是随着消化时间的增加,吸收强度增大,吸收峰强度变化说明样品在胃肠道消化过程中由于分子或原子之间的相互作用,发生了电子跃迁和能量级的变化[17]。这表明在模拟口腔胃肠消化过程中鲟鱼头硒螯合肽的结构比鲟鱼头蛋白肽更加稳定。
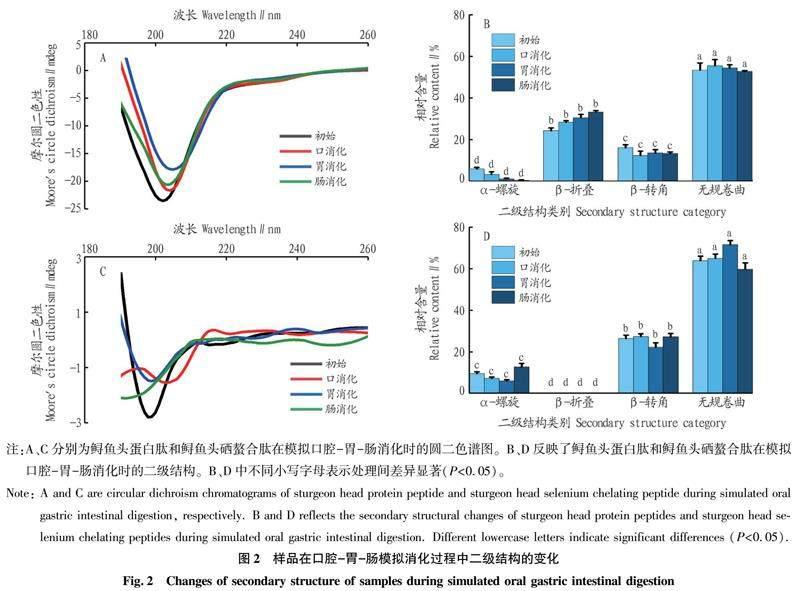
2.2口腔胃肠模拟消化中的二级结构变化
从图2A可以发现,消化前,鲟鱼头蛋白肽在202 nm附近处有一个负峰,经胃、口、肠消化后分别移动至204、205和203 nm处,与未消化相比,消化结束后的峰值强度降低。结合图2B可知,消化结束后鲟鱼头蛋白肽α螺旋和β转角的相对含量降低,β折叠相对含量明显增加。α螺旋和β转角含量的降低表明氨基酸残基中的氢键被破坏。β折叠相对含量的增加主要是由于H与C=O形成了新的氢键。从图2C可以发现,鲟鱼头硒螯合肽口、胃、肠消化时,吸收峰强度显著降低,且在消化过程中的圆二色谱图波动较大,推测可能是由于鲟鱼头硒螯合肽经口、胃、肠消化时,唾液淀粉酶、胃蛋白酶和胰蛋白酶的水解作用以及pH环境的变化影响了鲟鱼头蛋白肽与硒的结合,破坏了其二级结构[18],从而对鲟鱼头硒螯合肽的结构稳定性产生了影响。具体来说,主要表现在α螺旋和β转角相对含量先降低后升高,无规卷曲含量先升高后降低(图2D),这可能是由于在消化过程中蛋白质分子部分展开,导致其二级结构含量的变化[19],这也表明鲟鱼头硒螯合肽在肠消化环境中具有比胃消化环境更高的稳定性。
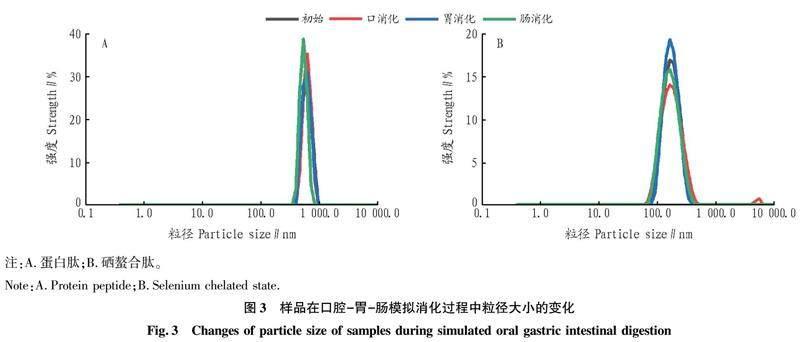
从图3可见,鲟鱼头蛋白肽和鲟鱼头硒螯合肽在模拟口腔胃肠消化过程中的粒径均呈减小的趋势。消化前鲟鱼头蛋白肽和鲟鱼头硒螯合肽的粒径大小分别为565.5和169.8 nm,经口腔消化后分别减小至553.2和167.2 nm,减小了12.3和2.6 nm,这主要是模拟口腔消化液中的唾液淀粉酶的降解作用。进入胃消化阶段,鲟鱼头蛋白肽和鲟鱼头硒螯合肽的粒径分别减小到548.6和166.5 nm,与模拟口腔消化后的粒径相比显著降低(P<0.05)。在肠消化阶段,鲟鱼头蛋白肽和鲟鱼头硒螯合肽的粒径进一步减小,分别为489.4和158.8 nm。其可能的原因是在经口腔胃肠模拟消化时,模拟消化液中胃消化液中的胃蛋白酶及肠消化液中的胰蛋白酶和胆汁盐等消化酶对鲟鱼头蛋白肽和鲟鱼头硒螯合肽的酶切降解,促进鲟鱼头蛋白肽和鲟鱼头硒螯合肽在模拟消化过程中的分解,从而减小了其颗粒大小[20]。同时,鲟鱼头硒螯合肽在口腔胃肠消化过程中的颗粒大小显著低于鲟鱼头蛋白肽(P<0.05),推测鲟鱼头硒螯合肽可能更易被消化吸收。
2.4ABTS自由基清除活性
鲟鱼头蛋白肽和鲟鱼头硒螯合肽在模拟口腔胃肠消化过程中,ABTS自由基清除活性变化如图4所示。从图4可见,多肽的抗氧化活性与其结构特征有关,如疏水性、序列和氨基酸组成等[21]。口消化阶段对ABTS自由基的消除能力不大,在胃消化过程中,消化产物对ABTS自由基的清除能力增强,这归因于胃蛋白酶的酶切降解,暴露出更多的抗氧化活性位点,形成小分子量的肽和游离氨基酸[22],使其与ABTS自由基反应的机会增加,从而使抗氧化活性显著增强。进入肠消化过程,ABTS自由基的清除能力进一步增强,其原因可能是经胃蛋白酶、胰酶、胰蛋白酶和胆汁酸等消化酶的酶切降解[23],样品中具有抗氧化活性的氨基酸(如酪氨酸、色氨酸和苯丙氨酸等)的数量[24]在肠模拟消化增多所导致[25]。
2.5OH自由基清除活性
鲟鱼头蛋白肽和鲟鱼头硒螯合肽在模拟口腔胃肠消化过程中OH自由基清除活性变化如图5所示。从图5可以发现,口消化阶段,OH自由基清除活性不大。进入胃消化阶段,消化产物与OH自由基能更好地接触反应,促使多肽原有活性显著增强。肠消化结束后OH自由基清除活性进一步增强,可能是由样品消化液中具有抗氧化活性的氨基酸数量在消化过程中增多所导致[26]。作为口腔胃肠消化过程中的产物易受其结构特征和生物活性变化的影响改变,如消化酶和肠道菌群等的改变也会导致蛋白质和多肽的降解[27],进一步生成小肽(二肽或三肽)和抗氧化活性较强的游离氨基酸,使其抗氧化活性增强。
2.6DPPH自由基清除活性
在模拟口腔胃肠消化过程中,鲟鱼头蛋白肽和鲟鱼头硒螯合肽的DPPH自由基清除活性变化如图6所示。从图6可见,DPPH自由基清除活性在口消化过程中较低,在经胃消化阶段和肠消化阶段后显著增加。这是由于随着胃肠模拟消化的进行,有更多的疏水性氨基酸侧链暴露,使得消化产物与DPPH自由基能够更好地接触反应[28],从而使得DPPH自由基清除率显著增加[27]。当进入模拟肠道阶段,DPPH自由基清除率又有所降低,其可能的原因是pH的改变影响了氨基酸生物活性的变化。
3结论
该研究通过体外模拟口腔及胃肠道消化处理过程中鲟鱼头蛋白肽和鲟鱼头硒螯合肽的结构变化以及抗氧化活性变化,明确了体外消化处理后硒螯合肽抗氧化活性差异。结果表明,在模拟口腔胃肠消化过程中鲟鱼头硒螯合肽的结构比鲟鱼头蛋白肽更加稳定。体外模拟消化导致鲟鱼头蛋白肽和鲟鱼头硒螯合肽的圆二色谱吸收峰强度显著降低。鲟鱼头蛋白肽和鲟鱼头硒螯合肽的粒径经口腔胃肠模拟消化后皆呈现减小的趋势,且鲟鱼头硒螯合肽在口腔胃肠消化过程中的颗粒大小显著低于鲟鱼头蛋白肽。ABTS、DPPH以及OH自由基清除活性结果显示,在体外模拟消化后,鲟鱼头蛋白肽和鲟鱼头硒螯合肽的自由基清除活性进一步增强,且鲟鱼头硒螯合肽的自由基清除能力更强。鲟鱼头硒螯合肽除作为有机硒营养补充剂外,还可以作为一种潜在的高效抗氧化剂,但其体内抗氧化活性还需进一步研究。
参考文献
[1] YI Y J,SUN J,ZHANG S H,et al.Assessment of Chinese sturgeon habitat suitability in the Yangtze River(China):Comparison of generalized additive model,data-driven fuzzy logic model,and preference curve model[J].Journal of hydrology,2016,536:447-456.
[2] 陈跃文,蔡文强,祁立波,等.俄罗斯鲟鱼不同部位肌肉营养组成分析与评价[J].中国食品学报,2019,19(8):286-293.
[3] 黄东雨,陈海光,FELICIA KOW.海洋鱼类分割加工废弃物的综合利用[J].广东农业科学,2009,36(9):144-148.
[4] 郭思亚.人工养殖鲟鱼鱼肉制品开发及其品质评价[D].成都:成都大学,2019.
[5] ABRAHA B,MAHMUD A,ADMASSU H,et al.Production of biscuit from Chinese sturgeon fish fillet powder(Acipeneser sinensis):A snack food for children[J].Journal of aquatic food product technology,2018,27(10):1048-1062.
[6] 李沛洋,朱學芝,李昭林,等.鲟鱼营养研究进展[J].广东饲料,2021,30(8):33-38.
[7] STOFFANELLER R,MORSE N L.A review of dietary selenium intake and selenium status in Europe and the Middle East[J].Nutrients,2015,7(3):1494-1537.
[8] YE Q W,WU X P,ZHANG X Y,et al.Organic selenium derived from chelation of soybean peptide-selenium lenium and its functional properties in vitro and in vivo[J].Food & function,2019,10(8):4761-4770.
[9] NATASHA,SHAHID M,NIAZI N K,et al.A critical review of selenium biogeochemical behavior in soil-plant system with an inference to human health[J].Environmental pollution,2018,234:915-934.
[10] MISTRY H D,PIPKIN F B,REDMAN C W G,et al.Selenium in reproductive health[J].American journal of obstetrics and gynecology,2012,206(1):21-30.
[11] 宫民,刘丹阳.鲟鱼营养价值研究进展[J].黑龙江水产,2018(4):10-11.
[12] 金子琪.蛋清肽螯合钙的结构表征及其促钙吸收途径的研究[D].大连:大连工业大学,2019.
[13] KETNAWA S,LICEAGA A M.Effect of microwave treatments on antioxidant activity and antigenicity of fish frame protein hydrolysates[J].Food and bioprocess technology,2017,10(3):582-591.
[14] 刘昕,张驰,薛艾莲,等.超声酶法提取的豆腐柴低酯果胶理化性质及结构表征[J].食品与发酵工业,2021,47(8):108-115.
[15] 章银良,张陆燕,周文权,等.不同温度对酪蛋白木糖模式美拉德反应产物抗氧化性的影响[J].现代食品科技,2014,30(4):211-219.
[16] 马勇,高丽辉,冯晓文,等.模拟胃肠消化对牡蛎低聚肽抗氧化活性的影响[J].食品与机械,2020,36(11):133-137,176.
[17] 李海枝,王俊,熊菲菲,等.不同钙制剂体外消化的稳定性比较及消化后的结构研究[J].食品与发酵工业,2021,47(7):116-122.
[18] GLER G,VOROB′EV M M,VOGEL V,et al.Proteolytically-induced changes of secondary structural protein conformation of bovine serum albumin monitored by Fourier transform infrared(FT-IR)and UV-circular dichroism spectroscopy[J].Spectrochim acta a mol biomol spectrosc,2016,161:8-18.
[19] WU C,DONG H,WANG P,et al.Sequential changes in antioxidant activity and structure of curcumin-myofibrillar protein nano complex during in vitro digestion[J].Food chemistry,2022,382:132331.
[20] 王笑涵,姜卉,吴海涛,等.大黄鱼卵分离蛋白乳液的构筑及其体外消化规律[J].食品科学,2020,41(18):813.
[21] ZOU T B,HE T P,LI H B,et al.The structure-activity relationship of the antioxidant peptides from natural proteins[J].Molecules,2016,21(1):1-14.
[22] SHAO Y H,ZHANG Y,LIU J,et al.Influence of ultrasonic pretreatment on the structure,antioxidant and IgG/IgE binding activity of β-lactoglobulin during digestion in vitro[J].Food chemistry,2020,312:1-8.
[23] MORAN E T,JR.Gastric digestion of protein through pancreozyme action optimizes intestinal forms for absorption,mucin formation and villus integrity[J].Animal feed science and technology,2016,221:284-303.
[24] GUO H,KOUZUMA Y,YONEKURA M.Structures and properties of antioxidative peptides derived from royal jelly protein[J].Food chemistry,2009,113(1):238-245.
[25] LEE S Y,LEE D Y,HUR S J.Changes in the stability and antioxidant activities of different molecular weight bioactive peptide extracts obtained from beef during in vitro human digestion by gut microbiota[J].Food research international,2021,141:17.
[26] QIAN Z J,JUNG W K,BYUN H G,et al.Protective effect of an antioxidative peptide purified from gastrointestinal digests of oyster,Crassostrea gigas against free radical induced DNA damage[J].Bioresource technology,2008,99(9):3365-3371.
[27] LEE S J,LEE S Y,CHUNG M S,et al.Development of novel in vitro human digestion systems for screening the bioavailability and digestibility of foods[J].Journal of functional foods,2016,22:113-121.
[28] 陳丽花,朱楚楚,李冉冉.体外消化对金瓜籽抗氧化肽抗氧化活性的影响[J].食品科学,2019,40(3):78-86.
基金项目辽宁省博士科研启动基金计划项目(2019BS017)。
作者简介贾娇(1995—),女,甘肃白银人,硕士研究生,研究方向:食品加工与功能食品。*通信作者,博士,从事食品加工与功能食品研究。

