β-内酰胺酶抑制剂的稳定性与降解反应特性
摘要:β-内酰胺酶抑制剂与广谱β-内酰胺抗生素的联合使用是一种有效解决细菌耐药的策略之一。目前上市的β-内酰胺酶抑制剂按其化学结构主要包括氧青霉烯类(克拉维酸)、青霉烷砜类(舒巴坦和他唑巴坦)和二氮杂二环辛烷类化合物(阿维巴坦),本文对临床常见的β-内酰胺酶抑制剂的稳定性与降解反应特性进行综述,并结合当前药典标准中的有关物质检查项,探讨上述β-内酰胺酶抑制剂的杂质谱控制策略。
关键词:β-内酰胺酶抑制剂;稳定性;降解反应;杂质谱控制
中图分类号:R978.1文献标志码:A
Stability and degradation characteristics of β-lactamase inhibitors
AbstractThe combination of β-lactamase inhibitors with broad-spectrum β-lactam antibiotics is one of the effective strategies to meet the challenge of bacterial resistance. Currently, β-lactamase inhibitors mainly used on the market include oxapenems (clavulanic acid), penicillane sulfones (sulbactam and tazobactam) and diazabicyclooctanes (avibactam), according to their chemical structure. In this paper, the stability and degradation mechanisms/characteristics of the β-lactamase inhibitors were reviewed. Combined with the methods of related substance determination in the specifications of pharmacopeia, the strategy for the impurity profiling control of the β-lactamase inhibitors was discussed.
Key words β-lactamase inhibitor; Stability; Degradation mechanism; Impurity profiling
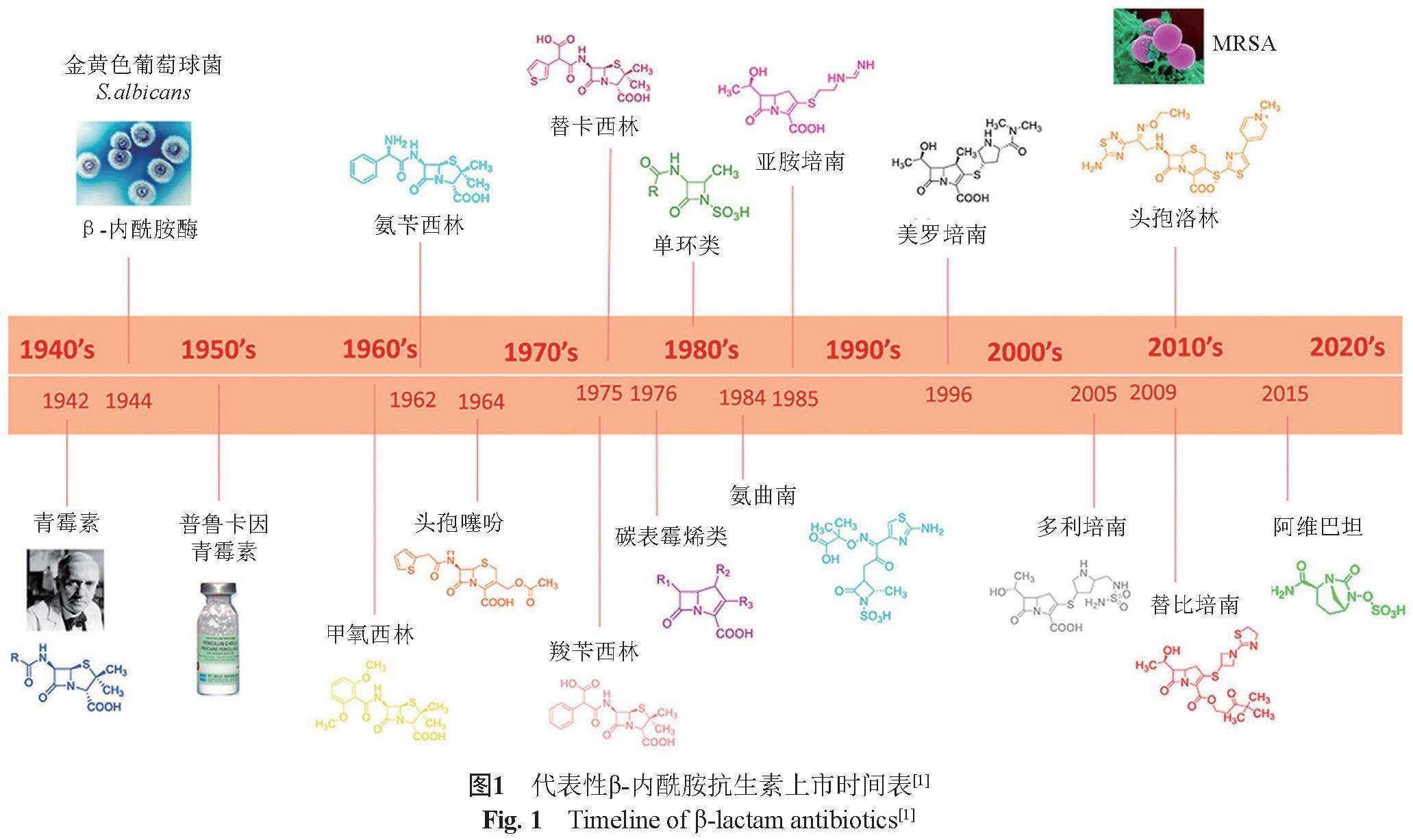
β-內酰胺类抗生素是临床中最重要的一类抗感染药物。β-内酰胺类抗生素的研发历程贯穿于人类与微生物博弈的全过程(图1)。第一个β-内酰胺抗生素(青霉素G)的上市被认为是现代化疗的标志性里程碑。从那时起,青霉素类、头孢菌素类、碳青霉烯类、青霉烯类和单环类β-内酰胺抗生素被逐渐引入临床,彻底改变了人类对抗细菌感染治疗的认知。然而,伴随着β-内酰胺抗生素的广泛应用,细菌逐渐产生耐药性,又使得β-内酰胺抗生素的抗菌功效受到抑制。在诸多的细菌耐药机制中,最普遍且最重要的耐药机制是细菌通过产生β-内酰胺酶灭活β-内酰胺抗生素。β-内酰胺酶抑制剂的发现,酶抑制剂与广谱β-内酰胺抗生素的联合使用是一种有效解决细菌耐药的策略之一。
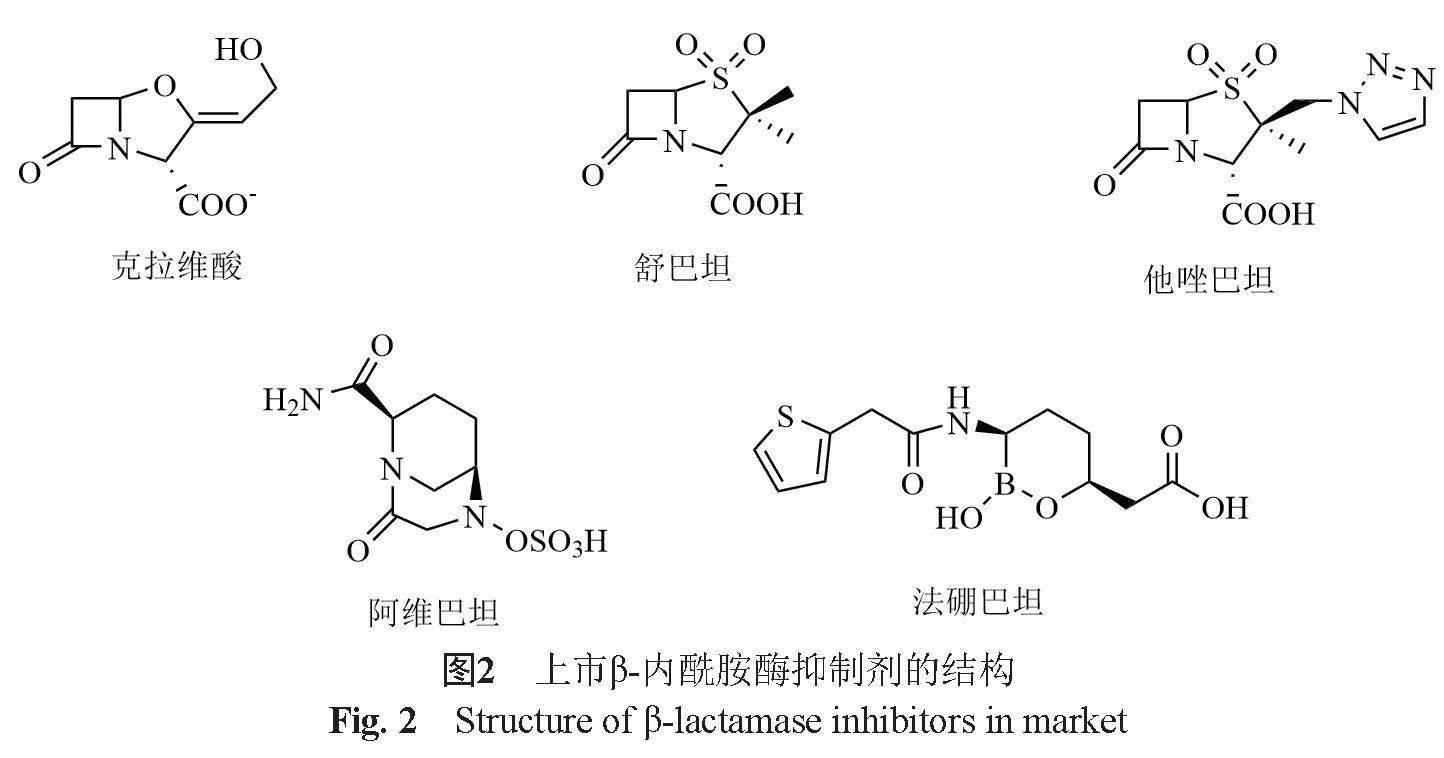
目前已上市的β-内酰胺酶抑制剂均为丝氨酸β-内酰胺酶(SBLs)抑制剂(图2),按其化学结构包括氧青霉烯类(克拉维酸)、青霉烷砜类(舒巴坦和他唑巴坦)、二氮杂二环辛烷类化合物(DBO)(阿维巴坦)和有机硼酸类化合物(法硼巴坦)。对β-内酰胺酶抑制剂的作用机理、抑酶特性和临床应用等国内外均已经有较全面的综述[2-8],β-内酰胺酶抑制剂通常与β-内酰胺抗生素组成复方制剂。按现代药物杂质谱控制的理念,需对复方制剂中β-内酰胺酶抑制剂的杂质谱进行控制。然而,对β-内酰胺酶抑制剂的稳定性与降解反应特性的综述尚较少见。本文对目前临床常见的β-内酰胺酶抑制剂的稳定性与降解反应特性进行综述,并结合当前药典标准中的有关物质检查项,探讨上述β-内酰胺酶抑制剂的杂质谱控制策略。
1 克拉维酸
克拉维酸(clavulanic acid)是首个由棒状链霉菌 (Streptomyces clavuligerus)产生的β-内酰胺酶抑制剂,是氧青霉烷类β-内酰胺酶抑制剂的典型代表。上市的克拉维酸产品为克拉维酸钾,其标准品为克拉维酸锂;临床中最常见的复方制剂是各种规格的阿莫西林(钠)-克拉维酸钾注射剂和口服制剂。
1.1 固体稳定性
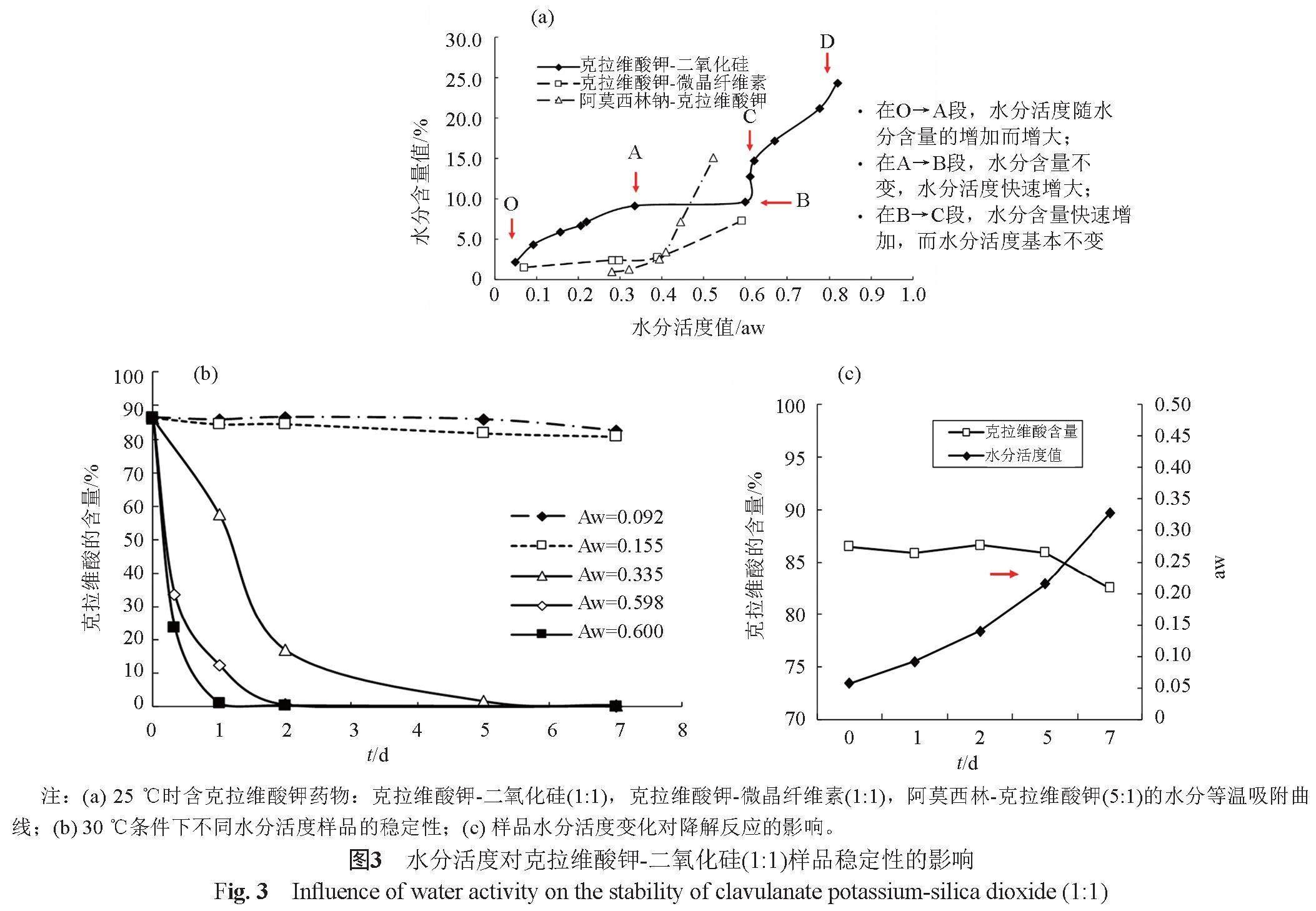
克拉维酸钾对水分十分敏感,克拉维酸钾与二氧化硅、微晶纤维素或与阿莫西林三水合物混合后,均可以降低其中能自由逸出可以与克拉维酸发生反应的水分子的量,因而可以使其稳定性显著提高。通常用水分活度表征样品中水的逸出能力(数值介于0~1),水分活度是影响克拉维酸钾固体稳定性的关键因素。药物水分活度与水分含量的关系可用吸附-解吸附等温线(moisture sorption-desorption isotherms)表示。对3种含克拉维酸钾药物25 ℃时的水分等温吸附曲线进行分析(图3a),样品中水分含量的变化呈阶梯状: O→A段,水分活度与水分含量均缓慢增加; A→B段,水分含量基本不变,但水分活度快速增加;B→C段,水分含量快速增加,水分活度基本不变;C→D段,水分含量与水分活度均快速增加。进一步比较30 ℃时不同水分活度(aw)的克拉维酸钾-二氧化硅(1:1)样品的稳定性(图3b):当样品中的水分活度大于0.15 aw(水分含量约大于5%)时,克拉维酸钾迅速降解;样品3与样品4中的水分含量仅差0.3%,前者的水分活度值为0.335 aw,后者为0.598 aw,样品4在0.5 d就降解了约50%,降解反应速率明显快于样品3。进一步分析水分活度-降解反应的关系:某样品在加速实验(30 ℃)中水分活度逐渐增大,在第5天时大于0.15 aw(约为0.2 aw);在前5天的加速实验中,基本观测不到该样品的降解,但第5天后,样品发生明显的降解反应(图3c);提示30 ℃时引起克拉维酸钾发生降解反应的水分活度阈值约为0.15 aw。上述结果提示,根据贮存温度引起药物降解反应的水活度阈值,控制药物中水分的含量,可以保证样品贮存期的稳定性。
样品中的水分活度与其基质的特性有关,相同水分条件下,基质对水分的吸附作用越强,样品的水活度越低;25 ℃时,克拉维酸钾-微晶纤维素(1:1)样品的水分活度为0.430,克拉维酸钾-二氧化硅(1:1)样品的水分活度为0.327,阿莫西林-克拉维酸钾(5:1)样品的水分活度为0.223;室温贮存时,阿莫西林-克拉维酸钾样品相对最稳定。由于水分活度随温度的增加而增大,贮存温度越高,样品中的水分含量应控制得更低,才能保证其稳定性。
1.2 溶液稳定性
克拉维酸钾在溶液中对温度和pH均非常敏感,利用一级动力学方程可以较好地解释其在溶液中的水解动力学特性,Arrhenius方程可以较好地表征不同pH条件下降解速率常数与温度的关系;克拉维酸在发酵培养基中较其在标准品溶液和制剂溶液中更不稳定[9]。对克拉维酸钾在不同pH、温度和不同盐溶液中的稳定性研究表明, 20 ℃、pH 6.0~7.2时克拉维酸的稳定性较好;溶液中盐对其稳定性的影响依次为Na2SO4>MgSO4>氯化钙>氯化钠[10]。在水溶液(35 ℃、?=0.5、pH 3~10)中,pH为6.39时克拉维酸最稳定;在碱性介质中克拉维酸的降解速度较酸性介质中快10倍;且缓冲盐的催化作用对降解反应的影响显著(缓冲液浓度越大,降解反应越快)[11]。
1.3 降解反应途径
对克拉维酸在水溶液中的降解反应途径研究表明,其首先水解形成开环物;由于开环物非常不稳定,在开环的同时氧青霉烯母核中的C-O键断裂,形成降解物VI,经脱乙酸甲醛和二氧化碳后,形成主要水解产物1 -氨基-4-羟基丁烷-2-酮(IX);降解物IX是后续形成吡嗪衍生物的重要中间体(图4)。在酸性条件下降解物IX比较稳定;在中性和碱性溶液中,降解物IX会发生自缩合反应,首先形成二氢吡嗪衍生物(降解物X,EP中的杂质A),再进一步形成降解物I(2,5-双(2-羟乙基)吡嗪)和降解物IV(3-乙基-2,5-双(2-羟乙基)吡嗪,EP中的杂质C)等吡嗪衍生物 [12]。在弱碱性溶液中已鉴定出4个吡嗪衍生物,包括降解物I、降解物II(3-甲基-2,5-双(2-羟乙基)吡嗪)、降解物III(3-(2-羧乙基)-2,5-双-(2-羟乙基)吡嗪,EP中的杂质B)和降解物IV[13]。降解物X在空气中氧化即可形成降解物I,与克拉维酸降解过程中产生的甲醛、乙酸甲醛、乙醛反应,则分别形成降解物II、降解物III和降解物IV。克拉维酸在60 ℃条件下水解,可降解形成4种吡嗪衍生物; 但35 ℃条件下不能形成降解物II, 100 ℃下不能形成降解物III[13]。
在碱性水溶液中,克拉维酸钾降解物VII(8-羟基-6-氧-4-氮杂-2-辛酸)的λmax为260 nm[14]。在甲醇和饱和NaOH甲醇溶液中,则形成8-羟基-6-氧-4-氮杂-2-辛酸甲酯(降解物VII甲酯),其λmax为268nm(甲醇);降解物VII甲酯经碱催化的重排反应,分子内缩合可形成4-(2-羟乙基)吡咯-3-甲酸甲酯(3,4-二取代吡咯衍生物)[15];克拉维酸与咪唑反应可形成1-(8-羟基-6-氧-4-氮杂-2-辛酸)咪唑(咪唑衍生物),经酸水解后形成降解物VII[16];降解物VII和其甲酯酸化后,紫外吸收几乎消失,但碱化后可再次出现(图5)[14]。
1.4 对降解杂质的控制
欧洲药典(EP11.0)在克拉维酸钾各论中,列出了部分特定杂质的结构,其中杂质A、B、C分别为克拉维酸降解形成的吡嗪衍生物(杂质X、杂质III和杂质IV);杂质D为降解物VII经碱催化分子内缩合形成的重排产物。《中国药典》2020年版采用HPLC主成分自身对照法对克拉维酸钾中的杂质进行控制,但没有对特定降解杂质进行针对性的控制。从杂质谱控制角度,EP对克拉维酸钾降解杂质的控制较《中国药典》更为完善。但EP未对克拉维酸钾降解形成的杂质I和杂质II这两个重要的吡嗪衍生物进行控制,使其略显不足。此外,目前药品质控方法均采用HPLC-UV色谱系统进行有关物质检查,而克拉维酸钾的直接降解产物如降解物IX等,由于没有明显的紫外吸收不适宜采用UV检测器直接检测,因而采取测定他们的缩合产物控制其降解反应的策略。如采用电化学检测,则可能促使其杂质谱控制方法更为完善。
已发表的对阿莫西林-克拉维酸钾制剂杂质谱的分析方法,通常均仅对阿莫西林产生的特定杂质进行了归属[17-18],虽然克拉维酸钾在复方制剂中较阿莫西林更不稳定[18],但由于在HPLC-UV色谱系统中,克拉维酸钾降解产物与阿莫西林杂质相比响应值较低不宜被检测,因而在分析时通常均被忽略。开发适宜的色谱系统分析阿莫西林-克拉维酸钾复方制剂中克拉维酸钾的降解杂质,对评价复方制剂的质量具有重要的意义。
2 青霉烷砜类酶抑制剂
青霉烷砜类化合物是由6-氨基青霉烷酸(6-APA)为起始物合成得到的一类衍生物,其中舒巴坦和他唑巴坦对β-内酰胺酶具有很强的抑制作用,分别于1978年和1984年上市。舒巴坦、他唑巴坦均為竞争性不可逆的β-内酰胺酶抑制剂,临床中常见的制剂有注射用氨苄西林钠/舒巴坦钠、注射用头孢哌酮钠/舒巴坦钠、注射用哌拉西林钠/他唑巴坦钠等。青霉烷砜类β-内酰胺酶抑制剂较克拉维酸钾的稳定性要好,但在溶液中特别是在碱性溶液中仍易降解。
2.1 舒巴坦
2.1.1 固体稳定性
舒巴坦的常见药用形式是舒巴坦钠,通常由结晶工艺生产,其在固态状态下较为稳定。在药物制剂中舒巴坦钠的稳定性与生产工艺有关。如注射用头孢哌酮钠舒巴坦钠,可以由冷冻干燥工艺生产,产品为无定型粉末;也可以由无菌分装工艺生产,产品为无定型头孢哌酮钠/结晶型舒巴坦钠和结晶型头孢哌酮钠/结晶型舒巴坦钠。对头孢哌酮钠舒巴坦钠的产品稳定性考察发现,固体状态下头孢哌酮钠较舒巴坦钠更不稳定,影响复方注射剂质量的关键因素是头孢哌酮钠的质量。选择理想的头孢哌酮晶体,同时根据产品的水活度特性控制产品中的水分含量是提高产品稳定性的关键。
2.1.2 降解反應
舒巴坦钠的主要降解反应为水解反应。舒巴坦钠在水溶液(35 ℃,离子强度=0.5)中,最稳定的pH范围为3.0~7.0;在不同pH条件(pH 1~10)下的降解反应均遵循一级动力学反应特性[19]。舒巴坦钠水解时首先β-内酰胺环开环,并快速形成降解物IV(5-羧基-6-甲基-6-亚磺酸基-4-氮杂-2-庚烯酸,EP中的杂质G),其紫外光谱的λmax为267 nm;再分解成2-氨基-3-甲基-3-亚磺酸基丁酸(VIII,EP中的杂质A)和乙酸甲醛(VI)。在碱性甲醇溶液中,则先形成2-氨基-3-甲基-3-亚磺酸基丁酸甲酯(II),其紫外光谱λmax为279 nm;再进一步分解(图6)[20]。降解物II和降解物IV在酸性水溶液中进一步水解后,紫外吸收几乎消失,但碱化后乙酸甲醛烯醇化后再次显现紫外吸收。
2.2 他唑巴坦
2.2.1 固体稳定性
影响他唑巴坦固体稳定性的主要因素与其物理状态(结晶型或无定型)及样品中水分的存在形式有关。他唑巴坦为多晶型药物,可以形成无水物和二种具有不同晶格结构的半水合物晶体。他唑巴坦无水无物晶体为正交晶系(在乙醇-水=70:30的溶液中结晶),空间群为P212121;晶胞参数:a=10.230(2), b=14.396(2), c=17.291(2) ?;Z=8;化学计量式: C10H12N4O5S。晶胞中C(2)羧酸中的质子和三唑基的N(4)氮原子存在分子间氢键[21]。半水合物晶体I为单斜晶系(在2~8 ℃,pH 1.7的水溶液中结晶),空间群为P21;晶胞参数:a=9.9008(5), b=12.2025(6),c= 12.0204(5) ?,β=111.4777(14)°;Z=2;化学计量式: C10H12N4O5S·0.5H2O,1个不对称单元含有2分子他唑巴坦分子和1分子结晶水。与无水物晶体相似,晶胞中三唑环的N和羧基的H通过氢键连接;但水分子通过3个氢键分别与他唑巴坦分子的三唑基、羧基和磺酰基结合(距离分别为2.770 ? 、2.594 ? 和2.735 ?),因而晶格结构与无水物晶体不同[22]。半水合物晶体II为正交晶系(在5 ℃,乙醇-水=70:30(V/V)的饱和溶液中结晶);晶胞中他唑巴坦羧基的H与β-内酰胺环的N之间存在分子内的氢键,不对称单元中二个分子的氢键键长分别为2.654 ?和2.681 ?,与半水合物I分子间的作用方式不同;此外,水分子与他唑巴坦的羧基和羰基分别形成二个氢键(距离分别为2.579 ?和3.075 ?),水分子在晶格中十分稳定,至熔融分解时才释放;而他唑巴坦分子间不存在氢键联系[23]。总体而言,他唑巴坦的固体稳定性通常较好。
在药物制剂中他唑巴坦通常以他唑巴坦钠的形式存在,其稳定性与生产工艺有关。如注射用哌拉西林钠他唑巴坦钠常以哌拉西林酸与他唑巴坦水合物为原料,与成盐剂(碳酸钠)成盐后,由冷冻干燥工艺得到。制剂中的哌拉西林钠与他唑巴坦钠均为无定形产品,因而,对其水分含量的控制是稳定性的关键。
2.2.2 降解反应
他唑巴坦与舒巴坦中在溶液中的降解反应途径不完全相似(图7)[24-25]。在碱性水溶液中,他唑巴坦可形成降解物I;降解物I仅在碱性环境下稳定,在酸性和中性溶液中可迅速分解成降解物II(2-氨基-3-甲基-3-亚磺酸基-4-(1氢-1,2,3-三氮唑-1-基)-丁酸,USP中的杂质A)和降解物III(乙酸甲醛);在酸性溶液中,降解物II可以继续降解为三氮杂和多个结构未知的降解物(降解物IIIa-IIId)。在不同pH条件下,他唑巴坦不仅降解反应速度不同,降解途径也不完全相同,因而所能检测到的降解产物也不完全相同。在碱性甲醇溶液中他唑巴坦则可形成一对顺反异构体(Ia,Ib)。在固态下如冷冻干燥的样品中,他唑巴坦的降解反应途径与其在溶液中的反应相似,但由于降解物I非常不稳定,通常检测不到它的存在,而仅能检测到降解物II和降解物III;此外,固态条件下还可以检测到降解物IV,其仍可能源于降解物I的进一步降解。
2.3 对降解杂质的控制
由于舒巴坦降解物的响应值在药典收载的HPLC-UV色谱系统(检测波长215 nm)中均较低,因而各国药典对其降解杂质的控制策略不同。EP11.0在列出的有关物质结构中,明确了杂质A(降解杂质VIII)和杂质G(降解杂质IV)(图6)的结构,但仅对杂质A作为特定杂质进行控制,杂质G作为非特定杂质进行控制。《中国药典》2020年版采用HPLC主成分自身对照法控制舒巴坦中的杂质,采用2-氨基-3-甲基-3-亚磺酸基丁酸(降解杂质VIII)进行系统适用性实验,但未对降解杂质作为特定杂质进行控制。
对他唑巴坦降解杂质的控制情况与舒巴坦相似。USP(2020)有关物质测定采用HPLC-UV色谱系统,检测波长为210 nm;并将降解杂质II(图7)作为特定杂质进行控制,并利用降解杂质II对照品(USP杂质A对照品)进行系统适用性实验,保证色谱系统的有效性。《中国药典》2020年版收载的检测方法色谱流动相与检测波长均与USP不同,且未提供任何与他唑巴坦降解杂质相关的信息,因而无法判断其对他唑巴坦降解杂质的检测能力。
在对其复方制剂如氨苄西林/舒巴坦、哌拉西林/他唑巴坦复方制剂的分析中,由于舒巴坦/他唑巴坦降解杂质与氨苄西林/哌拉西林降解杂质紫外响应因子的巨大差异,且舒巴坦/他唑巴坦降解杂质的保留值通常均较小,因而在分析中非常容易被忽略,如对氨苄西林/舒巴坦有关物质的分析[26]等。
综上,对青霉烷砜类酶抑制剂降解杂质的控制是杂质谱控制的薄弱环节,其原因为在目前的HPLC-UV色谱系统中,其降解产物的紫外响应值较低且保留值也较小,在分析中特别是在对其复方制剂的杂质谱分析中很容易被忽略。开发针对紫外吸收较弱、极性较强的舒巴坦/他唑巴坦降解杂质的适宜色谱系统是其杂质谱控制的发展方向之一。
3 阿維巴坦钠
20世纪90年代中期,科学家预测二氮杂二环辛烷(diazabicycloocatanes,DBOs)类化合物可能具有与β-内酰胺类抗生素相似的抗菌作用,但由于其结构与β-内酰胺类化合物完全不同,因而可能具有耐β-内酰胺酶的特性。虽然后期的研究中未能从中筛选出具有强抑菌活性的化合物,但发现阿维巴坦(avibactam)和MK-7655均具有较好的抑制β-内酰胺酶的作用[6]。阿维巴坦((2S,5R)-7-氧-6-(亚氧基)-1,6-重氮杂环[3,2,1]辛烷-2-羧酰胺) 是第一个完成临床试验的非β-内酰胺型β-内酰胺酶抑制剂,它对A类、C类和一些D类β-内酰胺酶均用较好的抑制作用,其复方制剂注射用头孢他啶阿维巴坦钠已在临床应用。
阿维巴坦钠是多晶型药物,可以形成二水合物(晶型E)、一水合物(晶型A)和两种无水物(晶型B和晶型D)晶体,4种晶体的单晶结构不同,且表现出不同的粉末X衍射特征(图8a)[27]。晶型E(二水合物)晶体为正交晶系,空间群为P212121;晶胞参数:a=7.7815(16)?, b=12.374(3)?,c=12.931(3)?;Z=4;化学计量式: C7H10N3NaO6S·2H2O; 晶型A(一水合物)晶体为单斜晶系,空间群为P21;晶胞参数:a=8.6213(17)?,b=6.9281(14)?,c=10.391(2)?;β=91.82(3)°;Z=2;化学计量式: C7H10N3NaO6S·H2O; 晶型B(无水合物)晶体为单斜晶系,空间群为P21;晶胞参数:a=8.5289(17)?,b=6.2868(13)?,c=10.219(2)?;β=93.77(3)°;Z=2;化学计量式: C7H10N3NaO6S; 晶型D(无水合物)晶体为单斜晶系,空间群为P21;晶胞参数:a=8.0823(16)?, b=6.4168(13)?,c=10.434(3)?;β=104.13(3)°;Z=2;化学计量式: C7H10N3NaO6S。
采用TG结合DSC分析阿维巴坦钠4种晶体的热稳定性,探讨水分子对晶体稳定性的影响(图8b~c)。在晶型A(一水合物)的TG图谱中,在温度378~389 K范围可见明显的失重(约5.9%),对应的DSC曲线中也出现明显的放热峰,提示结晶水的丢失;在510 K时样品分解。在晶型B和晶型D(无水物)的TG图谱中,在500 K之前未见明显失重,二者分别在510 K和502 K处分解,提示晶型B较晶型D对热更稳定。在晶型E(二水合物)的TG图谱中,样品失重约为11.20%,与理论含水量11.11%基本一致;在约509 K时分解,分解温度与晶型A和晶型B相似;在对应的DSC曲线中,晶型E在359~372 K和375~391 K处显示出两个吸热峰,提示其脱水过程分为两步,第一步丢失仅通过氢键相连接的水分子[H2O(1)],第二步丢失与Na+离子配位结合的水分子[H2O(2)]。
采用动态水分吸附实验(DVS)分析阿维巴坦钠不同晶型的吸水/脱水特性,并通过粉末-X衍射(PXRD)试验对晶型的转变进行确证。晶型A在相对湿度(RH)>85%时开始吸水;当RH达到95%时吸收水分约6%;当RH降至85%时,形成了二水合物(晶型E)(图9a)。晶型B(无水物)的水合/脱水过程可分为二个阶段:在RH 70%~85%范围吸附约6.2%的水,首先形成晶型A;再随着RH的增加持续吸收水分,当RH达到95%时吸水量为21.2%;当RH再降至85%时,吸水量为12.1%,形成了二水合物(晶型E)(图9b)。该结果提示晶型B的第一步水合作用具有较低的能垒,也说明晶型A晶体和晶型B的结构较相似。晶型D(无水物)与晶型B的水合特性不同,吸收水分后直接转化为二水合物(图9c):晶型D当RH在0~80%范围水分含量基本不变;之后开始逐渐吸附水分,当RH达到95%时,吸水量约15%;RH再次下降到80%时,吸水量约12.4%,形成了晶型E(二水合物)。晶型D与晶型A晶格结构的差异使其无法直接转变成晶型A。晶型E在RH大于80%时开始吸水,当HR为95%时可吸收约4%的水(图9d);其对水分的高度稳定性可能与水分子与API分子之间具有较强的配位键和丰富的氢键有关。上述结果提示,无水物晶体中分子间的相互作用保证了晶体结构的稳定性,而在水合物晶体中,分子间较强的配位键和丰富的氢键相互作用保证了水合物晶体的稳定性。不同晶型的阿维巴坦钠对水的稳定性依次为晶型B<晶型D<晶型A<晶型E。
对阿维巴坦钠的晶体稳定性特性揭示,虽然其可以形成多种不同的晶型,但不同晶型在固体状态均较稳定。对阿维巴坦钠的水解反应等降解反应特性的报道目前尚较少见,脱羰基阿维巴坦(CAS:2243810-78-6)(decarbonylated avibatan)可能是其主要的降解(水解)产物。因而,系统地揭示阿维巴坦钠的水解反应途径是阿维巴坦钠及制剂杂质谱控制的关键。
参 考 文 献
Lima L M, Monteiro da Silva B N, Barbosa G, et al. β-Lactam antibiotics: An overview from a medicinal chemistry perspective[J]. Eur J Med Chem, https://doi.org/10.1016/j.ejmech.2020.112829.
韩江雪, 刘忆霜, 肖春玲. β-内酰胺酶抑制剂研究进展[J]. 中国抗生素杂志, 2019, 44(6): 647-653.
郑卫. β-内酰胺酶及其抑制剂研究进展[J]. 国外医药抗生素分册, 2001, 22(2): 49-56.
宋丹青, 张致平. 青霉烷砜类β-内酰胺酶抑制剂的研究进展[J]. 国外医药抗生素分册, 2000, 21(2): 68-70.
曾志旋, 曹胜华, 陈林. 新型β-内酰胺酶抑制剂—阿维巴坦的研究进展[J]. 国外医药抗生素分册, 2014, 35(2): 58-62.
Coleman K. Diazabicyclooctanes (DBOs): A potent new class of non-beta-lactam beta-lactamase inhibitors[J]. Curr Opin Microbiol, 2011, 14(5): 550-555.
Wang D Y, Abboud M I, Markoulides M S, et al. The road to avibactam: the first clinically useful non-β-lactam working somewhat like a β-lactam[J]. Future Med Chem, 2016, 8(10): 1063-1084.
Docquiera J D, Manganib S. An update on β-lactamase inhibitor discovery and development[J]. Drug Resist Update, 2018, 36: 13-29.
Bersanetti P A, Almeida R M R G, Barboza M, et al. Kinetic studies on clavulanic acid degradation[J]. Biochem Eng J, 2005, 23(1): 31-36.
Santos V C, Pereira J F B, Haga R B, et al. Stability of clavulanic acid under variable pH, ionic strength and temperature conditions. A new kinetic approach[J]. Biochem Eng J, 2009, 45(2): 89-93.
Haginaka J, Nakagawa T, Uno T. Stability of clavulanic acid in aqueous solutions[J]. Chem Pharm Bull, 1981, 29(11): 3334-3341.
Finn M J, Harris M A, Hunt E, et al. Studies on the hydrolysis of clavulanic acid[J]. J Chem Soc Perkin Trans 1, 1984: 1345-1349.
Haginaka J, Yasuda H, Uno T, et al. Degradation of clavulanic acid in aqueous alkaline solution: Isolation and structural investigation of degradation products[J]. Chem Pharm Bull, 1985, 33(1): 218-224.
Haginaka J, Yasuda H, Uno T, et al. Alkaline degradation of clavulanic acid and high performance liquid chromatographic determination by post-column alkaline degradation[J]. Chem Pharm Bull, 1983, 31(12): 4436-4447.
Davies J S, Howarth T T. Clavulanic acid. Rearrangement to 3, 4-disubstituted pyrroles[J]. Tetrahedron Lett, 1982, 23(30): 3109-3112.
Bird A E, Bellis J M, Gasson B C. Spectrophotometric assay of clavulanic acid by reaction with imidazole[J]. Analyst, 1982, 107(1279): 1241-1245.
崇小萌, 李進, 王琰, 等. 阿莫西林克拉维酸钾片剂的关键质量属性与控制[J]. 药学学报, 2016, 51(7): 1121-1124.
薛晶, 朱克旭, 崇小萌, 等. 水分对阿莫西林克拉维酸钾颗粒稳定性的影响[J]. 中国药学杂志, 2016, 51(3): 224-229.
Haginaka J, Wakai J, Yasuda H, et al. Degradation kinetics of sodium sulbactam in aqueous solutions[J]. Chem Pharm Bull, 1985, 33(6): 2461-2468.
Haginaka J, Wakai J, Yasuda H, et al. Alkaline degradation of sulbactam[J]. Chem Pharm Bull, 1985, 33(5): 2035-2043.
Toomer C A, Schwalbe C H, Ringan N S, et al. Structural studies on tazobactam[J]. J Med Chem, 1991, 34(7): 1944-1947.
Takahashi M, Uekusa H. Dehydration and rehydration mechanisms of pharmaceutical crystals: Classification of hydrates by activation energy[J]. J Pharm Sci, 2021. https://doi.org/10.1016/j.xphs.2021.10.033.
袁耀佐, 胡昌勤, 金少鸿. 他唑巴坦中结晶水的研究[J]. 药学学报, 2002, 37(2): 144-147.
Marunaka T, Matsushima E, Minami Y, et al. Degradation of β-lactamase inhibitor, (2S,3R,5S)-3-methyl-7-oxo-3-(1H-1,2,3-triazol-1-yl-methyl)-4-thia-1-azabicyclo[3.2.0]heptane-2-carboxylic acid 4,4-dioxide (YTR-830H), in aqueous solutions and alkaline methanol solution: Pathway and structural elucidation of products[J]. Chem Pharm Bull, 1988, 36(11): 4478-4487.
Matsushima E, Yoshida K I, Azuma R, et al. Degradation of β-lactamase inhibitor (2S, 3R, 5S)-3-methyl-7-oxo-3-(1H-1, 2, 3-triazol-1-yl-methyl)-4-thia-1-azabicyclo [3.2. 0]-heptane-2-carboxylic acid 4, 4-dioxide (YTR-830H) in the solid state: Structural elucidation[J]. Chem Pharm Bull, 1988, 36(11): 4593-4596.
姚蕾, 施亞琴, 胡昌勤. 注射用氨苄西林钠舒巴坦钠中有关物质HPLC检测方法的改进[J]. 中国抗生素杂志, 2009, 34(12): 734-738.
Ding Z, Su W, Huang X, et al. Understanding the role of water in different solid forms of avibactam sodium and its affecting mechanism[J]. Cryst Growth Des, 2020, 20(2): 1150-1161.

