注射用头孢他啶的质量分析
杜旭?刘海玲?郭艳娟?张琳?王悦雯?鲁瑞娟?杨倩?唐素芳


摘要:目的 评价国内注射用头孢他啶的质量现状。方法 采用调研、文献检索、法定标准检验结合探索性研究的方式,对国内36家企业生产的177批次的注射用头孢他啶和原研制剂的质量进行比较分析;通过对杂质谱、配伍稳定性、包材相容性等关键质量属性进行考察,分析不同企业产品的质量差异。结果 177批次注射用头孢他啶按法定标准检验均符合规定;但质量标准仍然存在部分项目检验方法和限度不统一,药品说明书表述不一致等问题。探索性研究中,优化了有关物质分析方法,采用LC/MS对产品中杂质的可能结构进行了推断,对其来源进行了分析。配伍稳定性结果表明,部分企业药品说明书不合理,存在风险隐患。结论 注射用头孢他啶总体质量较好,现行标准有待统一和提高。
关键词:注射用头孢他啶;国家药品抽检;质量分析
中圖分类号:R978.1文献标志码:A
Quality analysis of ceftazidime for injection
Abstract Objective This research evaluated the quality status of ceftazidime for injection. Methods Using statutory testing procedures in conjunction with exploratory research, 177 batches of ceftazidime for injection, manufactured by 36 companies, and one batch of the original medication were compared. The quality differences of products from different manufacturers were analyzed by investigating key quality attributes such as impurity profiles, compatible stability and packaging material compatibility. Results All 177 batches of ceftazidime for injection complied with the requirements. However, there were still some problems in the specifications, such as inconsistent determination methods and limits for some items and so on. Also, the description of drug instructions was inconsistent. In the exploratory study, the impurity analysis method was optimized, and the possible structure of impurities in the product was inferred by LC/MS and their source was analyzed. The results of compatible stability tests showed that the drug instructions of some manufacturers were unreasonable and there were hidden risks. Conclusion The overall quality of ceftazidime for injection was acceptable, but the current specification needed to be unified and improved.
Key words Ceftazidime for injection; National drug sampling; Quality analysis
头孢他啶为第三代头孢菌素,通过抑制细菌细胞壁的合成发挥抗菌作用。头孢他啶由葛兰素史克公司于1978年开发。注射用头孢他啶于1983年首次在英国上市,商品名为Fortum?。主要用于敏感革兰阴性杆菌,尤其铜绿假单胞菌等所致的各种感染,对铜绿假单胞菌的抗菌作用在第三代头孢菌素中最强。注射用头孢他啶由头孢他啶原料与助溶剂碳酸钠或精氨酸混合制成,临床中被广泛应用于呼吸科、皮肤科、妇产科、骨科和泌尿科等敏感菌导致的感染。1985年国产仿制品获准上市,1993年列入《国家基本药物目录》。《中国药典》自2000年版起收载注射用头孢他啶。目前注射用头孢他啶在《中国药典》2020年版、USP2022、BP2022和JP18中均有收载。
据国家药品监督管理局网站数据库检索,注射用头孢他啶国内批准文号有286个,共有0.5、0.75、1.0、1.5、2.0和3.0 g等6种规格,涉及生产企业81家;另有进口药品批准文号11个,涉及生产企业4家,规格为0.5和1.0 g。本品的不良反应轻且少见,不良反应发生率约2.5%,皮疹最常见,偶见药物热、静脉炎、注射部位疼痛、嗜酸性粒细胞增多等不良反应[1]。
为加强对上市后药品质量的监管,国家药品监督管理局将注射用头孢他啶列入2022年度国家药品抽检计划。国家药品抽检旨在客观地评价国内上市药品的质量现状,分析产品质量问题以保障公众用药安全。本文通过对注射用头孢他啶的标准检验和探索性研究,从安全性、有效性和质量可控性角度对其质量状况进行全面地评价,并对其产品质量的改进提出建议。
1 试药与样品
177批注射用头孢他啶为2022年国家药品抽检样品,涉及36个生产企业,另有1批次为原研制剂(意大利史克,批号:2002E1)。
头孢他啶对照品(批号:130484-202107,纯度86.1%),7-ACA对照品(批号:130538-20002),7-ADCA对照品(批号:130416-2010)购自中国食品药品检定研究院;杂质A对照品(批号:20-APR-19-01)购自美国Qualtiy Control Chemicals Inc;杂质B对照品(批号:4452-087A3),杂质C对照品(批号:2969-071A4),杂质E对照品(批号:1425-016A1),杂质G对照品(批号:4831-014A9),杂质H对照品(批号:4780-058A3)购自TLC Pharmaceutical Standards Ltd.;杂质F对照品(批号:G880916)购自英国Laboratory of the Government Chemist;杂质M对照品(批号:5001A17T)购自浙江普洛得邦制药有限公司。
甲醇(色谱纯)、乙腈(色谱纯)为默克股份公司产品,磷酸、磷酸氢二钠和磷酸二氢钾(分析纯)为国药集团化学试剂有限公司产品,纯化水为自制。
2 试验方法
2.1 法定标准检验
法定检验涉及15个标准,包括《中国药典》2020年版和2015年版标准及13个国家药品监督管理局标准。177批注射用头孢他啶分别按各自执行标准进行检验。主要检验项目包括性状、鉴别、有关物质、吡啶、头孢他啶聚合物、含量均匀度和含量测定等。
2.2 探索性研究
2.2.1 优化的HPLC杂质谱分析方法
色谱条件:采用OSAKASODA CAPCELL PAK C18 MGⅡ(4.6 mm×250 mm,5 μm)色谱柱;流动相A为磷酸盐缓冲液(取磷酸氢二钠3.6 g,磷酸二氢钾1.4 g加水溶解并稀释至1000 mL, 用10%(V/V)磷酸溶液调节pH值至3.4),流动相B为乙腈;梯度洗脱:0~4 min(4%~11%B)→4~5 min(11%~11%B) →5~8 min(11%~16%B)→8~11 min(16%~20%B) →11~15 min(20%~50%B)→15~18 min(50%~80%B) →18~22 min(80%B)→22~23 min(80%~4%B)→23~33 min
(4%B);流速为1.3 mL/min,检测波长为254 nm。
头孢他啶强制聚合溶液的制备:称取头孢他啶原料适量,用水溶解并稀释成约含10 mg/mL的浓溶液,室温放置48 h后作为储备液。测定时用水稀释成约为1 mg/mL的溶液,进行聚合物类杂质的分析。
2.2.2 LC-MS分析
采用Waters ACQUITY UPLCTM2D色谱仪及Xevo G2-S QTof质谱系统对已知杂质和主要的降解杂质进行定性分析。色谱条件同“2.2.1”的HPLC方法,仅以0.1%的乙酸铵溶液(甲酸调节pH至3.4)替代原方法的流动相A。
质谱条件:离子源为ESI源,正离子模式,扫描范围:m/z 50~1500;离子源温度:110 ℃;毛细管电压3.0 kV;雾化器温度:450 ℃;雾化器流速800 L/h。
2.2.3 残留溶剂分析
采用Agilent7890A气相色谱仪,Agilent HP-1(60 m×
0.53 mm×5 ?m)色谱柱;柱温为程序升温,初始温度65 ℃保持8 min,20 ℃/min升至150 ℃,保持
5 min,50 ℃/min升至200 ℃,保持7 min;进样口温度170 ℃;检测器温度250 ℃;顶空进样方式,顶空瓶温度70 ℃;平衡时间30 min;进样量1 mL;载气为N2,流速4 mL/min;分流比:10:1。
2.2.4 包材相容性研究
对胶塞中可提取物分析。采用岛津GC-MS-TQ8050三重四级杆气相色谱质谱联用仪分别对提取物中的挥发性、半挥发性和特殊有机物进行分析。胶塞分别剪成细小颗粒进行实验。①挥发性有机物采用80 ℃顶空进样;利用仪器的Scan模式,对比NIST14数据库进行定性和半定量分析。②半挥发有机物以甲醇为提取溶剂,采用50 ℃保温3 d后液体进样;利用仪器的SIM扫描模式,以保留时间,离子对以及离子相对丰度比与对照品溶液比较,进行定性和定量分析。③特殊有机物测定,以甲醇为提取溶剂,采用50 ℃保温3 d后液体进样;利用仪器的MRM扫描模式,以保留时间,离子对以及離子相对丰度比与对照品溶液比较,进行定性和定量分析。
玻璃中金属元素的浸出物实验。采用ICAP7400电感耦合等离子体发射光谱仪考察25种目标元素(Al、As、B、Ba、Ca、Cd、Co、Cr、Cu、Fe、Hg、K、Li、Mg、Mn、Mo、Ni、Pb、Sb、Se、Si、Sn、Ti、V、Zn)。对0 d和加速放置10 d的注射用头孢他啶浸出物进行测定。
采用HPLC-PDA法对注射用头孢他啶中的抗氧剂、降解产物、抗氧剂BHT及可提取硫的浸出量进行测定。对0 d及加速放置10 d的注射用头孢他啶浸出物进行测定。
2.2.5 粒度和粒度分布分析
采用Mastersizer 2000激光粒度仪,按照不同助溶剂、不同原料来源和不同生产工艺的样品随机抽取,进行粒度分布分析。
2.2.6 晶型比较
采用X2TP-2 POL偏光显微镜、ZEISS MERLIN Compact型高分辨率场发射扫描电镜、Bruker TENSOR 27红外分光光度计和D2 PHASER X射线衍射仪对不同企业的原料、添加了助溶剂的注射剂以及原研样品的晶型进行比较。
2.2.7 配伍稳定性研究
参考文献[2],模拟临床使用情况,分别采用5%葡萄糖注射液、0.9%氯化钠注射液稀释注射剂,于不同温度、不同时段取配伍溶液对有关物质、吡啶、pH值、渗透压等主要指标进行测定,考察不同原料来源、不同工艺的样品在不同助溶剂中的质量变化情况。
3 结果与讨论
本次国家药品抽检获得36家企业生产的177批样品,来自28个省(自治区、直辖市),涉及批准文号49个,约65%的样品抽自经营单位。样品的覆盖面较广,其质量基本可反映国内注射用头孢他啶的现状。
3.1 法定检验结果及分析
按现行质量标准检验,177批注射用头孢他啶均符合规定。对与产品质量密切相关的质控项目进行分析:pH值分布在5.8~7.0之间,均值为6.5;头孢他啶聚合物含量分布0.02%~0.20%之间,均值0.08%,但部分结果较为离散;有关物质中最大杂质含量分布为0.06%~0.45%,总杂质含量为0.11%~0.89%,但部分企业的不同批次样品差距较大。
目前注射用头孢他啶的现行质量标准有15个,各标准在检验项目、检验方法和限度规定等方面均存在一定差异,主要表现为有关物质检查,《中国药典》2020年版仅控制“单一杂质”和“总杂质”,且限度明显宽于国家药监局标准,使得执行药典标准的企业样品杂质含量明显高于执行注册标准企业的样品,且不同企业的产品较难通过法定检验对质量进行比较。此外,所有质量标准均采用葡聚糖凝胶G10色谱法控制头孢他啶聚合物,该方法专属性差,分析时间长,且聚合物的限度远高于与实际样品中聚合物的量。
3.2 探索性研究结果
根据法定检验结果,结合调研、文献检索的情况,围绕着药品的安全性、有效性和质量可控性,对注射用头孢他啶的杂质谱、基因毒性杂质、残留溶剂、包材相容性、粒度和粒度分布、晶型及配伍稳定性等方面开展探索性研究。
3.2.1 杂质谱分析
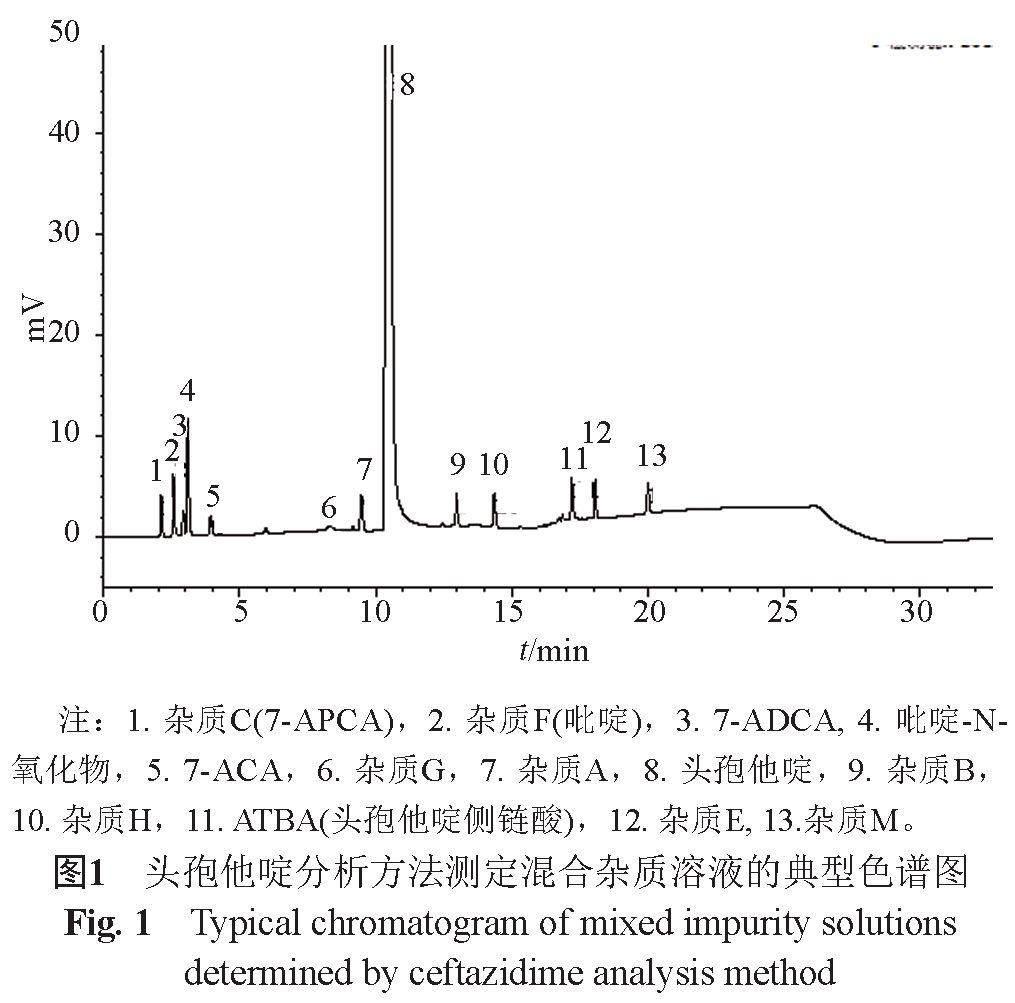
针对《中国药典》2020年版等头孢他啶现行质量标准未对其特定杂质进行控制的现状,在已有方法的基础上,结合文献[3~8],对色谱方法进行了优化,优化后的色谱方法可实现对头孢他啶中的诸已知杂质良好分离(图1)。在此基础上采用LC-QTOF/MS法对其降解杂质进行定性分析(图2),并结合生产工艺及文献,分析诸杂质的可能来源,推断出了主要酸降解产物(杂质7)、氧化降解产物(杂质6)及热降解产物(杂质4、杂质13)的可能结构(表1)。
采用改进后的分析方法对不同原料来源、不同助溶剂、不同生产工艺样品中的杂质进行分析,部分样品中杂质H(头孢他啶甲酯)为最大杂质。虽然杂质H的毒性作用大于头孢他啶[9],但进一步对其ADME和特定毒性反应的评估提示其可作为普通杂质控制[10],BP2022和通过一致性评价品种的注册标准均将杂质H作为“其他杂质”,限度控制为0.10%或0.1%。合成过程中通过对甲醇含量的控制可使其含量明显降低。
2-巯基苯并噻唑(杂质M)是合成过程中产生的1类致癌物质。对不同工艺的原料和制剂的测定结果表明,杂质M的含量按头孢他啶计在0.002~0.74 ppm之间,平均为0.31 ppm,远远小于规定的限度20 ppm。
由于常规HPLC色谱系统中含磷酸盐缓冲液的流动相不适宜用于质谱分析,在进行LC-MS分析时,采用乙酸铵溶液替代磷酸盐缓冲液,可满足MS分析的基本要求。经比较两色谱系统的杂质检出能力相当,杂质峰的洗脱顺序一致(图3),但流动相为磷酸盐缓冲液时基线更为平稳,有利于对微量杂质的检测。
采用二维液质联用技术亦是解决色谱流动相与质谱分析不相匹配的方法之一。由于本品中含量≥0.1%的杂质均为已知杂质,未知杂质的含量大都在0.05%以下,在对微量未知杂质进行定性分析时,二维液质联用技术在灵敏度及检测效率方面不具有优势。
3.2.2 头孢他啶聚合物
改进后的有关物质检查方法能够有效地检出聚合物类杂质(图4)。采用液质联用技术对强制聚合溶液(图5)和供试品溶液(图4)中的聚合物类杂质进行定性分析,推断聚合物杂质的可能结构(表2,图6)。结果表明,降解溶液中含有多种聚合物类杂质,聚合物杂质存在同分异构体,与文献[11]报道一致。不同来源的样品中聚合物类杂质的结构相似但与强制聚合溶液中的聚合物不一致。
由图4可见,头孢他啶中主要聚合物杂质的保留时间均介于已知杂质H与杂质E之间;对39批样品的测定表明,其含量均小于忽略限0.05%。注射用头孢他啶现行标准中均采用G10凝胶色谱法控制聚合物类杂质。凝胶色谱法测定头孢菌素聚合物的专属性已受到广泛质疑,本研究为注射用头孢他啶聚合物测定方法的修订提供了基础数据。
3.2.3 残留溶剂
注射用头孢他啶为头孢他啶无菌原料与碳酸钠或精氨酸直接混合分装制得,对其溶剂残留的分析可以揭示头孢他啶原料中残留溶剂的现状。经调研,头孢他啶在生产过程中可能引入的有机溶剂有甲醇、乙醇、乙腈、丙酮、二氯甲烷、叔丁醇和三乙胺等。其中甲醇、乙腈、二氯甲烷、叔丁醇属于二类溶剂,乙醇、丙酮、三乙胺属于三类有机溶剂[12]。分析结果显示,本品及其原料残留溶剂测定的结果差异不大,各批样品中均仅检出丙酮,含量远低于0.5%的限度值,其他残留溶剂均低于检测限。
3.2.4 包材相容性分析
采用气质联用技术,对胶塞中可提取物包括挥发性、半挥发性、难挥发性有机物及特殊有机物进行分析,结果均未超过50%AET的限值。
按照《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)》及ICH-Q3D的要求,开展玻璃中元素的遷移实验。采用所建立的ICP-OES对可能迁移到制剂中的25种金属元素进行考察,全部样品结果均符合要求。
按照弹性体密封件指导原则的要求,开展胶塞中抗氧剂的迁移实验。对全部样品包括原研样品中胶塞可能迁移至样品中的常见抗氧剂及降解产物进行筛查,结果均符合要求。
上述結果提示,目前市场上的注射用头孢他啶与其包装材料的相容性良好。
3.2.5 配伍稳定性试验
对注射用头孢他啶与临床中常用的溶液(5%葡萄糖注射液、0.9%氯化钠注射液)的配伍稳定性进行了分析,结果显示,室温放置时,样品均不稳定,有关物质和吡啶含量大幅增长。在室温放置24 h后,已知杂质、最大单一未知杂质和总杂质的量均明显增加,其中杂质G由低于忽略限增加到2.8%左右,总杂质由0.6%增加到3.7%以上,吡啶含量由0.1%增长到0.7%左右。但冷藏放置24 h,总杂质基本无变化。
目前各企业的注射用头孢他啶药品说明书,在用法用量和注意事项中对配伍稳定的表述各不相同。有的说明书标示为“以生理盐水、5%葡萄糖注射液或乳酸钠稀释成的静脉注射液在室温存放不宜超过24 h”;有的标示为“头孢他啶可与常用的静脉注射溶液配伍,为了符合制剂的管理要求,最好使用新配制的头孢他啶注射液。如果不能实现,存放在2~8 ℃冰箱中保存24 h可保持药效”。修订、统一药品说明书中配伍稳定性的说明,对保证临床用药安全性有重要意义。
3.2.6 其他与制剂相关的关键质量属性
对抽检样品与原研样品在复溶时间、粉末粒度分布、晶型等方面进行了比较,均未发现抽检样品与原研产品的质量存在明显差异。绝大部分样品粒度分布基本一致;个别企业、批次的粒度分布稍有差异;但对粒度分布结果和复溶时间进行相关性分析,二者无相关性。不同来源的原料粉末X射线衍射图基本一致,主要特征峰的2 θ相同;不同来源的原料的红外光谱图也基本一致。采用扫描电镜法观察,国内各厂家原料均为片状方形结晶(图7)。本品制剂中的辅料为无水碳酸钠或精氨酸,无水碳酸钠为无定型粉末,精氨酸为结晶性粉末,在电镜图中可明显区分,制剂中的晶体形状也基本相同,进一步判定国产原料药的晶型基本相同。
4 结论
本次国家药品抽检采用法定标准检验结合探索性研究的方式,结合调研、文献检索,对国内注射用头孢他啶的质量现状进行了全面的分析和评价。
按照法定标准检验,177批次样品均符合规定,说明注射用头孢他啶质量总体评价较好。质量标准方面,本品执行的质量标准有药典标准及13个国家药品监督管理局标准,其中有关物质测定方法的差异较大,统一质量标准有助于促进生产企业进行工艺的提升。
探索性研究对有关物质检查方法进行了优化,并对不同来源样品中杂质的来源、结构进行了推测,其可以同时控制头孢他啶聚合物类杂质。配伍稳定性研究表明,应尽快修订或完善药品使用说明书,以确保临床用药的安全性和有效性。
参 考 文 献
冷慧敏, 姜天华, 李成建. 头孢他啶所致不良反应近况文献概述[J].中国药物滥用防治杂志, 2018, 24(1): 48-49.
郑晨, 王钰, 何晓静, 等. 对头孢他啶注射液稳定性的影响因素研究[J]. 中国临床药理学杂志, 2017, 33(23): 2443-2445.
吴琦琦, 李晓燕, 李文莉. 部分国产注射用头孢他啶与原研产品杂质研究[J]. 中国新药杂志, 2015, 24(8): 947-953.
王双双, 宋凡, 杭太俊, 等. 注射用头孢他啶有关物质的色谱-质谱结构鉴定[J]. 中国新药杂志, 2018, 27(1): 102-109.
孙雪奇, 王野, 刘峥, 等. 注射用头孢他啶杂质研究[J]. 药物分析杂志, 2012, 32(12): 2234-2239.
胡昌勤. β-内酰胺抗生素聚合物分析技术的展望[J]. 中国新药杂志, 2008, 17(24): 2098-2102.
李进, 张培培, 姚尚辰, 等. 注射用哌拉西林钠他唑巴坦钠的聚合物杂质分析[J]. 药物分析杂志, 2019, 39(7): 1279-1294.
李进, 姚尚晨, 尹利辉, 等. 头孢他啶原料及制剂的聚合物杂质分析[J]. 药学学报, 2020, 55(8): 1889-1896.
孙雪齐, 张姮婕, 袁军, 等. 头孢他啶杂质H研究[J]. 药物分析杂志, 2014, 34(9): 1605-1610.
Han Y, Zhang J, Hu C, et al. In silico ADME and toxicity prediction of ceftazidime and its impurities[J]. Front Pharmacol, 2019, 10: 434.
胡昌勤, 李进, 张夏. 7-氨噻肟头孢菌素聚合物分析[J]. 中国抗生素杂志, 2022, 47(3): 209.
ICH.Q3C(R8): Guideline for residual solvents [EB/OL]. (2021-04-22) [2021-08-08] https://database.ich.org/sites/default/files/ICH_Q3C-R8_Guideline_Step4_2021_0422_1.pdf.

