注射用亚胺培南西司他丁钠质量分析
彭洁?贾艳花?李佩?肖慧?罗嘉琳?李何杏?王婷婷?洪建文
摘要:目的 对国内市场中不同企业的注射用亚胺培南西司他丁钠的质量状况进行评价,发现质量风险点,为仿制药一致性评价提供质量控制关键点。方法 采用法定检验结合探索性研究的方法对样品进行检验,统计分析注射用亚胺培南西司他丁钠的整体质量水平,分析不同企业产品的差异。结果 按法定标准检验,80批次抽验样品结果均符合规定。但发现原研产品的复溶时间更快;不同企业的产品有关物质和含量结果差异较大;现行质量标准差异较大亟待提高统一。探索性研究表明,样品复溶时间与制剂中亚胺培南晶癖及粒度相关;采用LC/MS等方法对本品有关物质的来源进行了归属,对部分杂质结构进行了推断;对本品的含量测定方法进行了优化。结论 国内市场中注射用亚胺培南西司他丁钠的质量总体较好;在开展仿制药一致性评价工作中,需关注亚胺培南的晶癖以及制剂的有关物质、含量、充氮工艺和异亚丙基丙酮等质量关键点;现行标准有待统一和提高。
关键词:注射用亚胺培南西司他丁钠;质量分析;晶癖;有关物质;含量
中图分类号:R978.1,R917文献标志码:A
Quality assessment of imipenem and cilastatin sodium for injection
Abstract Objective This study evaluated the quality status of imipenem and cilastatin sodium for injection from different manufacturers in the domestic market, found out the quality risk points, and provided key quality control points for the consistency evaluation of generic drugs. Methods The statutory testing methods combined with the exploratory research were used to examine samples, and the quality status of imipenem and cilastatin sodium for injection and the differences between different manufacturers were also analyzed. Results According to the statutory testing of 80 baths, all complied with regulations. However, it was found that the original products were dissolved faster. There were significant differences in related substances and assays from the productions of different manufacturers. And there were significant differences in current standards; therefore, the statutory standards needed to be improved and unified. It was shown that the solubility of the sample was related to the crystal habit and granularity of imipenem by exploratory research. The source and the structure of some impurities were identified by LC/MS. The determination method of the assay was optimized. Conclusion The quality of imipenem and cilastatin sodium for injection in the domestic market was good; in conducting consistency evaluations of generic drugs, the crystal habit of imipenem, related substances, contents, nitrogen charging technology and mesityl oxide for the injection should be paid attention to. The statutory standards needed to be integrated and improved.
Key words Imipenem and cilastatin sodium for injection; Quality analysis; Crystal habit; Related substances; Contents
亞胺培南为碳青霉烯类抗生素, 其在体内约80%以上可被肾脱氢辅酶I(肾辅酶I,DHPI)分解。临床中常将亚胺培南与肾脱氢辅酶I抑制剂西司他丁作为复方制剂使用。注射用亚胺培南西司他丁钠(商品名“泰能”)由美国默沙东公司研发,并在1985年被批准上市。目前,该品种尚未被《中国药典》收载,但是在英国药典2023年版(BP2023)、美国药典在线版(USP-NF Online版,生效日期2018年5月1日)和日本药典18版(JP18)收载其原料和制剂。该品种制剂有国产批文10个,进口批文10个,国内上市产品规格有0.5、1.0和2.0 g。原研药“泰能”在国内销售的规格为1.0 g(亚胺培南500 mg和西司他丁钠500 mg)。
为更好地了解国内药品的质量状况,注射用亚胺培南西司他丁钠被列为2022年度国家药品抽检计划品种。本文在完成法定标准检验的基础上,针对检验中发现的质量风险开展探索性研究,尝试从安全性、有效性、质量可控的角度发现质量风险点,为仿制药一致性评价提供质量控制的关键点。
1 材料与方法
1.1 仪器与试剂
1260-6460液质联用仪(美国Agilent公司)、1260液相色谱仪(美国Agilent公司)、2695液相色谱仪(美国Waters公司)、LC20A液相色谱仪(日本Shimadzu公司)、 Evolution 300可见-紫外分光光度计(带VISION lite Color Calc软件,美国ThermoFisher公司)、6890气相色谱仪(美国Agilent公司)、SU8100场发射电子显微镜(日本Hitachi公司),LS13320激光粒度分析仪(美国BeckmanCoulter公司)、X射线衍射仪(日本Rigaku公司)、CP225D电子天平(德国Sartorius公司)。
乙腈为质谱级,乙酸铵为色谱级,其余试剂为分析纯,水为超纯水。
1.2 样品
亚胺培南对照品(批号:3.0,92.5%)、西司他丁系统适用性对照品1(批号:1.1)、西司他丁系统适用性对照品2(批号:1.1)为EDQM对照品;西司他丁铵对照品(批号:R12300,94.3%)为USP对照品。
80批次注射用亚胺培南西司他丁钠均为2022年国家药品抽检样品,涉及8家生产企业,其中3家为进口生产企业,5家为国内生产企业。对应的原料涉及6家生产企业(进口和国内生产企业各3家)。
2 实验方法
2.1 法定检验
根据各企业药品批准文号信息,按相应的注册标准进行法定检验。主要项目包括性状、液相鉴别、钠盐鉴别、碳酸盐与碳酸氢钠盐鉴别、酸碱度、澄清度与颜色、有关物质、装量差异或含量均匀度、干燥失重、溶解性、细菌内毒素、无菌、可见异物、不溶性微粒和含量测定等。
2.2 探索性研究
2.2.1 复溶时间
取本品1瓶,从装有100 mL(规格为1.0 g时,如规格为0.5 g时则为50 mL,以此类推)的0.9%氯化钠注射液的输液瓶中取出10%注入样品瓶中,摇匀,将混悬液转移至输液瓶中,重复上述步骤一次,以保证样品瓶中的内容物完全转移。以200~210 次/min的频率振摇60 s,静置45 s,在澄明度仪下观察供试品是否完全溶解。若供试品未完全溶解,则继续以200~210 次/min的频率振摇30 s,静置45 s,在澄明度仪下观察供试品是否完全溶解。重复上述步骤至本品完全溶解,计算溶解所需时间(静置时间不计)。
2.2.2 有关物质分析
RP-HPLC分析:采用BP2023收載的注射用亚胺培南西司他丁钠有关物质方法对样品进行测定。
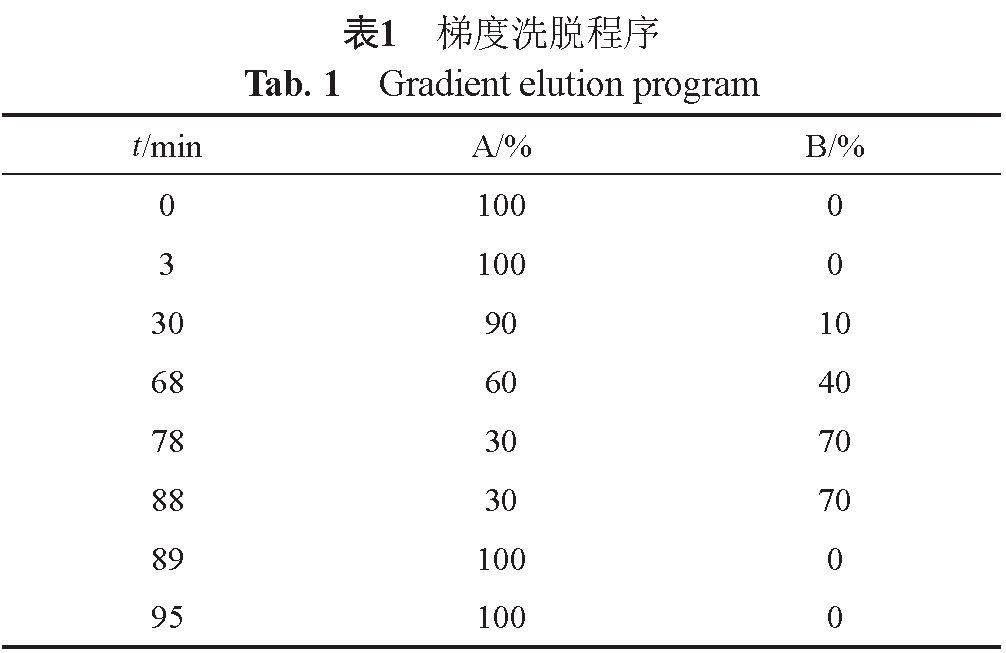
LC-MS分析:采用1260-6460液质联用,YMC Pack ODS-AQ色谱柱(250 mm×4.6 mm,5 ?m);以
5 mmol/L乙酸铵溶液(用氨水调节pH值至5.6)为流动相A,5 mmol/L乙酸铵溶液(用甲酸调节pH值至3.0)-乙腈(50:50)为流动相B,按表1进行梯度洗脱;柱温为
30 ℃,流速为1.5 mL/min,进样20 ?L;采用紫外检测器串联质谱检测器进行检测,紫外检测波长为210 nm,
同时利用分流装置分流紫外检测器的部分流出液至质谱检测器,对各企业产品的有关物质进行分析。
2.2.3 含量测定
RP-HPLC分析:以0.15%庚烷磺酸钠的磷酸盐缓冲液(取磷酸二氢钾3.4 g,加水溶解并稀释制成1000 mL,用5 mol/L的氢氧化钾溶液调节pH值至7.0±0.1)-甲醇(93:7, V/V)为流动相,检测波长为254 nm。
精密量取供试品溶液和对照品溶液各20 μL,分别注入液相色谱仪,记录色谱图。
2.2.4 加速稳定性试验
选取代表性批次样品16批次,倒置在60 ℃、湿度75%的条件下,分别于第5天和第10天定期取样,考察复溶时间、有关物质以及澄清度与颜色的变化。
2.2.5 残留溶剂
顶空气相色谱分析:采用DB-624毛细管柱
(1.4 μm×0.25 mm×30 mm),程序升温,起始温度为40 ℃,保持32 min,以30 ℃/min的速率升温至
120 ℃,保持10 min,以50 ℃/min的速率升温至200℃,保持5 min;载气为氮气,流速为1 mL/min;FID进样口温度为280 ℃;检测器温度为230 ℃;顶空平衡温度为80 ℃,平衡时间为30 min。将对照品溶液与供试品溶液分别顶空进样,记录色谱图。
2.2.6 晶型/晶癖分析
采用粉末X射线衍射仪分析亚胺培南原料、西司他丁钠原料以及注射用亚胺培南西司他丁钠的晶型;采用激光粒度分析仪对其粒度与粒度分布进行测定;并采用场发射电子显微镜,观察其微观结构。
3 结果与讨论
3.1 法定检验结果与分析
对80批次注射亚胺培南西司他丁钠进行法定检验,全部样品均符合规定。对现行标准中与产品质量密切的质控项目如有关物质、含量测定等结果进行统计分析。
3.1.1 有关物质
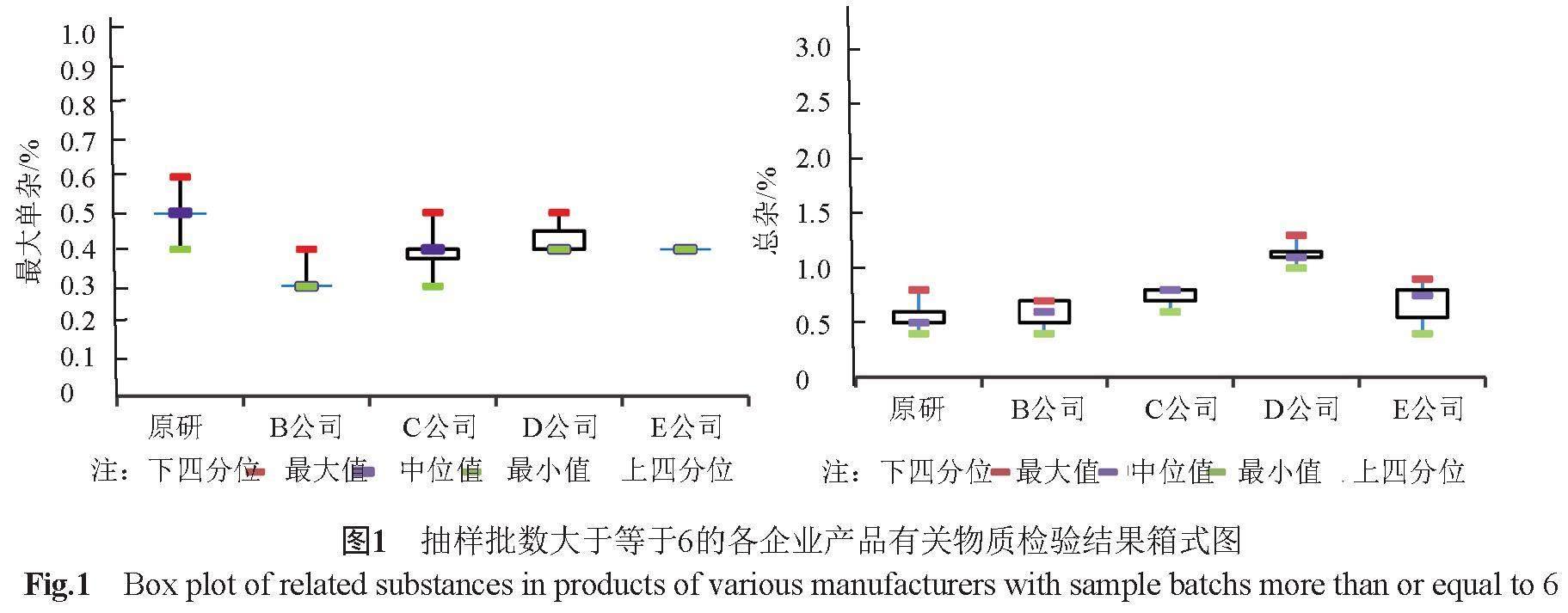
不同企业产品处方基本一致,但不同注册标准中的有关物质方法和限度存在较大差异。8家企业的注册标准仅2家对硫霉素等特定杂质进行了控制,其余仅控制最大单个杂质和总杂质。最大单个杂质的含量为0.3%~0.6%,总杂质含量为0.4%~1.3%。各企业产品有关物质差异较大,原研产品相对杂质个数少且总量低,均值为0.6%;部分企业如D公司产品总杂相对较高,均值超过1.0%(图1)。由于检验标准方法及限度不一致,提示本品有关物质检查项应统一修订提高。
3.1.2 含量测定
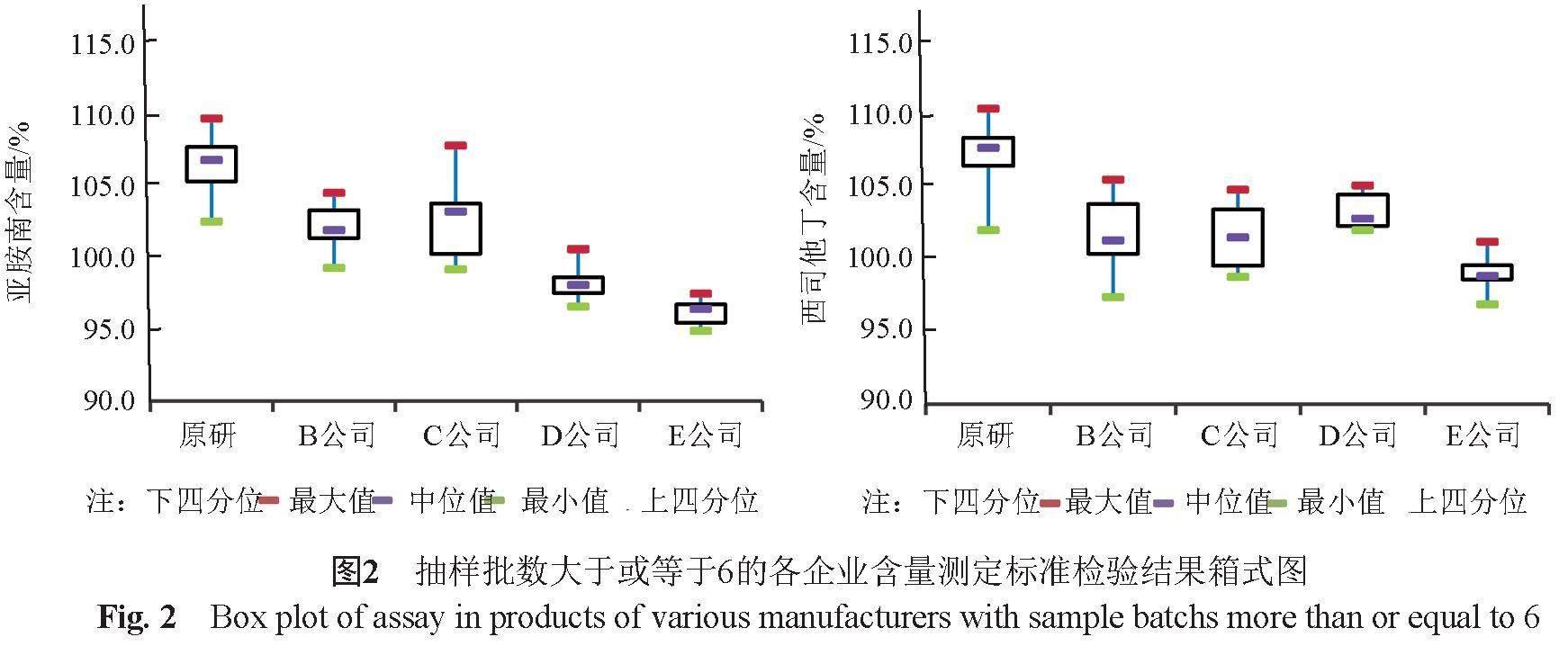
80批次样品按平均装量(或平均含量)计,亚胺培南含量为94.9%~109.7%,均值102.6%;西司他丁钠为96.9%~110.4%,均值103.6%。企业间差异大,原研产品含量最高,亚胺培南和西司他丁含量均值分别为106.4%和107.1%,E公司产品含量最低,均值分别为96.2%和99.0%,两者相差约10%(图2)。
本品亚胺培南与西司他丁的处方比例为1:1,亚胺培南与西司他丁的比值应为1。对不同企业两主成分含量比进行统计,发现部分企业产品含量比偏小,均值仅为0.95,个别批次低至0.92,起药效作用的亚胺培南的含量低,可能存在一定的风险。
实验发现部分注册标准的色谱条件苛刻,在柱温50 ℃的条件下,采用100%或接近100%的全盐相流动相进行测定,色谱柱柱效迅速下降,西司他丁峰展宽,提示本品含量测定的色谱条件有待优化。
3.2 探索性研究结果与分析
3.2.1 样品的复溶时间
复溶时间取决于主成分的物化参数,与临床应用的方便性相关,是难溶性注射用粉针剂仿制药一致性评价的关键点之一[1]。本品为复方制剂,在水中亚胺培南微溶,西司他丁钠极易溶解,亚胺培南的溶解是关键。对复溶时间的测定结果显示,原研产品均在1 min内溶解完全,其余产品需1.5~4.5 min;在加速稳定性试验中,原研产品的复溶时间保持不变,其余产品的复溶时间均有不同程度的增加(表2)。
对8家企业制剂、部分企业的亚胺培南原料和西司他丁钠原料进行晶型、粒度与粒度分布分析。
粉末X射线衍射分析显示,西司他丁钠原料为无定型粉末,亚胺培南原料的晶型基本一致;各企业的制剂晶型也基本一致。但在电子显微镜下进一步观测晶体的晶癖特征,西司他丁钠无定型粉末呈非晶态结构,不同企业亚胺培南的晶癖特征明显不同(图3a~b)。原研产品晶癖呈均匀的小方晶颗粒;其余产品则为大小不一的片状物或块状物(图3 c~j)。
不同企业的亚胺培南原料及制剂的粒度与粒度分布呈较大差异。制剂粒度与粒度分布的差异由其中亚胺培南原料的差异所致。表现为d(0.1)为0.69~9.21,d(0.5)为4.41~54.34,d(0.9)为21.7~316.1;亚胺培南原料d(0.1)为3.43~13.83,d(0.5)为17.59~63.56,d(0.9)为64.8~109.9。
对晶型、粒度与粒度分布与复溶时间的相关性进行分析。西司他丁钠原料为无定型粉末,且在水中极易溶解,故其对复溶时间的差异无影响。复溶时间最短的原研产品,亚胺培南晶癖呈均匀的小方晶颗粒,与其他产品的晶癖明显不同,提示亚胺培南晶癖是影响溶解速率的关键点;G公司和H公司制剂中的亚胺培南均来源于L公司(晶型、晶癖相同),但H公司产品的颗粒度更大,复溶时间更长,提示亚胺培南的粒度与粒度分布亦可影响其溶解速率。
3.2.2 有關物质分析
为对本品的杂质谱有更清晰全面地了解,对其中具有代表性的64批样品进行了检测,共检出杂质18个,其中9个为所有产品中共有的杂质(图4)。除药典及文献报道的杂质外,还发现5个未知杂质,结合LC/MS信息及文献[2-6],推测出2个杂质的结构(图5)。
对各厂家样品的杂质谱按亚胺培南杂质及西司他丁杂质进行了归属(表3)。亚胺培南杂质中,最大单杂均为硫霉素(亚胺培南杂质A),均值为0.7%;有3个降解杂质(亚胺培南杂质B1、B2和A)、1个工艺杂质(亚胺培南杂质E)和1个既是工艺杂质也是降解杂质(亚胺培南杂质C);厂家特有杂质3个(亚胺培南杂质D1、D2和E);亚胺培南总杂均值为1.3%。西司他丁杂质含量较低,最大单杂均为西司他丁杂质A,均值为0.2%;有2个降解杂质(西司他丁杂质A1和A2)、5个工艺杂质(西司他丁杂质B、C、F、I和J)和4个既是工艺杂质又是降解杂质(西司他丁杂质E、G1、G2、H);厂家特有杂质2个(西司他丁杂质I和J);西司他丁总杂均值为0.6%。
此外, LC/MS分析发现有分子量为598、554和595的三个较大杂质,其中598为亚胺培南二聚物杂质[2],
结合文献推断其余杂质分别为亚胺培南二聚物脱羧产物(亚胺培南杂质E)以及亚胺培南二聚物脱羧产物与西司他丁结合产物(西司他丁杂质J)。有关物质分析方法可同时控制本品的聚合物。
3.2.3 含量测定
针对部分注册标准HPLC含量测定方法色谱条件的缺陷,建立了新的含量测定方法。经方法学验证,方法的专属性良好;亚胺培南在浓度为0.0025~
5 mg/mL范围内线性关系良好(Y=5574.6X+129.99,r=0.9996);西司他丁在浓度为0.0025~5 mg/mL范围内线性关系(Y=3167X+29.439,r=0.9999);方法的精密度良好(RSD亚胺培南=0.6%,RSD西司他丁=0.6%);流动相中加入甲醇,耐用性提高。测定部分代表性批次样品并将其与原方法测定结果进行比较,两者偏差亚胺培南为0.1%~0.5%,西司他丁为0.5%~1.1%,均小于2%。
3.2.4 残留溶剂
对80批次样品中残留的丙酮和异亚丙基丙酮进行了测定。丙酮的残留量为0.02%~0.3%,均未超过《中国药典》2020年版对残留丙酮的限度(0.5%);异亚丙基丙酮的残留量为0.0002%~0.1%,均未超过EP西司他丁钠规定的限度(0.4%)。结果同时显示,丙酮的残留量与异亚丙基丙酮的残留量具有强相关性。当丙酮的含量控制在较低水平,如0.1%以下时,异亚丙基丙酮含量显著降低。
参考文献[6]显示,西司他丁钠合成的最后一步反应为:西司他丁酯在甲醇溶液中经强碱氢氧化钠的作用成盐,然后加入盐酸中和,经丙酮结晶,洗涤、干燥。丙酮在碱性条件下会缩合成二丙酮醇,二丙酮醇在酸性条件下缩水得异亚丙基丙酮。异亚丙基丙酮为具有遗传毒性的致癌警示结构。按照毒理学关注阈值(TTC)计算,其在本品中的控制限度为30 ppm(0.0003%),在EP西司他丁钠原料标准中该杂质作为杂质D进行控制。
3.2.5 溶液的颜色
采用色差计法比较加速稳定性试验中样品溶液色差值的变化。结果显示,样品经加速试验后,溶液的颜色均有所加深;C公司产品加速10 d后,颜色超过了黄色1号或黄绿色2号标准比色液。将加速实验中样品溶液的变化与原料进行关联,发现原料同为J公司的C公司和D公司制剂,采用充氮工艺的产品颜色变化率明显低于未采用充氮工艺的产品;原料同为L公司的G公司和H公司的制剂,亦表现出相同规律(图6)。提示溶液的变化与样品的氧化有关,采用充氮工艺以减少有色杂质的产生。
4 结论
国家药品抽检结果显示,国内上市的注射亚胺培南西司他丁钠总体质量较好,但原研药的质量各方面均优于仿制药。因而在开展仿制药一致性评价时,应特别亚胺培南的晶癖、有关物质、含量、充氮工艺、异亚丙基丙酮等关键点。
目前本品的国内标准均为各企业的注册标准,质量标准差异较大,其中在有关物质检测方法和杂质控制方面差异较大;同时,缺乏对产品复溶时间的控制,含量测定方法的耐用性差,并缺少对两主成分比例的控制。建议对本品的标准进行统一提高。
参 考 文 献
盖荣银, 赵同新, 姚劲挺, 等. 注射用粉末剂型仿制药一致性评价关键技术要点解析[J]. 中国医药工业杂志, 2019, 50(2): 226-228.
George B S, George C D, Alan W D. Stability and kinetics of degradation of lmipenem in aqueous solution[J]. J Pharm sci-us, 1990, 79(8): 732-740.
彭洁, 洪建文, 陈冬妮. 高效液相色谱法测定亚胺培南的有关物质[J]. 今日藥学, 2013, 23(11): 733-735.
李承明, 郭珩, 杨丽娜, 等. 西司他丁钠有关物质的合成[J]. 中国医药工业杂志, 2021, 52(6): 786-789.
陆静, 李悦, 王慧敏, 等. LC-MS法研究西司他丁钠中的有关物质[J]. 中国医药工业杂志, 2012, 43(11): 938-942.
欧阳罗, 陈瑞业, 柏一慧, 等. 西司他丁钠的合成[J]. 浙江师范大学学报(自然科学版), 2011, 34(3): 317-322.
吴小红, 王明娟, 胡昌勤. 效液相色谱法测定注射用亚胺培南/西司他丁钠含量及含量均匀度[J]. 中国抗生素杂志, 2005, 20(10): 591-593.
阚家义, 许威. 注射用亚胺培南/西司他汀钠含量和有关物质测定方法的改进[J]. 药物分析杂志, 2006, 26(3): 390-392.

