头孢唑林及其杂质诱导的斑马鱼胃肠道毒性反应比较分析
张苗青?张靖溥?胡昌勤
摘要:目的 本研究利用藥源性斑马鱼胃肠道毒性反应模型,比较分析头孢唑林及其杂质F和杂质A诱导的胃肠道毒性反应及其机制。方法 荧光显微镜下活体观测头孢唑林、杂质F和杂质A对斑马鱼幼鱼胃肠道排空过程的影响,评价其毒性反应,比较分析3种化合物结构与毒性关系;利用RNA-seq技术分析3种化合物胃肠道毒性反应机制的差异;利用分子对接模拟分析3种化合物与胆汁盐外排蛋白(BSEP)蛋白结合亲和力。结果 杂质F胃肠排空能力明显大于头孢唑林,杂质A的胃肠排空能力明显小于头孢唑林,MMTD结构是头孢唑林导致胃肠道毒性反应的主要毒性功能基团;RNA-seq分析发现杂质F处理组分别与头孢唑林和杂质A处理组相比较具有45个共同呈显著差异的基因,主要显著富集在矿物质吸收通路和胆汁分泌通路中,其中abcb11b基因的表达与胃肠道毒性反应呈明显相关;分子对接结果显示杂质F与斑马鱼BSEP的亲和力高于头孢唑林,头孢唑林的结合亲和力高于杂质A。结论 临床中头孢唑林钠的胃肠毒性反应可能与产品中杂质F有关,通过药物和杂质与BSEP蛋白结合的亲和力可以评估头孢唑林杂质引起的胃肠道毒性反应的差异,可为头孢唑林钠的生产工艺评估和质量控制提供理论依据。
关键词:头孢唑林;杂质;斑马鱼;胃肠道毒性
中图分类号:R978.1文献标志码:A
Comparative analysis of gastrointestinal toxicity induced by cefazolin and its impurities in zebrafish
Abstract Objective This study employed a zebrafish model to comprehensively assess and compare the gastrointestinal toxicity induced by cefazolin, impurity F, and impurity A, shedding light on the underlying mechanisms. Methods Real-time observation of zebrafish larvaes gastrointestinal emptying under a fluorescence microscope allowed the evaluation of toxicity responses to cefazolin, impurity F, and impurity A. Structural relationships among the three compounds were analyzed. Genome expression patterns associated with gastrointestinal toxicity reactions were elucidated by means of RNA-seq technology. Molecular docking assessed the binding affinity between the compounds and the bile salt export pump (BSEP) protein. Results Impurity F exhibited significantly higher gastrointestinal emptying capacity compared to cefazolin, while impurity A demonstrated notably lower emptying capacity than cefazolin. The MMTD structure emerged as the primary toxic functional group responsible for cefazolin-induced gastrointestinal toxicity. RNA-seq analysis unveiled 45 significantly differentially expressed genes shared between the impurity F group and the cefazolin and impurity A groups. These genes were predominantly enriched in the mineral absorption and bile secretion pathways, with the expression of the abcb11b gene closely linked to gastrointestinal toxicity reactions. Molecular docking results indicated that impurity F had a stronger affinity for zebrafish BSEP than cefazolin, while cefazolin exhibited a higher binding affinity compared to impurity A. Conclusion Clinical gastrointestinal toxicity reactions attributed to cefazolin sodium may be associated with impurity F in the product. The assessment of the binding affinity of the drug and the impurities to the BSEP protein offered insights into variations in gastrointestinal toxicity reactions caused by the impurities in cefazolin sodium. This study provided a theoretical foundation for evaluating the production process and quality control of cefazolin sodium.
Key words Cefazolin; Impurities; Zebrafish; Gastrointestinal toxicity
头孢唑林(cefazolin)为第一代头孢菌素,用于治疗多种细菌感染,包括但不限于上呼吸道感染(如鼻窦炎、扁桃体炎、喉炎)、下呼吸道感染(如支气管炎和肺炎)、皮肤和软组织感染等[1]。头孢唑林在体内几乎不代谢,主要通过尿和胆汁排泄。随着其在临床中的广泛应用,不断有头孢唑林引起的药物不良反应包括过敏反应、肾损伤、胃肠道反应、心律失常等的报道[2]。其中,胃肠道反应主要包括腹痛、腹泻、恶心呕吐、食欲不振等症状。这些反应可通过有效的干预措施得以缓解和消失[3]。然而,头孢唑林药品导致胃肠道反应的主要因素及作用机制目前尚未明确。
药品杂质是引起药品安全问题的重要原因之一[4]。头孢菌素类药物在储存过程中易发生降解。药品中杂质含量的增加,可能影响药物的疗效,降低药物的安全性。由于药物杂质通常与原料药(active pharmaceutical ingredient,API)具有相似的结构,但含量较低,因而不易分离,难以直接对其进行安全性评价。建立灵敏的药物杂质毒性评价模型对药品质量控制尤为重要。
斑马鱼作为一种模式动物,具有遗传水平与人类相似、高繁殖力以及可视化的发育过程等优势,已广泛用于建立各类药品安全性评价模型[5]。尽管斑马鱼没有胃,但其肠道在基因表达、解剖结构、细胞结构以及对化学物质的反应方面与哺乳动物小肠相似[6]。斑马鱼肠道可分为肠球区、中肠区和远肠区[7]。受精3 d(3 day post fertilization, 3 dpf)后的斑马鱼肠道可发生自发性的不稳定收缩,受精5 d(5 dpf)后可发生自动蠕动,增强斑马鱼的摄食能力[8]。斑马鱼在进食、消化、吸收和排泄过程中的肠道蠕动行为与人类相似,已成功地用于机体胃肠道生理学的研究[9-11]。本课题组已利用斑马鱼模型对阿奇霉素导致的胃肠道不良反应机理进行了研究,发现阿奇霉素杂质J是引起胃肠道毒性反应的主要杂质[12]。
本研究利用建立的药源性斑马鱼胃肠道毒性模型,深入探讨头孢唑林诱导胃肠道毒性的作用机制,评价头孢唑林杂质的胃肠道毒性反应,以便为头孢唑林杂质的质量控制提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
斑马鱼采用野生型AB系;饲养液电导率为500~550 μS/cm,饲养温度为28 ℃,光照条件为14 h光照/10 h黑暗。雌雄成魚按照1:1配对/交配盒,产卵后,随机挑选正常受精卵在斑马鱼饲养液中培养,发育至受精后5 d(5 dpf)供后续实验使用。本研究的实验程序符合中国医学科学院医药生物技术研究所的动物实验伦理规则,并已获得所实验动物管理委员会的准许。
1.1.2 试剂
头孢唑林、杂质F和杂质A对照品来自中国食品药品检定研究院;Neil red染色试剂购自Sigma-Aldrich公司;TRIzol试剂购自Thermo Fisher公司;PrimeScript RT Master Mix购自Takara公司。
1.2 方法
1.2.1 对斑马鱼幼鱼胃肠排空过程的观察
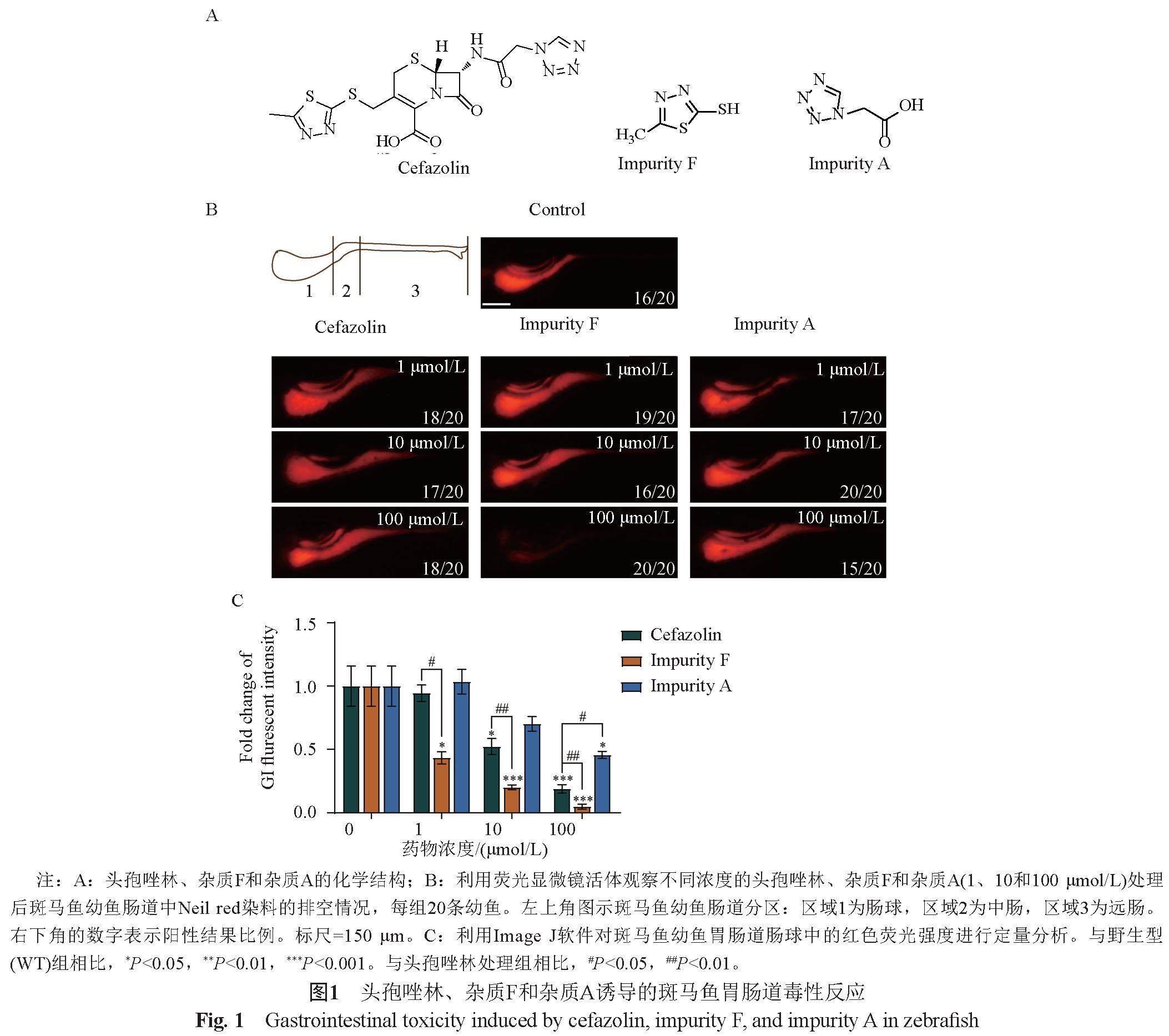
参照文献[12]方法。随机挑选发育正常的5 dpf仔鱼,每组各20条;首先在饲养液中分别给予10 μg/L的荧光示踪剂Neil red染料,于黑暗中喂养16 h后,转移至光照条件。给药组分别置于含不同浓度的头孢唑林、杂质F或杂质A(1、10和100 μmol/L)的饲养液中,6 h后,在体式荧光显微镜下观察荧光示踪剂(红色染料)在斑马鱼幼鱼胃肠中的排空变化;以不给药的野生型组为对照,拍照记录;利用Image J软件测量幼鱼肠球处荧光示踪剂的红色荧光强度。
1.2.2 RNA-seq分析
取6 dpf野生型斑马鱼幼鱼,置于分别含有100 μmol/L的头孢唑林、杂质F或杂质A的饲养液中,给药6 h后收集各组斑马鱼幼鱼。总RNA提取、样品质量检测、RNA-seq测序和分析均由上海美吉生物有限公司完成。所有生物信息学数据均在美吉生物云平台上分析。差异基因(DEGs)显著性差异定义为Fold change≥2。KEGG pathway富集分析的显著性阈值为P<0.05。
1.2.3 实时定量PCR(qRT-PCR)分析
取6 dpf野生型斑马鱼仔鱼,分别给药不同浓度的头孢唑林、杂质F或杂质A(1、10和100 μmol/L),6 h后,收集各组斑马鱼幼鱼。TRIzol法提取总RNA;利用PrimeScript RT Master Mix反转录成cDNA,以cDNA为模板,使用LightCycler480 system(Roche)进行qRT-PCR,实验中选择β-actin为内对照,野生型斑马鱼组为外对照,mRNA的相对表达量采用2-△△Ct方法计算。qRT-PCR所需的引物序列如下:abcb11b(F: GGTGTGGCTGTTATCATCTCC, R: GTCCTGCTTGGCGAATCC);β-actin(F: CCGTGACATCAAGGAGAAG; R: ATACCGCAAGATTC CATACC)。
1.2.4 统计学分析
利用GraphPad 8.0软件进行统计分析,所有数据以3个独立实验的平均值±标准偏差(SD)表示。两组间的比较采用t检验,P<0.05被认为具有显著性。
2 结果
2.1 头孢唑林及其杂质F和杂质A对斑马鱼幼鱼胃肠道排空过程的影响
利用建立的药源性斑马鱼胃肠道毒性反应模型,观测头孢唑林、杂质F(MMTD)和杂质(TAA)(图1A)对斑马鱼幼鱼胃肠道排空过程的影响,评价其毒性反应。与未处理组相比较,在荧光显微镜下可见,随着给药浓度的增加,头孢唑林、杂质F和杂质A均导致红色染料由肠球向中肠和远肠区转移;在100 μmol/L浓度下,杂质F组中的红色荧光几乎消失(图1B)。测量肠球区的红色荧光强度,这3种化合物导致肠球区红色荧光的减弱与给药浓度呈明显相关(图1C);当给药浓度为1 μmol/L时,杂质F处理组与头孢唑林处理组相比荧光强度显著降低,而杂质A处理组的荧光强度与对照组相比没有显著差异;当给药浓度为10 μmol/L时,杂质F处理组与头孢唑林处理组相比的荧光强度均再同步降低,而杂质A处理组的荧光强度与对照组相比仍未显示显著差异;当给药浓度为100 μmol/L时,杂质F处理组与头孢唑林处理组的荧光强度均进一步降低,杂质A处理组与对照组相比荧光强度才显示出显著降低。上述结果表明,在相同处理浓度下,杂质F的胃肠排空能力明显大于头孢唑林,杂质A的胃肠排空能力明显小于头孢唑林。即头孢唑林、杂质F和杂质A诱导的斑马鱼胃肠毒性依次为:杂质F>头孢唑林>杂质A。
2.2 RNA-seq分析
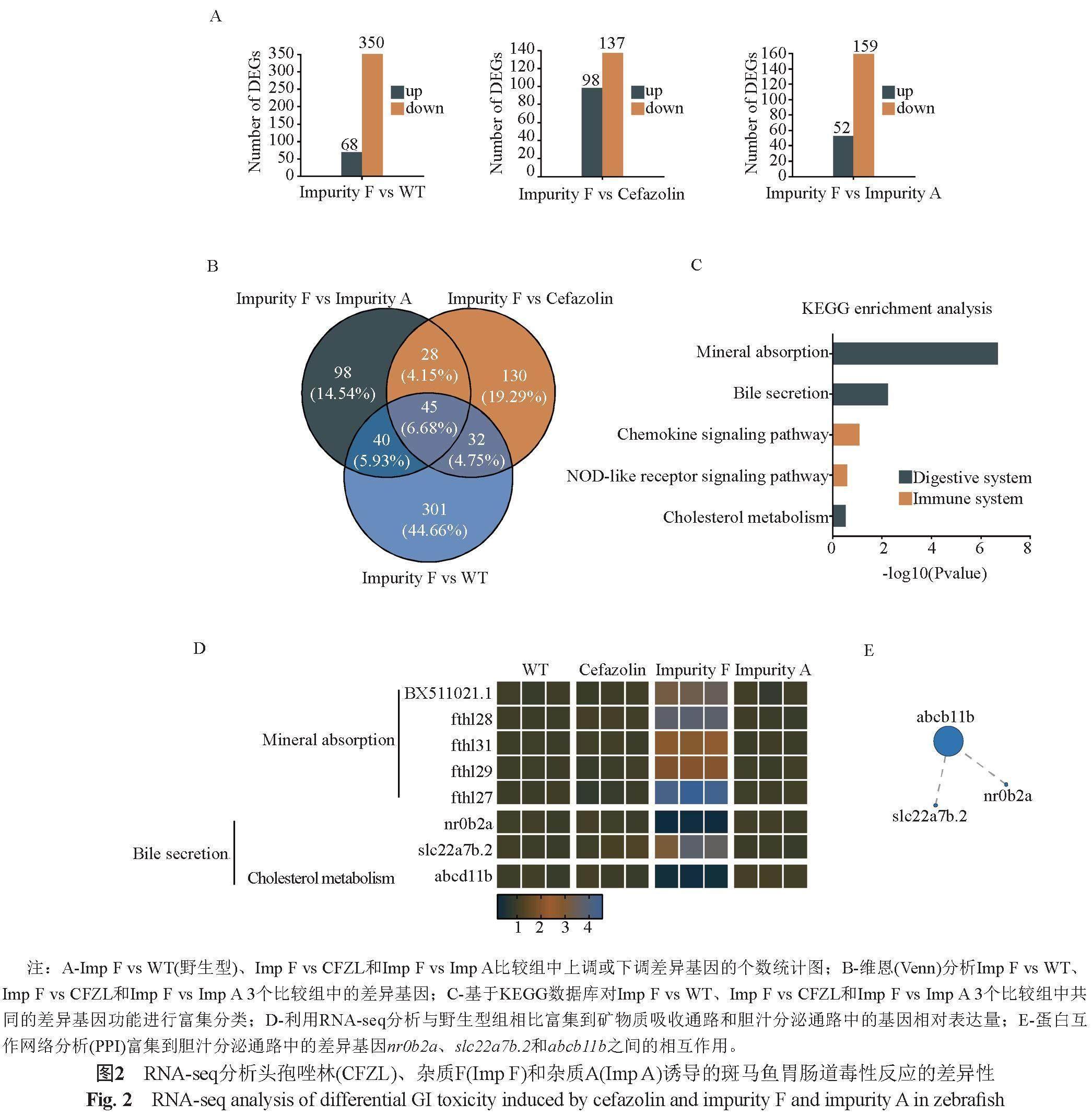
利用RNA-seq技术通过转录组学分析深入研究头孢唑林及其杂质导致的胃肠道毒性反应机制,以及上述3种化合物胃肠道毒性反应机制的差异。与野生型组相比,杂质F处理组共有418个呈显著差异的表达基因(DEGs),其中上调基因68个,下调基因350个;与头孢唑林处理组相比,杂质F处理组共有235个呈显著差异的表达基因,其中上调基因98个,下调基因137个;与杂质A处理组相比,杂质F处理组共有211个呈显著差异的表达基因,其中上调基因52个,下调基因159个(图2A)。对上述3组呈显著差异的表达基因进行维恩(Venn)分析,找到了45个共同呈显著差异的基因(图2B)。将这45个共同呈显著差异的基因进行KEGG pathway功能富集分析,发现它们主要富集在消化系统相关的通路(digestive system)和与免疫系统相关的通路(immune system)中;其中,与消化系统相关通路中的矿物质吸收(mineral absorption)通路和胆汁分泌(bile secretion)通路存在显著富集情况(P<0.05)(图2C)。矿物质吸收通路异常通常涉及肠道吸收问题,如脂肪吸收不良、乳糖不耐受等,吸收不良综合症通常影响了胃肠道的正常排空和吸收能力[13]。胆汁分泌通路异常可能会影响胆汁的质量和数量,对脂肪的消化和吸收产生不利影响,表现为脂肪大量排出,脂溶性维生素吸收不良,以及腹泻等胃肠道反应[14]。富集到矿物质吸收通路的差异基因有BX511021.1、fthl28、fthl31、fthl29和fthl27,富集到胆汁分泌通路的差异基因有nr0b2a、slc22a7b.2和abcb11b;与野生型相比,这些基因的表达只有杂质F处理组显示出显著差异,头孢唑林和杂质A处理组则表现为没有显著差异(图2D)。上述结果提示,杂质F较头孢唑林和杂质A具有更强的胃肠道毒性反应可能与这些差异基因的表达有关。将这些基因进行蛋白互作网络分析(PPI),发现只有富集到胆汁分泌通路的nr0b2a、slc22a7b.2和abcb11b具有蛋白互作关系,其中abcb11b在该网络中具有较高的节点度(图2E)。提示abcb11b在杂质F导致的胃肠道毒性反应中可能具有重要作用。
2.3 分子对接
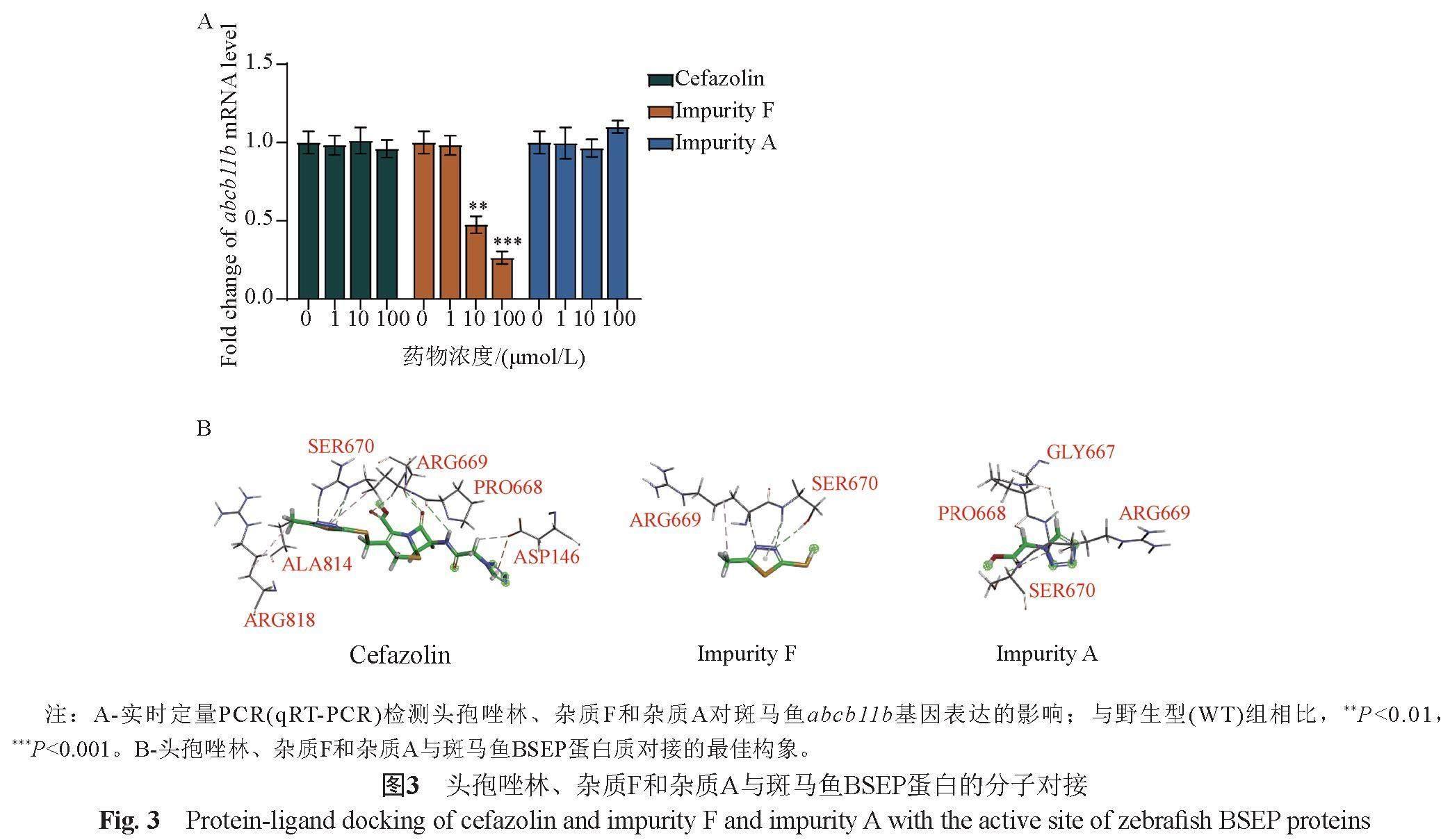
结构-毒性关系(structure-toxicity relationships)已被用于计算机预测药物毒性。近年来的研究表明,结构-毒性关系与分子对接(基于结构的计算)联合应用可用于预测药物杂质的毒性。上述PPI分析结果表明,与abcb11b的相互作用可能与药物诱导的胃肠道毒性有关。采用qRT-PCR验证头孢唑林、杂质F和杂质A对斑马鱼体内abcb11b基因表达水平的影响,结果表明,杂质F能浓度依赖地显著降低abcb11b基因的表达水平,而头孢唑林和杂质A对abcb11b基因的表达无影响(图3A)。abcb11b基因编码胆汁盐外排蛋白(bile salt export pump,BSEP),这是一种细胞膜转运蛋白,主要在肝细胞的胆小管上表达。其主要功能是维持正常的胆汁酸循环和胆汁的排泄[15]。斑马鱼的BSEP和人类BSEP的氨基酸序列同源性高达70.9%。以头孢唑林、杂质F和杂质A作为配體,分别与斑马鱼BSEP的活性位点进行对接,其最佳对接构象如图3B所示。采用-CDOCKER相互作用能量值(-CDOCKER interaction energy scores)表征配体与蛋白质结合的亲和力[16],上述3种化合物的最高-CDOCKER相互作用能量值得分依次为杂质F>头孢唑林>杂质A(表1)。杂质F与斑马鱼BSEP的亲和力高于头孢唑林,头孢唑林的结合亲和力高于杂质A,与体内实验结果一致。上述结果提示,药物与BSEP蛋白结合的亲和力可能表征其导致的胃肠道毒性反应,利用药物与BSEP蛋白分子的对接模拟分析,可以快速评估头孢唑林杂质导致的胃肠道毒性反应。然而,BSEP是否是头孢唑林及其杂质诱导胃肠道毒性的真正靶标还需进一步研究。
3 讨论
分子中直接导致机体毒性反应的化学基团被称为毒性功能基因[17];头孢菌素的3位和7位侧链被认为是不同的毒性功能基团,可导致机体发生不同毒性反应[18]。前期的研究证明,头孢唑林分子3位侧链的MMTD结构是导致斑马鱼胚胎畸形的主要毒性功能基团,亦是引起药物心脏毒性的主要毒性功能基团之一[19];本文利用药源性斑马鱼胃肠道毒性反应模型比较头孢唑林与杂质F(C-3位侧链的结构单元)、杂质A(C-7位侧链的结构单元)的胃肠道毒性反应,杂质F(MMTD)的胃肠道毒性反应明显大于头孢唑林(图1),证明MMTD结构亦是导致头孢唑林胃肠道反应的主要毒性功能基团。头孢唑林中的已知杂质按其结构可分为3类:第一类杂质包括杂质A(头孢唑林的7侧链TAA)、杂质G(头孢唑林的母核7-ACA)和杂质F(头孢唑林的3侧链MMTD),为头孢唑林分子结构的基本单元;第二类杂质的7侧链均为TAA结构,但3侧链与头孢唑林不同;第三类杂质的3侧链为MMTD结构,但7侧链的结构或构型与头孢唑林不同[19]。本文的结果表明,含有MMTD结构的第三类杂质亦是导致头孢唑林胃肠道反应的毒性杂质。
目前国内上市的注射用头孢唑林钠分别由冷冻干燥工艺和溶媒结晶工艺生产,前者常称为普通头孢唑林钠,后者称为五水头孢唑林钠。2020年国家评价性抽验数据显示,冷冻干燥工艺产品中的杂质含量明显高于溶媒结晶工艺的产品;在冷冻干燥工艺产品中,杂质F的含量约为0.4(SD=0.18),总杂质的含量约为2.1(SD=0.75);在溶媒结晶工艺产品中,杂质F的含量约为0.1(SD=0.06);总杂质的含量约为1.2(SD=0.39)(未发表资料);对2010—2018年国家药品不良反应数据库中注射用头孢唑林钠的不良反应监测数据进行统计分析(表2)。可见,不同工艺产品的不良反应差异主要表现为胃肠道反应的不同;冻干工艺产品的胃肠道反应是溶媒结晶工艺产品的2倍。提示不同企业生产的注射用头孢唑林钠不良反应的差异可能与其所含有的杂质,特别是与杂质F的含量不同有关。
化合物與BSEP蛋白结合的亲和力可能表征其引起的胃肠道毒性反应的差异(表1);利用药物与BSEP蛋白分子的对接模拟分析,可以快速评估头孢唑林杂质导致的胃肠道毒性反应(图3)。采用该方法对含有MMTD结构的第三类头孢唑林杂质进行评估,比较其与头孢唑林和杂质F亲和力的差异,可以评估它们导致胃肠道毒性反应的能力。
4 结论
利用药源性斑马鱼胃肠道毒性反应模型,通过比较头孢唑林、杂质F(3位侧链结构单元MMTD)和杂质A(3位侧链结构单元TAA)的胃肠道毒性反应,证明MMTD结构是头孢唑林导致的胃肠道毒性反应的主要毒性功能基团,但杂质F的胃肠道毒性远强于头孢唑林,临床中头孢唑林钠的胃肠道毒性反应差异可能与产品中杂质F的含量有关。杂质F可以来源于合成中残留的前体,也可以通过降解反应产生,与生产工艺关系密切,是头孢唑林中的主要杂质之一。上述研究为头孢唑林钠的生产工艺评估和质量控制提供了理论依据。
对头孢唑林胃肠道毒性反应机理的研究表明,杂质F下调abcb11b基因的表达与胃肠道毒性反应呈明显相关。abcb11b基因编码胆汁盐外排蛋白(Bile Salt Export Pump,BSEP),利用分子对接技术,通过药物与BSEP蛋白结合的亲和力可以评估其引起的胃肠道毒性反应的差异。利用该策略对含有MMTD结构的头孢唑林杂质等进行评估,可以快速评估他们的胃肠道毒性反应能力。
参 考 文 献
Quintiliani R, Nightingale C H. Cefazolin[J]. Ann Intern Med, 1978, 89(5): 650-656.
林文强. 头孢唑林注射剂至不良反应377例文献分析[J]. 中国药房, 2015, 26(6): 743-744.
何解生. 头孢唑林钠152例不良反应文献分析[J]. 药学实践杂志, 2004, 22(1): 51-53.
Alsante K M, Huynh-Ba K C, Baertschi S W, et al. Recent trends in product development and regulatory issues on impurities in active pharmaceutical ingredient (API) and drug products. Part 2: Safety considerations of impurities in pharmaceutical products and surveying the impurity landscape[J]. AAPS Pharm Sci Tech, 2014, 15(1): 237-251.
Bambino K, Chu J. Zebrafish in toxicology and environmental health[J]. Curr Top Dev Biol, 2017, 124: 331-367.
Kothekar A T, Kulkarni A P. Gastrointestinal tract: A neglected guardian angel?[J]. Indian J Crit Care Med, 2020, 24(4): 146-151.
Field H A, Kelley K A, Martell L, et al. Analysis of gastrointestinal physiology using a novel intestinal transit assay in zebrafish[J]. Neurogastroenterol Motil, 2009, 21(3): 304-312.
Rich A. A new high-content model system for studies of gastrointestinal transit: The zebrafish[J]. Neurogastroenterol Motil, 2009, 21(3): 225-228.
Martyniuk C J, Buerger A N, Vespalcova H, et al. Sex-dependent host-microbiome dynamics in zebrafish: Implications for toxicology and gastrointestinal physiology[J]. Comp Biochem Physiol Part D Genomics Proteomics, 2022, 42: 100993-100999.
He X, Yang J, Qiu L, et al. Thiodiketopiperazines produced by penicillium crustosum and their activities to promote gastrointestinal motility[J]. Molecules, 2019, 24(2): 1-4.
Kikuchi K, Noh H, Numayama-Tsuruta K, et al. Mechanical roles of anterograde and retrograde intestinal peristalses after feeding in a larval fish (Danio rerio)[J]. Am J Physiol Gastrointest Liver Physiol, 2020, 318(6): 1013-1021.
Zhang M Q, Wu G Z, Zhang J P, et al. The comparative analysis of gastrointestinal toxicity of azithromycin and 3'-decladinosyl azithromycin on zebrafish larvae[J]. Toxicol Appl Pharmacol, 2023, 469: 116529-116534.
Powell J J, Jugdaohsingh R, Thompson R P. The regulation of mineral absorption in the gastrointestinal tract[J]. Proc Nutr Soc, 1999, 58(1): 147-153.
Ridlon J M, Wolf P G, Gaskins H R. Taurocholic acid metabolism by gut microbes and colon cancer[J]. Gut Microbes, 2016, 7(3): 201-215.
Meier P J, Stieger B. Bile salt transporters[J]. Annu Rev Physiol, 2002, 64: 635-661.
Rampogu S, Rampogu-Lemuel M. Network based approach in the establishment of the relationship between type 2 diabetes mellitus and its complications at the molecular level coupled with molecular docking mechanism[J]. Biomed Res Int, 2016, 2016: 6068437-6068441.
Zhang J, Meng J, Li Y, et al. Investigation of the toxic functional group of cephalosporins by zebrafish embryo toxicity test[J]. Arch Pharm (Weinheim), 2010, 343(10): 553-560.
Zhang J, Qian J, Tong J, et al. Toxic effects of cephalosporins with specific functional groups as indicated by zebrafish embryo toxicity testing[J]. Chem Res Toxicol, 2013, 26(8): 1168-1181.
Chen B, Gao Z Q, Liu Y, et al. Embryo and developmental toxicity of cefazolin sodium impurities in zebrafish[J]. Front Pharmacol, 2017, 8: 403-409.

