实验性大鼠脑出血脑内Bax、Bcl2表达的实验研究
魏秀娥 荣良群
徐州医学院第二附属医院神经内科 徐州 221006
Qureshi等许多研究均证实[1-3],细胞凋亡机制参与了脑出血的继发性损伤,是脑出血后血肿周围区细胞死亡的主要方式,Bcl-2基因家族在调节细胞凋亡中发挥重要作用。Bcl-2是重要的凋亡抑制基因,Bax是Bcl-2基因家族中重要的凋亡促进基因,其基因产物Bcl-2、Bax是重要的凋亡调控蛋白,Bax可通过其自身形成的Bax同二聚体和(或)与Bcl-2形成Bax-Bcl-2异二聚体而发挥作用。Bax同二聚体促进细胞凋亡,Bax-Bcl-2异二聚体则抑制细胞凋亡。Bax、Bcl-2是否在脑出血中表达及其特点,国内外报道不一,因此,本实验拟利用自体血注入法建立大鼠ICH模型,对ICH凋亡相关蛋白Bax、Bcl-2表达规律进行研究,以期在有效的时间窗内争取通过上调抗凋亡蛋白Bcl-2和下调促凋亡蛋白Bax的表达,调控细胞凋亡,为临床治疗脑出血提供新思路。
1 材料和方法
1.1 材料
1.1.1 实验动物:SD大鼠84只,清洁级,成年雄性,体质量220~250g,由徐州医学院实验动物中心提供。
1.1.2 主要试剂:Bax Bcl-2 抗体(Santa Cruz Biotechnology,USA),二步法免疫组化检测试剂(北京中山生物科技有限公司品),DAB显色试剂盒(北京中山生物科技有限公司产品)。
1.1.3 主要仪器:动物立体定位仪(江湾二型),100μL微量进样器(浙江省医用器械厂),KD1508转轮式切片机(浙江金华科迪仪器设备有限公司),OLYMPUS光学显微镜(日本),远红外快速恒温干燥箱(上海跃进医疗器械厂),电子分析天平(HR2140美国,精密度0.0001g)。
1.2 方法
1.2.1 动物模型的制备:参照Yang等[5]报道的方法改进,根据大鼠脑立体定位图谱[4]确定尾状核的位置:前囟前0.2 mm,矢状缝向右3.0mm,深6.3mm为注射点。大鼠经10%水合氯醛(350mg/kg)腹腔麻醉俯卧位固定于立体定位仪上,头皮正中消毒后矢状位切开约1.5cm,暴露前囟点,据图谱调整立体定位仪于注射点(A 0.2mm L 3.0mm V 6.3 mm),钻颅打孔(直径约1mm)将鼠尾置于40℃水温浴10 min后取出擦干消毒,距离鼠尾末端3cm处剪断,用100μL微量进样器吸取新鲜血液约50μL,迅速插入已钻好孔内,进针6.3mm(相当于尾状核位置),注射时间不少于15min,留针10min缓慢退针,局部碘伏消毒后,缝合切口皮肤。大鼠清醒后无偏瘫体征(Longa评分)者弃用。
1.2.2 实验分组及动物给药:正常组(Nor组):不做任何处理,12只。生理盐水组(NS组):注入生理盐水50μL,36只。出血组(ICH组):立体定位后注入新鲜未凝血50μL,造模成功后3h原位固定后注入生理盐水5μL,共36只。以上各组分别在6h、12h、24h、48h、72h、7d随机处死大鼠各6只,用于免疫组化染色。
1.2.3 大鼠脑灌注固定及免疫组化染色:造模成功后大鼠分别于各时相点经10%水合氯醛深度麻醉后,经升主动脉快速灌注37℃生理盐水100mL,然后以250mL固定液(4℃0.01MPB PH 7.4 4%多聚甲醛)灌注固定脑组织,30min内灌完,取全脑,去除小脑和脑干,置于上述固定液中后固定24 h,继入20%、30%蔗糖液(4℃0.01MPB PH 7.4),直至组织块沉底。将固定脑组织放在恒冷切片机上切取30μm厚的连续冠状切片,于尾侧向头侧随机隔6片取一组邻片,置于PBS中,进行免疫组化染色。Bax、Bcl-2均采用漂染法,以PBS代替一抗做阴性对照。
1.2.4 计数方法:免疫组化所有结果在10、20、40倍目镜下观察,采用40倍目镜计数每张脑片4个视野,一只大鼠测两张脑片,获得8个数值取其均数为一只大鼠的最终结果。
2 结果
2.1 免疫组化结果
2.1.1 bcl-2表达:阳性细胞染色均以胞浆有棕黄色物质沉积为主,多见于血肿周围基底节区,并可显示细胞轮廓;Nor组未见阳性细胞表达;NS组偶有表达,但各时相点差异无统计学意义(P>0.05);各组各时相点计数结果见表1。
表1 各组各时相点血肿周围bcl-2阳性细胞数 (个,)/高倍镜视野
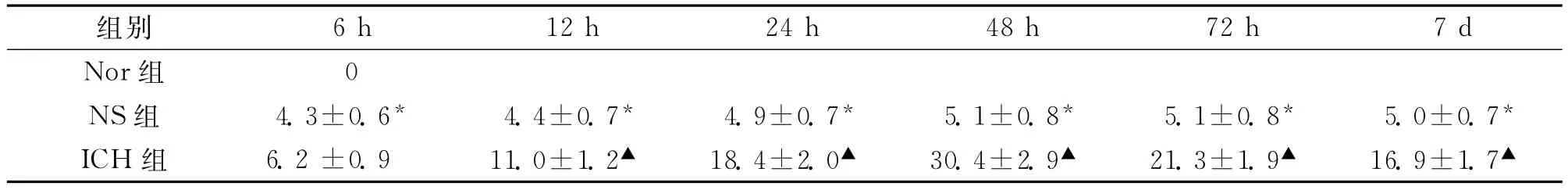
表1 各组各时相点血肿周围bcl-2阳性细胞数 (个,)/高倍镜视野
注:NS组各时相点均见少量阳性细胞表达,组内比较,*P>0.05;出血组同时相点与NS组比较,▲P<0.01
6h 12h 24h 48h 72h 7d Nor组组别0 NS组 4.3±0.6* 4.4±0.7* 4.9±0.7* 5.1±0.8* 5.1±0.8* 5.0±0.7*ICH组 6.2±0.9 11.0±1.2▲ 18.4±2.0▲ 30.4±2.9▲ 21.3±1.9▲ 16.9±1.7▲
2.1.2 bax表达:大鼠脑组织bax阳性细胞在出血组织及血肿周围均有表达,细胞染色形式以胞浆有棕黄色物质沉积为主,并可显示出细胞轮廓,血肿组织中的阳性神经元形态变化较大,胞体形态多不规则。NS组未见bax阳性表达,而ICH组6h出现表达,12h表达明显增加,1d达峰值,3d时阳性细胞明显减少,7d时仍持续存在,计数结果见表2。
表2 各组各时相点血肿周围bax阳性细胞数 (个,)/高倍镜视野
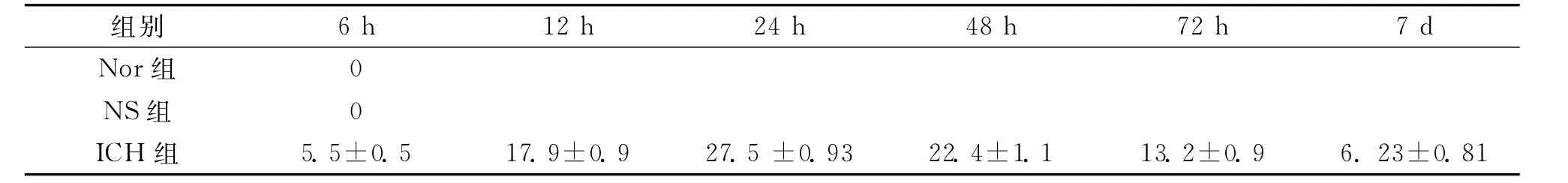
表2 各组各时相点血肿周围bax阳性细胞数 (个,)/高倍镜视野
Nor组0 NS组 0 ICH 组 5.5±0.5 17.9±0.9 27.5±0.93 22.4±1.1 13.2±0.9 6.23±0.81
3 讨论
既往研究表明,脑出血后脑损伤不仅是血肿的占位效应和血肿对周围脑组织的直接破坏所致,脑出血后rCBF下降、灶周再灌注损伤、脑水肿形成、炎症反应、细胞凋亡等均参与了脑出血继发性损伤,近年来研究表明,作为一种基因调控的细胞死亡方式,细胞凋亡参与了脑出血后神经细胞损伤过程[6],具体机制尚不清晰,分子生物学研究发现:细胞凋亡是机体在生长、发育和受到外来刺激时清除多余、衰老和受损伤的细胞以保持机体内环境平衡的一种自我调节机制。bcl-2基因家族包含抑制和促进细胞凋亡两类功能相反的蛋白质,在细胞凋亡中发挥重要的调节作用[7]。其中Bcl-2是重要的凋亡抑制基因,具有促进细胞生存的作用,位于凋亡基因网络的关键部位,阻止促凋亡信号的传递或其产物发挥作用;而bax是bcl-2基因家族中重要的凋亡促进基因作用于细胞凋亡的晚期环节。正常情况下,Bax、Bcl-2在细胞中的表达处于一个动态平衡中,并受到机体的严格调控[8]。Bcl-2、Bax蛋白是重要的凋亡调控蛋白,Bax可通过其自身形成的Bax同二聚体和(或)与Bcl-2形成Bax-Bcl-2异二聚体而发挥作用。Bax同二聚体促进细胞凋亡,Bax-Bcl-2异二聚体则抑制细胞凋亡。既往研究认为脑出血后早期凋亡相关蛋白以NF-κB等促凋亡蛋白增高为主,是临床症状加重的可能因素,当凋亡抑制蛋白HSP70等表达增强时症状趋于稳定[9]。本实验中Nor组与NS组右侧基底节区均未见Bax阳性细胞表达,ICH组特别是出血中心区损伤最重,神经元变性较重,可见坏死、炎症细胞浸润,亦未见Bax、Bcl-2表达。而血肿周围区Bax在出血后6h即出现表达,24h达到高峰,NS组即可见Bcl-2少量表达,ICH组Bcl-2在12h表达明显,48h达高峰,术后7d二者阳性表达仍持续存在。通过对脑出血大鼠血肿周围Bax、Bcl-2蛋白动态监测,进一步证实了在脑出血的发生和演变中的确出现了Bax、Bcl-2蛋白表达的动态失衡。Bax促凋亡作用的机制可能[10]与Bax蛋白在线粒体膜上形成同源二聚体,产生离子通道,造成细胞内钙超载,激活一系列酶,促使细胞发生凋亡;而Bcl-2在脑出血损伤过程中的作用机制与其具有抗氧化剂作用,可通过抑制超氧化物的产生和作用,从而抑制细胞凋亡,同时Bcl-2还可能通过抑制Ca2+的释放[11],阻止促凋亡基因信号的传递,或阻止这些诱导基因产物如Bax、P53等[12]而发挥抗细胞凋亡作用。出血24h后Bax蛋白表达达高峰,Bax-Bax同二聚体形成增加,促进出血早期细胞凋亡的发生,之后Bax表达渐减少,且凋亡抑制蛋白Bcl-2表达渐增加,48h后达高峰,Bax-Bcl-2异二聚体形成增加,抑制了细胞凋亡的发生,使Bax/Bcl-2在分子水平达到新的动态平衡,结果表明,凋亡相关蛋白bax、bcl-2参与了出血后脑损伤,为临床开发治疗脑出血的药物提供新的思路。
[1]Qureshi AI,Suri MF,Ostrow PT,et al.Apoptosis as a form of cell death in intracerebral hemorrhage[J].Neurosurgery,2003,52:1 041-1 047.
[2]Donovan FM,Pike CJ,Cotman CW,et al.Thrombin induces apoptosis in cultured neurons and astrocytes via a pathway requiring tyrosine kinase and RhoA activities[J].J Neurosci,1997,17(14):5 316-5 326.
[3]Matsushita K,Meng W,Wang X,et al.Evidence for apoptosis after intracerebral hemorrhage in rat striatum[J].J Cereb Blood Flow Metab,2000,20:396-404.
[4]包新民,舒斯云.大鼠脑立体定位图谱[M].北京:人民卫生出版社,1991:35.
[5]Yang GY,Bets AL,Chenevert TL,et al.Experimental intrac-erebral hemorrhage:relationship between brain edema,blood flow,and blood-brain barrier permeability in rats[J].J Neurosurg,1994,81(1):93-102.
[6]Kazui S,Minematsu K,Yamamoto H,et al.Predisposing factors to enlargement of spontaneous intracerebral haematoma[J].Stroke,1997,28:2 370-2 375.
[7]Ghobrial IM,Witzig TE,Adjei AA,et al.Targeting apoptosis pathways in cancer therapy[J].CA Cancer J Clin,2005,55:178-194.
[8]Fan TJ,Han LH,Cong RS,et al.Caspase family proteases and apoptosis[J].Acta Biochimica et Biophysica,2005,37(11):719-727.
[9]Passero S,Rocchi R,Rossi S,et al.Seizures after spontaneous supratentorial intracerebral hemorrhage[J].Epilepsia,2002,43:1 175-1 180.
[10]Krajewski S,Tanaka S,Takayame S,et al.Investigation of the subcellular distribution of bcl-2oncoprotein[J].Cancer Res,1993,53:4 701.
[11]Li Y,Chopp M,Zhang ZG,et al.p53-immunoreactive protein and p53mRNA expression after trasient middle cerebral artery occlusion in rats[J].Stroke,1994,25:849.
[12]Mutch NJ,Robbie LA,Booth NA.Human thrombi contain an abundance of active thrombin[J].Thromb Haemost,2000,86:1 028-1 034.

