克罗卡林对急性脑缺血再灌注大鼠的脑保护作用
冯 涛 娄季宇 白宏英 杨霄鹏 曾志磊 王金兰
郑州大学第二附属医院神经内科 郑州 450014
脑缺血再灌注后损伤是引起缺血性脑血管病(ischemic cerebrovascular disease,ICVD)脑功能损害的重要原因。已知很多因素参与再灌注后损伤的过程,其中炎症反应促进了继发性脑损伤。小胶质细胞(microglia,MG)是脑内的主要免疫效应细胞,生理状况下它对维持脑内环境稳态起重要作用,当脑内发生病理损害时迅速激活产生大量神经毒性因子,加速神经元的死亡。K-ATP通道开放剂Cromakalin以细胞内的ATP/ADP水平为门控因素、非电压依赖性的特殊钾离子通道,广泛存在中枢神经系统内。它的激活是机体缺血缺氧状态下的自我保护机制,可以对抗损害因子对机体的伤害,若早期用开放剂打开这类通道,可以减轻脑缺血缺氧对神经元的损害。
本研究旨在利用大鼠MCAO模型,观察大鼠急性脑缺血再灌注后海马区CA1区OX42、iNOS的表达情况,神经元特异性尼氏染色法检测神经元数目及Cromakalin干预后的变化,为K-ATP通道开放剂尽早应用于临床治疗ICVD提供理论依据。
1 材料与方法
1.1 材料、试剂及仪器SD大鼠由郑州大学实验动物中心提供。图像采集:德国Lecia显微照像系统。Cromakalin,Sigma美国。分析系统:上海山富科学仪器有限公司,Biosens Digital Imaging。System v1.6。OX42、iNOS抗体:北京中杉生物工程公司。
1.2 方法
1.2.1 动物分组:72只雄性SD大鼠,体质量(220±30)g随机分为3组:A组为假手术组,B组为单纯缺血再灌注组,C组为克罗卡林干预组,每组24只分6h、24h、72h、7d时间点,每个时间点各6只。
1.2.2 动物模型制备:应用改良Zea Longa线栓法制备大鼠MCAO模型。大鼠苏醒后参照Zea Longa 5分制标准[1]进行神经行为学评分,1~3分动物入选。
1.2.3 动物处理:C组在MCAO后2h给予Cromakalin 0.4mg/(kg·d),2mL腹腔注射,B组在MCAO后2 h给予生理盐水2 m L腹腔注射,A组除了不插入线栓其他同B组。达各时间点后,用10%水合氯醛(350 mg/kg)腹腔注射麻醉大鼠,用生理盐水和4%多聚甲醛进行心脏灌注固定,取脑,制作脑部冠状石蜡切片(厚度4μm)。采用免疫组化染色(SP法),检测CA1区OX42、iNOS的表达情况。各组取7d时间点进行海马CA1区神经元尼氏染色,每组取6张切片,在400倍视野下计数神经元。
1.3 统计学方法实验的数据采用均数±标准差(±s)表示,应用SPSS10.0统计软件对实验数据进行统计分析,多组均数间的比较采用单因素方差分析(one-way,ANOVA),均数间的两两比较采用LSD检验,以α=0.05作为显著性检验水准。
2 结果
2.1 海马CA1区OX42的表达情况A组、B组、C组各时间点海马CA1区OX42均有表达,A组4个时间点OX42变化不明显,B、C两组OX426h开始表达,24 h明显增多,72h达高峰,7d仍有表达,明显高于A组各时间点(P<0.05),C组时间点表达均少于B组(P<0.05)。结果见表1。
表1 各时间点海马CA1区OX-42的平均积分光密度的变化±s)
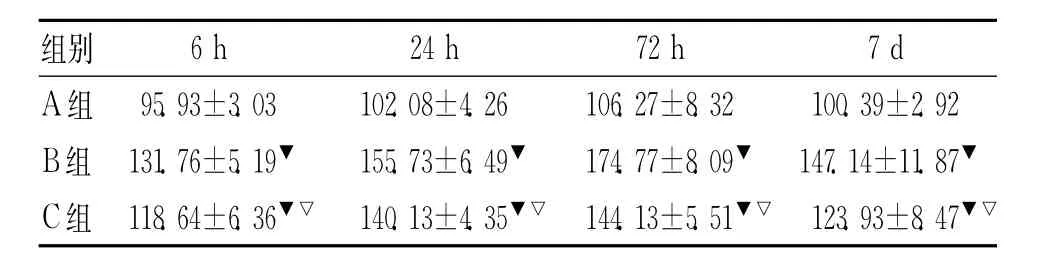
表1 各时间点海马CA1区OX-42的平均积分光密度的变化±s)
注:▼与 A组相比,P<0.01;▽与B组相比,P<0.01
组别6 h 24 h 72 h 7 d A组 95.93±3.03 102.08±4.26 106.27±8.32 100.39±2.92 B组 131.76±5.19▼ 155.73±6.49▼ 174.77±8.09▼147.14±11.87▼C组 118.64±6.36▼▽140.13±4.35▼▽144.13±5.51▼▽123.93±8.47▼▽
2.2 海马CA1区iNOS表达情况A组、B组、C组各时间点海马CA1区iNOS均有表达,A组4个时间点iNOS变化不明显,B、C两组6 h开始表达,24 h明显增多。72 h达高峰,7 d仍有表达,明显高于A组各时间点(P<0.05)。C组各时间点表达均少于B组(P<0.05)。结果见表2。
表2 各时间点海马CA1区iNOS的平均积分光密度的变化±s)

表2 各时间点海马CA1区iNOS的平均积分光密度的变化±s)
注:▼与A组相比,P<0.01;▽与B组相比,P<0.01
组别6 h 24 h 72 h 7 d A组 93.52±4.16 100.24±6.84 103.38±4.88 98.50±3.72 B组 127.47±3.77▼ 161.97±8.29▼170.86±10.21▼ 146.66±5.97▼C组 115.05±8.27▼▽133.64±7.59▼▽142.43±4.82▼▽121.60±5.97▼▽
2.3 海马CA1区神经元变化情况A组神经元(60.66±6.62)个,B组神经元(11.50±3.08)个,即在大鼠缺血再灌注7d时,海马CA1区神经元的死亡数目是原有数目的81.1%,存活数目是原有数目的18.9%。C组神经元(29.33±4.88)个,即在大鼠缺血再灌注7d时,海马CA1区神经元存活数目是原有数目的48.4%,即保护了29.5%的神经元免于死亡。三组之间差异有明显统计学意义(P<0.05),结果见表3。
表3 神经元尼氏染色±s,个/400倍视野)

表3 神经元尼氏染色±s,个/400倍视野)
注:▼与A组相比,P<0.01;▽与B组比,P<0.01
组别 n 神经元数目A组6 60.66±6.62 B组 6 11.50±3.08▼C组 6 29.33±4.88▼▽
3 讨论
近些年来随着影像学在神经科的广泛应用,特别是头颅MRI及DWI在临床的广泛应用,急性脑梗死后2h内即可在影像学上发现缺血病灶,为临床上早期溶栓治疗提供了可靠的依据,脑缺血再灌注损伤也是不能避免[2]。再灌注损伤涉及到多个病理生理环节,其中炎症反应促进了继发性脑损,是缺血再灌注损伤的重要原因之一。在哺乳动物中,海马CA1区神经元是脑部缺血容易损伤的区域之一,所以海马CA1是研究者经常选择观测脑部病理变化的区域之一。
MG在颅内分布比较广泛,是颅内的主要免疫效应细胞,大约占胶质细胞的5%~20%[3]。在生理状态下对神经元有营养、支持、保护等重要作用,对颅内环境有免疫监视和宿主防御的作用。同时MG对颅内的内环境改变及其敏感,特别是感染和创伤时迅速被激活,形态上由静息时的分支状到活化的阿米巴样,细胞胞体增大,并产生大量的神经毒性因子,对神经元产生毒性作用,加重对脑部的损害。因此抑制MG的过度激活,具有脑保护作用。另激活的MG是iNOS的主要来源。iNOS是人体内一种重要的合酶,在生理条件下并不表达,只在病理情况下如脑缺血再灌注损伤时,iNOS可以出现在炎性细胞、神经元、神经胶质细胞及微血管内皮细胞中,一旦诱导合成,就持续大量产生一氧化氮(NO)。NO是一种化学性质活泼的自由基,兼有细胞毒性作用,过量持续的表达是脑缺血再灌注损伤的一个重要因素,因此iNOS是脑缺血再灌注损伤产生过量NO的基础。
K-ATP通道是1983年Noma[4]首先发现存在于豚鼠心肌细胞膜上,现已经证明它也广泛存在中枢神经系统中,同样也存在小胶质细胞上。在正常生理状态下脑内的K-ATP通道处于关闭状态,当机体出现缺血缺氧、炎症反应等时,KATP通道开放,钾离子大量外流,细胞出现超极化状态,神经元的兴奋性降低,调节钙离子的平衡,稳定线粒体膜电位,抑制凋亡等,是机体的一种重要自我保护机制。本实验观察应用K-ATP通道开放剂Cromakalin干预大鼠脑缺血再灌注后不同时间点OX42、iNOS表达的变化,发现应用Cromakalin干预后,OX42、iNOS的表达明显低于脑缺血再灌注组,海马CA1区神经元存活数目Cromakalin干预组明显多于非干预组。说明K-ATP通道开放剂Cromakalin可通过抑制小胶质细胞的过度激活、iNOS的过度表达,保护脑缺血大鼠海马CA1区神经元迟发性死亡等方面保护神经元,从而起到脑保护的作用。
[1]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(l):84-91.
[2]李建章,主编.神经科医师手册[M].北京:人民卫生出版社,2010:161-183.
[3]彭玲梅,黄泳.小胶质细胞在阿尔茨海默病炎性反应中的双重作用[J].医学综述,2009,15(19):2 889-2 890.
[4]Noma A.ATP-regulated K+channels in cardiac muscle[J].Natuer,1983,305(5930):147-148.

