芽孢杆菌制剂和甘露聚糖制剂对家兔肠道生长抑素的影响
陈 岗,沈 洁
(1.四川省自贡市动物疫病预防控制中心,四川 自贡 626000;2.四川省自贡市农业广播电视学校,四川 自贡 626000)
1 材料与方法
1.1 材料
1.1.1 试验动物及基础日粮 48只40日龄断奶加利福尼亚兔,雄性,预试5 d后,体重为750±101 g,购自自贡市畜牧局种畜场。试验基础日粮参照家兔的营养需要,其配方见表1。饲养标准:粗蛋白质16.402 g/d·只,粗纤维10.460 g/d·只,消化能10.287MJ/d·只。
1.1.2 芽孢杆菌制剂和低聚糖 芽孢杆菌PAS38制剂:由自贡市动物疫病预防控制中心实验室研制,含菌量为109cfu/g;β-甘露聚糖制剂:购自湖北某生物工程有限公司,浓度>99%。

表1 家兔基础日粮配方 %
1.1.3 实验器材 玻片、石蜡切片机、Nikon显微镜、温箱、HC-TP-12型架盘天平、EPSON扫描仪。
1.1.4 试剂与药品 Mouse Anti-rabbit Somatostatin、SABC免疫组化试剂盒、DAB,均由武汉博士德生物工程有限公司提供;PBS缓冲液 0.02 M、pH 7.6,NaH2PO4·2H2O 0.5 g,Na2HPO4·12H2O 7 g,NaCl 9 g,D.D.W.1000mL,4%多聚甲醛磷酸缓冲液。
1.2 方法
1.2.1 试验分组及管理 将48只40日龄加利福尼亚兔随机分为芽孢(0.1%蜡样芽孢杆菌)组(Bacillus Group,简称 BG)、寡糖(0.15%β-甘露聚糖)组(Oligos Group,简称 OG)、混合(0.1%蜡样芽孢杆菌+0.15%β-甘露聚糖)组(Mix Group,简称 MG)、对照组(Control Group,简称CG),每组12只,见表2。饲喂时间为50d,其中预试期5 d,正式试验45 d。早上8∶00和晚上18∶00各喂一次饲料。日粮每天按组分别称量饲喂,并将前次未采食完的日粮全部收集,晒干称重。自由饮水,中午给予同样质量的青贮饲料。兔舍上午下午各打扫一次,保持兔舍内空气新鲜,每日平均温度维持在26±2℃,保持周围环境安静,做好记录。

表2 试验家兔分组情况
1.2.2 标本制备 所有实验动物于正式饲喂第15、30、45日早上8∶00空腹称重后各组宰杀4只,采取空肠、十二指肠各一段,放入4%多聚甲醛中固定24 h,制成5μm厚石蜡切片,用APES处理载玻片,用于生长抑素(SS)免疫组化分析。
1.2.3 免疫组织化学染色方法 石蜡切片脱蜡至水,用3%H2O2阻断内源性过氧化物的活性10min,微波修复抗原1~2次,正常山羊血清封闭非特异性背景20min,依次加入一抗(Mouse Anti-Rabbit Somatostatin抗体浓度1∶200,4℃过夜),二抗(生物素标记的山羊抗兔血清,室温下20min),SABC复合物(室温 20min),以上各步间均以PBS缓冲液(0.02mol/L pH 7.6)洗3次,DAB显色,苏木素复染,脱水,透明,封片,观察,以细胞膜上出现棕黄色颗粒为阳性反应。用PBS代替一抗作为阴性对照。
1.2.4 显微图像分析及结果处理 在Nikon数码显微镜下观察,拍照。每例动物随机选取5张切片,每张切片选取10个400倍视野计数,选取数据用平均数±标准差(±s)表示,然后运用SPSS13.0统计软件进行方差分析,并用LSD法作显著性比较。
2 结果
SS阳性细胞主要分布在肠绒毛上皮之间,肠腺中分布较少,与文献报道的一致。SS细胞中充满免疫反应阳性物质,尤以基底部及核周围明显,在细胞基底面及侧面细胞膜外可见免疫反应阳性物质溢出,但肠腔及腺腔内未见免疫反应阳性物质。十二指肠内SS免疫反应阳性细胞多呈圆形和椭圆形,多数细胞为开放型,可见细胞的突起伸向腺腔或肠腔面。
2.1 饲料中添加芽孢杆菌和β-甘露聚糖对家兔十二指肠SS阳性细胞的影响 在阳性细胞密度方面,芽孢杆菌组十二指肠中的SS阳性细胞数量比对照组显著减少(P<0.05);饲喂30 d后,与对照组相比,芽孢杆菌组和甘露聚糖组十二指肠中的SS阳性细胞比对照组显著减少(P<0.05),而混合组比对照组极显著减少(P<0.01);饲喂45 d之后,各试验组十二指肠中的SS阳性细胞数量已恢复到正常水平,与对照组比较无显著差异(P>0.05)。结果见表3和图1。
表3 家兔十二指肠中SS阳性细胞密度变化(±s) 个

表3 家兔十二指肠中SS阳性细胞密度变化(±s) 个
注:同列肩标小写字母相隔者表示差异极显著 (P<0.01),标不同小写字母相邻者表示差异显著(P<0.05),标相同字母或未标字母者差异不显著(P>0.05),下同。
组别 15 d 30 d 45 d十二指肠对照组 7.39±1.73a 9.37±1.97a 10.37±2.04芽孢组 5.74±1.60b 7.19±1.88bc 9.69±1.94寡糖组 6.49±1.70ab 7.40±1.87bc 9.92±2.01混合组 6.03±1.61ab 6.50±1.80c 8.72±1.92

图1 各组家兔十二指肠SS阳性细胞数量变化的比较
在平均灰度值方面,饲喂15 d后,3个试验组十二指肠中的SS阳性细胞平均灰度值与对照组相比无显著差异(P>0.05);饲喂30 d后,3个试验组十二指肠中的SS平均灰度值比对照组显著升高(P<0.05);饲喂45 d之后,各试验组十二指肠中的SS阳性细胞平均灰度值已接近对照组水平,与对照组比较无显著差异(P>0.05)。结果见表4和图2。
表4 家兔十二指肠中SS阳性细胞平均灰度变化(±s)
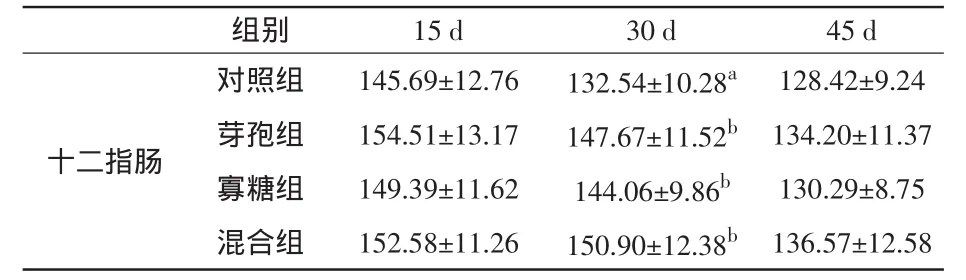
表4 家兔十二指肠中SS阳性细胞平均灰度变化(±s)
组别 15 d 30 d 45 d十二指肠对照组 145.69±12.76 132.54±10.28a 128.42±9.24芽孢组 154.51±13.17 147.67±11.52b 134.20±11.37寡糖组 149.39±11.62 144.06±9.86b 130.29±8.75混合组 152.58±11.26 150.90±12.38b 136.57±12.58
2.2 饲料中添加芽孢杆菌和β-甘露聚糖对家兔空肠SS阳性细胞的影响 在阳性细胞密度方面,饲喂15d后,3个试验组空肠中的SS阳性细胞数量均比对照组显著减少(P<0.05);饲喂30 d后,与对照组相比,甘露聚糖组空肠中的SS阳性细胞数量显著减少(P<0.05),芽孢杆菌组和混合组空肠中的SS阳性细胞数量极显著减少(P<0.01);饲喂45 d之后,芽孢杆菌组和甘露聚糖组空肠中的SS阳性细胞数量已经恢复到正常水平,而混合组与对照组相比,仍有显著差异(P<0.05)。结果见表5和图3。

图2 各组家兔十二指肠SS阳性细胞平均灰度值变化的比较
表5 家兔空肠中SS阳性细胞密度变化(±s) 个

表5 家兔空肠中SS阳性细胞密度变化(±s) 个
组别 15 d 30 d 45 d空肠对照组 7.09±1.67a 8.47±1.92a 9.58±2.01a芽孢组 5.36±1.66b 6.04±1.75c 8.96±1.86ab寡糖组 5.40±1.75b 6.51±1.73bc 8.78±1.94ab混合组 5.16±1.69b 5.79±1.79c 7.72±1.80b

图3 各组家兔空肠中SS阳性细胞数量变化的比较
在平均灰度值方面,饲喂15 d后,芽孢杆菌组和混合组空肠中的SS阳性细胞平均灰度值均比对照组显著升高(P<0.05);饲喂30 d后,与对照组相比,甘露聚糖组的平均灰度值显著升高(P<0.05),芽孢杆菌组和混合组极显著升高(P<0.01);饲喂45 d之后,芽孢杆菌组和甘露聚糖组空肠中的SS阳性细胞平均灰度值已经接近对照组水平,而混合组与对照组相比,仍有显著差异(P<0.05)。结果见表6和图4。
表6 家兔空肠中SS阳性细胞平均灰度变化(±s)
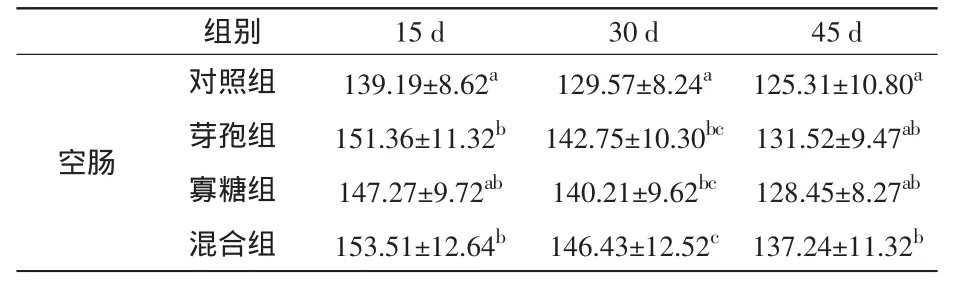
表6 家兔空肠中SS阳性细胞平均灰度变化(±s)
组别 15 d 30 d 45 d空肠对照组 139.19±8.62a 129.57±8.24a 125.31±10.80a芽孢组 151.36±11.32b 142.75±10.30bc 131.52±9.47ab寡糖组 147.27±9.72ab 140.21±9.62bc 128.45±8.27ab混合组 153.51±12.64b 146.43±12.52c 137.24±11.32b
3 分析与结论

图4 各组家兔空肠SS阳性细胞平均灰度值变化的比较
生长抑素(Somatostatin,SS)阳性细胞分布很广泛,不仅存在于中枢神经系统,而且存在于所有动物的胃肠道中,是小肠中一种主要的神经内分泌细胞。SS对胃肠道消化吸收及其他内分泌细胞起普遍性的抑制作用,如抑制几乎所有胃肠激素,比如胃泌素、血管活性肠肽、胰泌素和胃动素等;抑制胃肠运动,因此对机体的消化吸收功能有重要影响。SS还可以抑制T淋巴细胞的活动和淋巴细胞免疫球蛋白的合成,SS对IgA合成的抑制作用可高达20%~50%。
本试验采用免疫组织化学方法,用DAB作显色剂对SS阳性细胞进行了标记,结果显示,芽孢杆菌和甘露聚糖均能够使家兔小肠中SS阳性细胞密度降低,从而降低了SS对其他内分泌细胞和胃肠激素的抑制作用,增强了胃肠道的消化吸收功能。从饲喂的各个时期来看,芽孢杆菌组小肠中SS阳性细胞的平均数量均低于甘露聚糖组,说明两者单独使用时,芽孢杆菌对内分泌免疫的调节作用要优于甘露聚糖。
[1]范骏.肠道黏膜免疫[J].国际免疫学杂志,2006,29(2):111-115.
[2]周勤飞,李 浩,王永才.微生态制剂与动物免疫[J].畜禽业,2005,(1):26-27.
[3]Amold R,Lankisch P G.Somatostatin and gastrointe-stinal tract[J].Clin Gastroenterol,1980,(9):733-753.
[4]Larsson L.Gastrointestinal cells producing endocrine,neurocrine and paracrine messengers [J]. Clin Gastroenterol,1980,9:485-516.
[5]Sundler F,Hakanson R,Leander S.Peptidergic nervous systems in the gut[J].Clin Gastroenterol,1980,(9):517-543.
[6]杨 倩,练高建,等.半胱胺对鸡小肠黏膜中分泌型IgA细胞和上皮内淋巴细胞的影响 [J].南京农业大学学报,2002,25(2):89-92.
[7]Stanisz A M,Befus D,Bienenstock.Differential effects of vasoactive intestinal peptide,subsance P,and somato-statin on immunogobulin synthesis and proliferations by lymphocytes from Peyers patches,mesenteric lymph nodes,and spleen[J].J Immunol,1986,136(1):152-156.
[9]Porter P.Adoptive immunization of the neonate by breast factors[A].immunology of breast milk(Ed.by P L Ogra)[J].Reven Press,1979.
[10]Saavedra Y,Vergara P.Somatostatin inhibits intestinal mucosal mast cell degranulation in normal conditions and during mast cell hyperplasia[J].Regul Pept.,2003,111(3):67-75.